
- •Министерство образования и науки
- •Донецкий национальный университет
- •Химический факультет
- •Кафедра неорганической химии
- •Основы неорганической химии
- •Введение
- •Тема 1. Основные понятия и законы химии
- •Рекомендации к изучению теоретического материала
- •1.2 Примеры решения типовых задач
- •Контрольные вопросы
- •5. Предложите способ определения молекулярной массы с помощью других газовых законов.
- •1.3 Лабораторные работы
- •1.3.1 Взвешивание . Определение воды в кристаллогидрате
- •1.3.2 Очистка веществ
- •Контрольные вопросы
- •1.3.3 Определение молекулярной массы диоксида углерода
- •Контрольные вопросы
- •5. Предложите способ определения молекулярной массы с помощью других газовых законов.
- •Контрольные вопросы
- •1.4 Задачи для самостоятельного решения
- •Тема 2. Растворы. Способы выражения концентрации растворов
- •2.1 Рекомендации к изучению теоретического материала
- •2.2 Примеры решения типовых задач
- •2.3 Лабораторная работа Приготовление растворов
- •Варианты индивидуальных заданий
- •Контрольные вопросы
- •2.4 Задачи для самостоятельного решения
- •Тема 3. Классы неорганических соединений
- •3.1 Рекомендации к изучению теоретического материала
- •3.2 Задания для самостоятельного решения
- •Тема 4. Строение атома и периодический закон д. И. Менделеева
- •4.1 Рекомендации к изучению теоретического материала
- •4.2 Примеры решения типовых задач
- •4.3 Задачи для самостоятельного решения
- •Тема 5. Химическая связь
- •5.1 Рекомендации к изучению теоретического материала
- •5.2 Примеры решения типовых задач
- •5.3 Задания для самостоятельного решения
- •Тема 6. Равновесия в растворах электролитов
- •6.1 Рекомендации к изучению теоретического материала
- •6.1.1 Слабые электролиты. Константа и степень диссоциации
- •6.1.2 Сильные электролиты. Активность ионов
- •6.1.3 Ионное произведение воды. Вычисление рН растворов сильных и слабых кислот и оснований
- •6.1.4 Гетерогенные равновесия. Произведение растворимости
- •6.1.5 Обменные реакции в растворах электролитов. Гидролиз солей
- •6.2 Примеры решения типовых задач
- •6.3 Лабораторные работы
- •6.3.1 Равновесия в растворах электролитов
- •Контрольные вопросы
- •6.3.2 Произведение растворимости
- •Контрольные вопросы
- •6.4 Задачи для самостоятельного решения
- •Тема 7. Окислительно-восстановительные реакции
- •7.1 Рекомендации к изучению теоретического материала
- •7.3 Лабораторная работа Окислительно-восстановительные реакции
- •Контрольные вопросы
- •7.3 Задания для самостоятельного решения
- •Тема 8. Комплексные соединения
- •8.1 Рекомендации к изучениею теоретического материала
- •8.1.1 Состав и номенклатура комплексных соединений
- •8.1.2 Равновесия в растворах комплексных соединений
- •8.2 Примеры решения типовых задач
- •8.3 Лабораторная работа
- •Контрольные вопросы
- •8.4 Задачи для самостоятельного решения
- •Тема 9. Химия элементов
- •9.1 Рекомендации к изучению теоретического материала
- •9.2 Неметаллы
- •Контрольные вопросы
- •9.3 Общая характеристика металлов
- •Контрольные вопросы
- •9.4 Лабораторные работы
- •1. Неметаллы
- •3. Определение свинца методом фотоколориметрии
- •4. Определение жесткости воды
- •Контрольные вопросы
- •5. Йодометрия
- •Варианты индивидуальных заданий Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •1. Смесь хлорида и иодида кальция массой 2 г растворили в воде. Через
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Произведение растворимости малорастворимых веществ
- •Список рекомендуемой литературы
8.1.2 Равновесия в растворах комплексных соединений
Внешнесферная диссоциация комплексных солей происходит в водных растворах практически полностью, например: [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl.
Эта диссоциация называется первичной. Обратимый распад внутрен-ней сферы комплексного соединения называют вторичной диссоциацией. Например, ион диамминсеребра диссоциирует ступенчато по схеме:
[Ag(NH3)2]+ ⇄ [Ag(NH3)]+ + NH3 первая ступень;
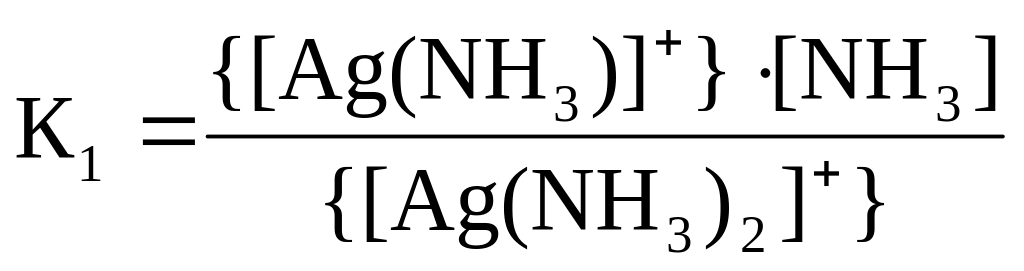 ;
;
[Ag(NH3)]+ ⇄ Ag+ + NH3 вторая ступень;
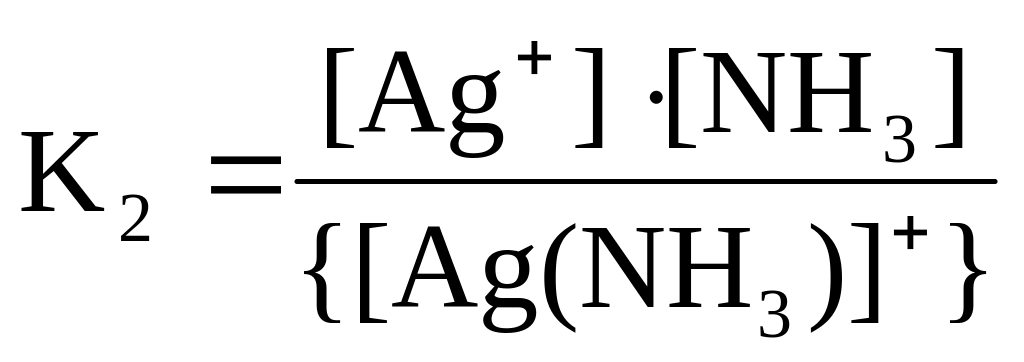 .
.
Суммируя две стадии диссоциации, получаем в общем виде выраже-ние для константы равновесия, называемой константой нестойкости ком-плексного иона:
[Ag(NH3)2]+ ⇄ Ag+ + 2NH3
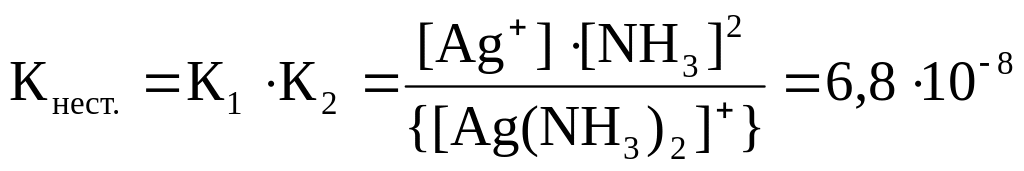 .
.
Величину, обратную константе нестойкости, называют общей кон-стантой устойчивости. Очевидно, чем большую устойчивость проявляет комплексный ион, тем меньше его константа неустойчивости и больше константа устойчивости.
Сравнение величин константы равновесия дает возможность количест-венно обосновать направление смещения равновесия в системах, содержа-щих комплексные ионы. Так, в реакции
[HgCl4]2 + 4J ⇄ [HgJ] + 4Cl
K=8,510 K=1,510
равновесие практически полностью смещено в сторону образования значительно более устойчивого комплексного иона [HgJ4].
8.2 Примеры решения типовых задач
Задача 1. Назвать комплексные соединения:
Решение
[PtCl3(NH3)3]Br трихлоротриамминплатины (IV) бромид;
Ba[Cr(SCN)4(NH3)2]2 бария тетратиоцианатодиамминхромат (III);
[CoF3(H2O)3] трифторотриаквокобальт;
[Pd(NH3)4][PdCl(NO2)3] тетраамминпалладия (II) тринитрохлоропалладат (II).
Задача 2. Химические названия желтой и красной кровяной соли: калия гексацианоферрат (II) и калия гексацианоферрат (III). Написать формулы этих солей.
Решение. K4[Fe(CN)6] и K3[Fe(CN)6].
Задача 3. Координационное число кобальта (III) равно шести. Соста-вить возможные формулы комплексного соединения CoBr3 4NH3 2H2O.
Решение. [CoBr2(NH3)4] Br2H2O; [Co (H 2O)2 (NH3)4] Br3;
[CoBr (H 2O )(NH3)4] Br2 H 2O.
Задача 4. Вычислить концентрацию ионов Ag+ в 0,1 М растворе
[Ag(NH3)2]NO3, содержащем дополнительно 1 моль/л аммиака. Константа не-устойчивости иона [Ag(NH3)2]+ составляет 6,8108.
Решение. Так как комплексная соль диссоциирует на внешнюю и внут-реннюю сферы как сильный электролит по схеме: [Ag(NH3)2]NO3 ⇄ [Ag(NH3)2]+ + NO3, то концентрация аммиачного комплекса в растворе при-нимается равной комплексной соли – 0,1 моль/л. Определим равновесные концентрации ионов комплексной частицы в присутствии аммиака:
СМ , моль/л [Ag(NH3)2]+ ⇄ Ag+ + 2NH3
Исходная 0,1 - 1,0
В диссоциации х х х
В равновесии (0,1 – х) х (1,0+х)
Согласно
условию задачи
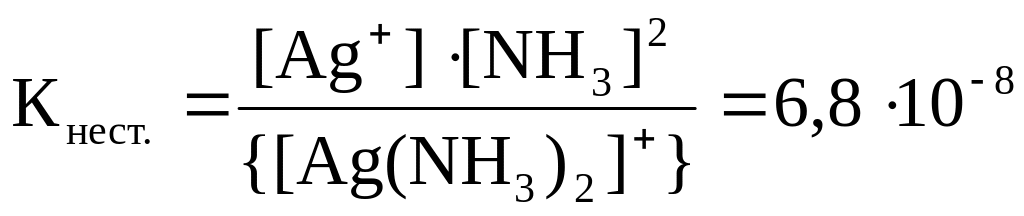 .
В присутствии избыточного NH3
равновесие диссоциации [Ag(NH3)2]+
⇄
Ag+
+ 2NH3
настолько сильно смещено влево, что
можно пренебречь той ничтожно малой
концентрацией аммиака, которая получается
за счет диссоциации комплекса, и принять
ее равной 1 моль/л. Считая [Ag(NH3)2]NO3
сильным электролитом и пренебрегая той
долей комплексных ионов, которые
подверглись диссоциации, можно приравнять
концентрацию недиссоциированной части
ионов [Ag(NH3)2]+
к общей концентрации этих ионов, т.е.
0,1 моль/л. Отсюда
.
В присутствии избыточного NH3
равновесие диссоциации [Ag(NH3)2]+
⇄
Ag+
+ 2NH3
настолько сильно смещено влево, что
можно пренебречь той ничтожно малой
концентрацией аммиака, которая получается
за счет диссоциации комплекса, и принять
ее равной 1 моль/л. Считая [Ag(NH3)2]NO3
сильным электролитом и пренебрегая той
долей комплексных ионов, которые
подверглись диссоциации, можно приравнять
концентрацию недиссоциированной части
ионов [Ag(NH3)2]+
к общей концентрации этих ионов, т.е.
0,1 моль/л. Отсюда
![]() моль/л.
моль/л.
