
- •2 Тарау энзимология негіздері Ферменттер (энзимдер): құрылысы, қасиеттері, жіктелуі, номенклатурасы. Метаболизм процесстерін реттеуі.
- •2.2. Ферменттердің әсер ету жағынан бейорганикалық катализаторлармен ұқсастықтары:
- •2.3. Ферменттер мен бейорганикалық катализатор-лардың айырмашылықтары:
- •2.4. Ферменттің активті орталығы : әсер ету арнайлығы
- •2.5.Ферменттердің әсер ету механизмі
- •2.6. Кофакторлар және коферменттер
- •2.7. Ферменттердің жіктелуі мен номенклатурасы
- •2.8. Ферментативті катализдің кинетикасының негіздері
- •2.9.1. Температураның әсері
- •2 .6 Сурет – Ферментативті реакция жылдамдығының (V)температураға тәуелділігі
- •2.9.2. Орта рН-ның әсері
- •2.7.Сурет. Ферментативті реакцияның жылдамдығының ортаның рН на тәуелділігі.
- •2.9.3. Субстрат пен ферменттің концентрацияларының әсері.
- •2.9.4. Реттеуші заттардың әсері.
- •2.9.5.Фермент белсенділігінің ингибиторлары
- •2.7 Сурет. Фермент белсенділігін бәсекелес ингибирлеу сызбанұсқасы.
- •2. Конкурентті емес қайтымды ингибирлену
- •2.15. Сурет. Дфф-тің көмегімен химотрипсиннің белсенділігінің арнайылықты ингибирленуі.
- •2.16. Сурет. Фермент активтілігінің йод ацетатымен арнайылығы жоқ ингибирленуі
- •2.10. Ферменттер активтілігінің реттелуі
- •2.2. Кесте. Ферментативті реакциялар жылдамдықтарының реттелу жолдары
- •2. Белок-белокпен әрекеттесу көмегімен реттелуі
- •2.20 Сурет. Протеинкиназа а (пка) белсенділігін белок-белоктық әрекеттесу көмегімен реттеу.
- •3. Фосфорлану-дефосфорлану жолымен ферменттің каталитикалық белсенділігін реттеу.
- •4. Ферменттердің каталитикалық белсенділігін шектеулі протеолизбен реттеу.
- •2.11. Ферменттердің медицинада қолданылуы
- •2.11.1. Энзимодиагностика
- •2.11.2. Энзимотерапия
- •2.11.3. Энзимопатиялар
- •2.8 Кесте. Миокард инфарктісі ауруының креатинкиназа (кк), аспартатаминотрансфераза (аст) және лактатдегидрогеназа(лдг) ферменттерінің анализінің нәтижелері.
- •Квантталған текстер
- •Ферменттер
- •Ферменттердің формалары.
- •Ферменттердің активтілігіне әсер ететін факторлар
- •Ферменттердің 1- класы- оксидоредуктазалар
- •Дегидрогеназалар (дг)
- •Дегидрогеназалар Пиридиндік ферменттер (пф)
- •Флавиндік ферменттер (фп)
- •Убихинон – коферментQ (KoQ10)
- •Убихинон(KoQ10) химиялық табиғаты жағынан 6-жағдайында изопреннің қалдығы бар (10 молекуласы) 2,3-диметокси-5-метил-1,4-бензохинонға жатады. KoQ дың апоферменті жоқ.
- •Цитохромдық жүйенің ферменттері Цитохромдардың құрылысы
- •Гидроксилазалар мен оксигеназалар
- •2)Диоксигеназалар
- •Каталаза
- •Пероксидазалар
2. Конкурентті емес қайтымды ингибирлену
Конкурентті емес ингибираторлар субстраттың құрылымына ұқсас болмайды. Конкурентті емес қайтымды ингибирлену кезінде субстрат S және ингибитор I әртүрлі орталықтармен байланысады (2.11-сурет), сондықтан EI комплексінің түзілуімен қатар, EIS үштік комплексі түзілу мүмкіндігі пайда болады; EIS комплексі ЕS комплексіне қарағанда төмен жылдамдықпен ыдырайды.

Осы конкуренттік емес ингибирлену көбінесе бірнеше субстраттардың өзгерістерін катализдейтін ферменттерде байқалады. Бұл кезде ингибитордың байланысуы субстраттың активті орталықпен байланысуына кедергі жасамайды, еркін ферментпен қалай байланысса, ES- комплексіменде солай байланысады. (Т.Т. Березов, Б.Ф. Коровкин, 1990). Конкурентті емес ингибитор Кm –ді өзгертпейді және V max-ті төмендетеді.
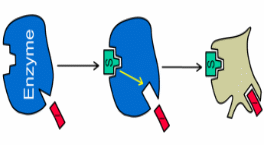
2.11-сурет. Фермент белсенділігінің конкурентті емес ингибирленуінің сызбанұсқасы.
Тірі жасушада түзілетін метаболизмнің аралық өнімдері едәуір маңызды бәсекелес емес ингибиторлар болып табылады. Олар ферменттің белгілі бөліктерімен қайтымды байланыса отырып (аллостерикалық орталықтар), ферменттің белсенділігін өзгертеді. Бұл метаболизмнің реттелу жолының бірі болып есептеледі. Мысалы, треониндегидратазаның изолейцинмен ингибирленуі (А. Ленинджер, 1985).
Ингибирлеудің осы түріне реакция өнімдерімен ингибирлену жатады. Көбіне реакция өнімдері субстраттарға ұқсас келеді. Мысалы, глюкоза-6-фосфатазаның субстраты глюкоза-6-фосфат, ал өнімі глюкоза.
Кинетикалық тестілер бәсекелес ингибирленуді бәсекелес еместен ажыратуға мүмкіндік береді.
2.13-сурет. I/V –нің I/S-ке тәуелділігі. 1-ингибиторсіз, 2 –ингибитор қатысуымен (а – конкурентті; б–конкурентті емес ингибирлену) |
Б. Қайтымсыз ингибирлену
Қайтымсыз ингибирлену фермент пен ингибитор молекуласы арасындағы берік ковалентті байланыс түзілгенде байқалады. Көбінесе ферменттің активті орталығы түрөзгеріске ұшырайды, нәтижесінде фермент каталитикалық қызметін атқара алмайды. Қайтымсыз ингибиторларға ауыр металл иондарын жатқызуға болады, мысалы сынап ( Hg2+), күміс (Ag+) және мышьяк (As3+), олар аз концентрацияда белсенді орталықтардың сульфгидрильді топтарын жауып тастайды. Сульфгидрильді топтар ферменттің активті орталығында, немесе одан тыс орналасуы мүмкін. Субстрат бұл кезде химиялық өзгеріске ұшырамайды. (2.14-сурет). Ферменттің атқаратын қызметі реактиваторлар болғанда қалпына келеді. Жоғары концентрацияларда ауыр металлдардың иондары ферменттің белок молекуласын денатурацияға ұшыратады, басқаша айтқанда, ферменттің толық инактивациясын тудырады.

2.14-сурет. Сынап иондарының қайтымсыз ингибитор ретінде әсер ету механизмі.
Аз концентрациялы сынап иондары активті орталықтың сульфгидрильді топтарын тежейді, бұл ферментативті реакциялардың жылдамдығының төмендеуіне әкеліп соғады.
Қайтымсыз ингибиторлар бірдей дәрежеде Km мен Vmax-ті төмендетеді.
|
|
|
А. Қайтымсыз ингибиторлардың қолданылуы ферменттердің әсер ету механизмін анықтауда үлесі зор. Активті орталықтың белгілі топтарын тежейтін қосылыстар бір активті орталық құрылысы туралы маңызды ақпаратты береді. Мұндай ингибиторларды арнайылығы бар деп атайды. Диизопропилфторфосфат (ДФФ) арнайылығы бар ингибиторлар қатарына жатқызылады. ДФФ ферменттің активті орталығындағы сериннің -ОН тобымен ковалентті байланыс түзеді. ДФФ «сериндік» ферменттердің арнайылығы бар қайтымсыз ингибиторларына жатқызылады, өйткені олар катализге тікелей қатысады (2.15-сурет). ДФФ-ті энзимологияда ферменттердің активті орталықтарының құрылымын зерттеу мақсатында қолданады. Диизопропилфторфосфат – нейрондардың жүйке импульстарды өткізу қасиетінен айырылуына әкелетіндіктен, жүйке-паралитикалық әсерлі улы заттардың бірі болып табылады.


