
- •Оборотні зміни:
- •Необоротні зміни:
- •2) Специфіка фібрилярного білка амілоїду дозволяє виділити al-, аа-, af- і asc1- амілоїдоз.
- •3)Враховуючи розповсюдження амілоїдозу,
- •1.Надпечінкова (гемолітична):
- •2.Печінкова (паренхіматозна):
- •3.Підпечінкова (механічна):
- •1. Руйнівні:
- •2. Консервувальні:
- •Регенерація крові
- •Регенерація судин
- •Регенрація сполучної тканини
- •Утворення «молодої» незрілої сполучної тканини
- •Утворення «дозріваючої грануляційної тканини»
- •Далі зріла грануляційна тканина рубцеву тканина
- •Грануляційна тканина (макро і мікроскопія)
- •Регенерація жирової тканини
- •Регенерація кісткової тканини
- •Регенерація хрящової тканини
- •Регенерація епітелію
- •Регенерація нервової тканини
- •Загоювання ран
- •Безпосереднє закриття дефекту епітеліального покриву
- •Загоювання під струпом
- •Загоювання рани первинним натягом
- •Загоювання вторинним натягом (загоювання через нагноєння або загоювання за допомогою гранулювання)
- •Класифікація ексудативного запалення
- •Морфологічна характеристика склеромної гранульоми.
- •Механізми розвитку реакцій гіперчутливості
- •Надгостре:
- •Гостре:
- •Хронічне:
- •Класифікація кровотеч
- •Повітряна емболія – це патологічний процес в організмі, при якомі відбувається емболізація повітрям мікроциркуляторного русла та судин.
- •Ріст пухлини
- •Принципи класифікації
- •Порівняльна характеристика критеріїв злоякісності і доброякісності
- •Доброякісні пухлини зі сполучної тканини:
- •Доброякісні пухлини з жирової тканини:
- •Доброякісні пухлини з м’язової тканини:
- •Доброякісні пухлини з кровоносних судин:
- •Передракові стани
- •1)Диференціювання клітин:
- •3)Метастазування:
- •4)Вплив на організм:
- •Диференційні ознаки доброякісних і злоякісних пухлин
- •1. Епітеліальні пухлини
- •4. Некласифіковані пухлини
- •1.Епітеліальні пухлини
- •1.Тимоми:
- •Лімфангіосаркома
- •Злоякісна мезотеліома
- •1.Пухлини нейроепітеліальної тканини:
- •2. Пухлини оболонок мозку:
- •Види біопсії
- •Хронічні лейкози лімфоцитарного походження
- •4 Варіанти (стадії):
- •Обмінні (екзо- та ендогенні):
- •Спадковість
- •3) Ускладнені ураження:
- •Атеросклероз артерій нижніх кінцівок
- •Патогенез
- •Етіологія
- •Вплив на дихальну систему –
- •Патогенез
- •Ускладнення
- •Хронічний бронхіт
- •Пневмококи і, іі, ііі і IV типів
- •Диплобацила Фрідлендера (рідко)
- •Некласичні прояви крупозної пневмонії:
- •Загальні прояви крупозної пневмонії:
- •Ускладнення
- •Особливості бронхопневмоній залежно від віку хворих:
- •Морфологічні особливості залежно від виду інфекційного агента:
- •Ускладнення
- •Нагноєння з утворенням абсцесів
- •Плеврит
- •Етіологія
- •Мікоплазми
- •Патоморфологічна характеристика
- •Ускладнення
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика
- •Типові патоморфологічні зміни при бронхоектазах:
- •Ускладнення
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика
- •Варіанти розвитку емфіземи легень:
- •Ускладнення
- •1. Легенева (дихальна) недостатність.
- •2. «Легеневе» серце.
- •3. Хронічна правошлуночкова серцева недостатність.
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика
- •Ускладнення
- •Патогенез
- •Патоморфологічна характеристика
- •Ускладнення
- •Гіпертензія в малому колі кровообігу
- •Гіпертрофія правого серця
- •Серцево-легенева недостатність
- •Класифікація Клініко-анатомічна класифікація раку легені:
- •Етіологія
- •Морфологія
- •Мікроскопічна будова:
- •Ускладнення
- •Метастази – лімфогенні та гематогенні –
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика Клініко-морфологічні форми гострої ангіни:
- •Ускладнення
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика Морфологічні форми езофагіту:
- •Гангренозна
- •Геморагічна
- •Ускладнення
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика Макроскопічні форми раку стравоходу:
- •Мікроскопічні форми раку стравоходу:
- •Метастазування
- •Ускладнення
- •Гастрити
- •Аутоімунний.
- •Етіологія
- •Патоморфологічна характеристика форм
- •Ускладнення
- •Етіологія
- •Екзогенні фактори –
- •Патоморфологічна характеристика форм
- •Хронічний ентерит без атрофії слизової оболонки –
- •Хронічний атрофічний ентерит –
- •Ускладнення
- •Етіологія
- •Інфекційні фактори –
- •Порушення проникності кишкового бар’єру Патогенез
- •Патоморфологічна характеристика форм
- •Ускладнення
- •Етіологія і патогенез
- •Патоморфологічна характеристика
- •Ускладнення
- •Етіологія
- •Патогенез
- •Класифікація
- •IV. За морфологічними змінами:
- •2) Пухлинні
- •3) Запальні
- •2) Пухлинні
- •3) Запальні
- •2) Пухлинні
- •3) Запальні
- •2) Пухлинні
- •3) Запальні
- •Морфологічно:
- •4) Стадія чистих виразок:
- •Загальні зміни:
- •Стадіїї місцевих змін:
- •Ускладнення
- •2. Генералізована форма
- •3. Рідкі форми :
- •Паразитарні інфекції
- •Грип середньої тяжкості
- •Класифікація
- •115. Парагрип – визначення, етіологія, патогенез, клініко-морфологічна характеристика, ускладнення.
- •116. Респіраторно-синцитіальна інфекція – етіологія, патогенез, патоморфологія. Наслідки.
- •117. Аденовірусна інфекція –– визначення, етіологія, патогенез, клініко-морфологічна характеристика, ускладнення.
- •118. Коронавірусна інфекція –– визначення, етіологія, патогенез, клініко-морфологічна характеристика, ускладнення.
- •119. Морфологічні особливості пневмонії обумовленої короновірусною інфекцією.
- •120. Віл інфекція –– визначення, етіологія, патогенез, клініко-морфологічна характеристика.
- •121. Кір: етіологія, патоморфологія, ускладнення. Причини смерті.
- •122. Краснуха. Етіологія, патогенез, морфологічна характеристика, наслідки.
- •123. Скарлатина: етіологія, патоморфологія, ускладнення. Причини смерті.
- •124. Поліомієліт: етіологія, патоморфологія, ускладнення. Причини смерті.
- •125. Дифтерія: етіологія, класифікація, патоморфологія, ускладнення. Причини смерті.
Передракові стани
|
Фонові зміни |
Власне передпухлинні осередки |
|
|
Також виділяють:
Облігатний передрак - той, який майже завжди завершується розвитком рака, частіше пов'язаний зі спадковою схильністю. Це природжений поліпоз товстої кишки, пігментна ксеродерма, нейрофіброматоз (хвороба Реклінгхаузена), нейробластома сітківки ока та ін.
Факультативний передрак – гіперпластично-диспластичні процеси, а також деякі дисембріопзазії.
Вірусна етіологія пухлин, приклади, клінічне значення етіології для профілактики пухлин, приклади.
Онкогенні віруси- ті ,що здатні перетворювати нормальну клітину на пухлинну)
можуть бути
-
ДНК/РНК вірусами
-
Екзогенні
-
-герпесоподібний вірус Епстайна –Бар »лімфома Беркіта
-
вірус герпесу»рак шийки матки
-
вірус гепатиту В»рак печінки
-
Ендогенні(в звичайних умовах складають частину геному,але за певних умов здатні перетворювати клітину на пухлину)
Суть вірусіндукованого канцерогенезу зводиться до того, що онкогенні віруси вносять в інфіковану клітину свій геном, до складу якого входить трансформуючий ген – вірусний онкоген. Продукт його діяльності (онкобілок) розпочинає трансформацію клітини й підтримує її в трансформованому вигляді.
Профілактика вірус індукованих пухлин має на меті максимальну активацію та підтримку імунної системи
-
імуностимулятори
-препарати тимусу та їх синтетичні аналоги
-інтерферони
-рекомбінантний людський інтерлейкін-2
-рослинні препарати (ехінацея,жень-шень)
Хімічний канцерогенез, етапи канцерогенезу, які молекулярні механізми можуть бути задіяні в формуванні пухлини.
Хімічний канцерогенез - складний багатоступінчастий процес утворення пухлини, що відбувається під тривалим впливом хімічних речовин - канцерогенів, в основі якого лежить ураження генів і епігенетичні зміни.
Хімічні канцерогени
-
поліциклічні ароматичні вуглеводи (ПАВ);
-
ароматичні азосполуки
-
ароматичні аміносполуки
-
нітрозо сполуки та нітраміни;
-
металів, металоїдів та неорганічних солей
Ендогенні
Метаболіти триптофану та тирозину
Етапи канцерогенезу
1.Ініціація – це швидкі, незворотні, спадкові зміни гено- типу нормальної соматичної клітини, що відбувають- ся при дії нелетальної дози канцерогену (ініціатора).
2.Промоція – стимуляція проліферації трансформо- ваних клітин та закріплення існуючих мутацій в наступних поколіннях.
3.Прогресія – виникнення додаткових змін у структурі генома, що призводять до появи пухлини, яку ми виявляємо морфологічно, та, яка має властивості інвазійного росту та метастазування.
Генетичні структурні компоненти клітини, що залучені до канцерогенезу
-
Протоонкогени
-
гени-супресори
-
мутаторні гени
Молекулярні механізми
-
точкові мутації»вплив на гени-супресори +активація протоонкогенів
-
рекомбінації генів »активація протоонкогенів
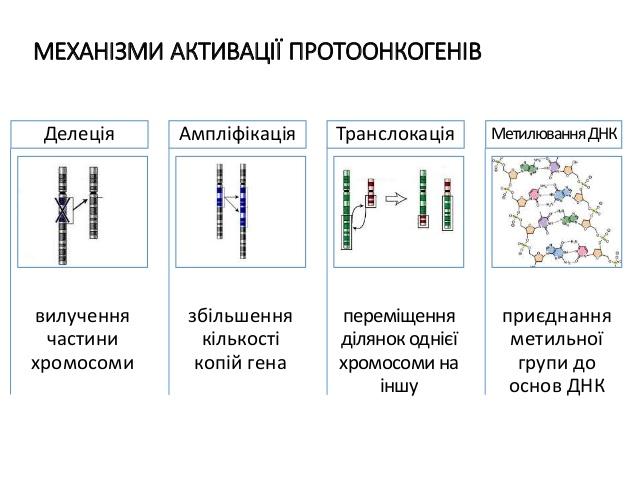
-Делеція
-Ампліфікація
-Транслокація
-Метилування днк
-
інактивація мутаторних генів

Напівзлоякісні пухлини, приклади, морфологічна характеристика.
Напівзлоякісні пухлини – це пухлини, які мікроскопічно мають будову зрілих, але клінічно можуть давати рецидиви, рідше, метастази (десмоїд, фіброма носоглотки, метастазуюча лейоміома). Всі пухлини головного мозку в силу своєї локалізації вважаються потенційно злоякісними (напівзлоякісними).
Місцеводеструктуючі пухлини (раніше їх називали "потенційно злоякісними", "напівзлоякісними") за морфологічними ознаками є доброякісними, але за інфільтративним ростом та клінічним перебігом (з частими рецидивами) більше схожі на злоякісні. До них належать:
-
десмоїдна фіброма (агресивний фіброматоз), які незалежно від розмірів пухлини деякі автори називають фібросаркомою І стадії
-
фіброма носоглотки
-
міжм'язові ліпоми, що дифузно інфільтрують сусідні тканини і рецидивують
-
гігантоклітинні пухлини
-
гемангіоендотеліоми
-
аденоми бронхів.
Десмоїд (десмоїдна фіброма) – сполучнотканинне утворення, що мікроскопічно нагадує фіброму, однак, характеризується інфільтративним ростом. Як правило, зустрічається у жінок після пологів. Розрізняють:
-
абдомінальний десмоїд
-
екстраабдомінальний десмоїд (синонім – агресивний фіброматоз; локалізується у зоні фасцій і апоневрозів, відрізняється швидким інфільтративним ростом, часто рецидивує та малігнізується).
Макроскопічно: побудована з щільної волокнистої сполучної тканини, має щільну або щільнувату консистенцію, росте у вигляді окремих вузлів. На розрізі тверда фіброма білувато-перламутрового кольору.
Мікроскопічно: сполучнотканинні (колагенові) волокна, які щільно прилягають одне до одного, не залишаючи між ними проміжків. В одному полі зору мікроскопа можна бачити різноманітне (хаотичне) направлення волокон так, що одні волокна мають повздовжній напрямок, другі – поперечний, треті – косий. Між окремими волокнами можуть знаходитись окремі стиснуті фібробласти. Окремі сполучнотканинні волокна набряклі, гомогенні, інколи вони ніби зливаються разом.
Доброякісна метастазуюча лейоміома матки (ДМЛ) – рідкісна патологія, що відноситься до доброякісних пухлин і діагностується у жінок оперованих з приводу лейоміоми матки, або які мають цю пухлину на момент обстеження. ДМЛ частіше зустрічається у жінок пізнього репродуктивного та пременопаузального віку, частіше з ураженням легень, хоча описані і інші локалізації метастазів. Цю патологію об`єднує тривалий безсимптомний перебіг, повільний ріст, скудність клінічних проявів до появи ускладнень або порушень бронхіальної прохідності.
Макроскопічно: пухлина, як правило, представлена щільними вузлами в легенях або інших органах різного розміру, сіро-білого кольору, слоїстої структури.
Мікроскопічно: пухлина представлена численними пучками гладком`язових клітин з ділянками фіброза і гіаліноза строми. При цьому відмічається певний поліморфізм елементів пухлини, однак численні мітози відсутні, не визначаються ознаки малігнізації.
Які класифікації пухлин ви знаєте? Наведіть приклади.
Пухлини поділяють на:
-
доброякісні
-
злоякісні.
Існує декілька класифікацій пухлин, серед них виділяють дві основні – TNM і гістогенетичну.
Класифікація TNM
T – tumor (пухлина). Відповідає певному розміру та величині первинної пухлини.
N – node (лімфатичний вузол). Визначає ступінь залучення лімфатичних вузлів у пухлинний процес.
M – metastasis (метастази). Наявність і розмір віддалених метастазів.
T (tumor)
Т0 – ознаки первинної пухлини відсутні.
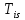 –
пухлина
в межах слизової оболонки (is situ).
–
пухлина
в межах слизової оболонки (is situ).
Т1 – пухлина в межах слизової і підслизової оболонок.
Т2 – уражена серозна оболонка.
Т3 – пухлина проростає через серозну оболонку, сусідні органи не втягнені в процес.
Т4 – пухлина проростає у сусідні тканини.
N (node)
N0 – метастази в лімфатичних вузлах відсутні.
N1 – уражені лімфатичні вузли не далі 3 см від первинної пухлини.
N2 – уражені регіональні лімфатичні вузли далі 3 см від первинної пухлини, але видаляються при операції.
N3 – залучені лімфатичні вузли інших груп.
M (metastasis)
M0 – віддалені метастази відсутні.
М1 – наявність віддалених метастазів.
Визначення стадії пухлинного процесу за TNM класифікацією
Стадія 0: Тis, N0, М0.
Стадія 1: Т1, N0, М0.
Стадія 2: Т 2-3, N0, М0.
Стадія 3: Т 1-3, N 1-2, М0.
Стадія 4: будь-які Т і N при наявності М1.
Додаткові символи та характеристики TNM
pTNM – патогістологічна класифікація (використовується після хірургічного втручання, патологоанатомічного та гістологічного дослідження). Її принципи аналогічні TNM-класифікації пухлин.
-
G – ступінь диференціації пухлинних клітин:
-
G1 – висока
-
G2 – середня
-
G3 – низька
-
Gх – диференціація не підлягає оцінці.
-
L – інвазія лімфатичних судин:
-
L0 – немає ознак інвазії
-
L1 – інвазія поверхневих лімфатичних судин
-
L2 – інвазія глибоких лімфатичних судин
-
Lх – інвазія лімфатичних судин не встановлена.
-
V – інвазія вен:
-
V0 – вени не містять пухлинних клітин
-
V1 – пухлинні клітини виявлені в прилеглих венах
-
V2 – пухлинні клітини виявлені у віддалених венах
-
Vх – інвазія вен не піддається оцінці.
-
r – рецидив (ставлять перед відповідним позначенням TNM).
-
P – глибина проростання пухлини в стінку кишки (визначається при гістологічному дослідженні операційного препарату):
-
P1 – пухлина інфільтрує тільки слизову оболонку
-
P2 – пухлина інфільтрує підслизову оболонку, але не інфільтрує м’язову
-
P3 – пухлина інфільтрує м’язову оболонку без ураження серозної
-
P4 – пухлина проростає всі оболонки стінки кишки та виходить за її межі.
Гістогенетична класифікація
-
Епітеліальні пухлини.
-
Пухлини екзо- й ендокринних залоз і епітеліальних покривів.
-
Мезенхімальні пухлини.
-
Пухлини меланінутворюючої тканини.
-
Пухлини нервової системи й оболонок мозку.
-
Пухлини системи крові.
-
Тератоми.
Також існує класифікація пухлин за співвідношенням паренхіми та строми:
-
Медулярний рак (паренхіма переважає над стромою).
-
Простий рак (паренхіма і строма у однаковій кількості).
-
Скірозний рак (строма переважає над паренхімою)
Пухлини епітеліальні: визначення, класифікація, приклади злоякісних епітеліальних пухлин, критеріїв злоякісності.
Епітеліальні пухлини.
Залежно від гістогенезу розрізняють:
-
пухлини з покривного епітелія (багатошарового плоского та перехідного)
-
залозистого.
За перебігом та диференціюванням епітеліальні пухлини бувають:
-
доброякісні
-
злоякісні.
Залежно від органної специфічності виділяють:
-
органоспецифічні
-
епітеліальні пухлини без специфічної локалізації.
До доброякісних епітеліальних пухлин належать:
1. Папілома. Пухлина з плоского та перехідного епітелію, має кулясту форму, сосочкоподібний вигляд (нагадує квітчасту капусту), м’яка на дотик, легко травмується, запалюється та кровоточить. Папілома найчастіше зустрічається на слизовій оболонці порожнини рота, голосових зв’язок, у мисках нирок, сечоводах, сечовому міхурі. При постійному подразненні може перероджуватися в рак.
2. Аденома. Пухлина залозистих органів і слизових оболонок, що вислані призматичним епітелієм. Має вигляд добре відмежованого вузла м’якої консистенції, на розрізі біло-рожевого кольору, іноді містить кісти. Аденоми зустрічаються в молочній, підшлунковій, передміхуровій та інших залозах. Аденома може перероджуватись в рак. Аденома на ніжці називається поліпом.
Розрізняють такі морфологічні варіанти аденом:
-
ацинозна (альвеолярна)
-
тубулярна
-
трабекулярна
-
солідна
-
сосочкова
-
цистаденома
-
ворсинчаста аденома
-
фіброаденома.
Злоякісні епітеліальні пухлини – називаються рак або карциномами.
До злоякісних епітеліальних пухлин належать:
1. Рак на місці (carcinoma in situ). Росте в межах епітеліального шару, без проростання базальної мембрани і переходу на прилеглі тканини. Визначається мікроскопічно.
2. Плоскоклітинний незроговілий і зроговілий рак. Розвивається в шкірі та слизових оболонках, покритих плоским і перехідним епітелієм (порожнина рота, стравохід, шийка матки, піхва тощо). При зроговінні утворюються ракові «перлини».
3. Аденокарцинома. Розвивається з призматичного епітелію слизових оболонок і епітелію залоз. Аденокарциноми зустрічаються в молочній, підшлунковій, передміхуровій залозах, у стінці шлунка, кишки й ін.
4. Слизовий (колоїдний) рак. Пухлина має вигляд слизової маси. Ракові клітини продукують величезну кількість слизу й гинуть у ній.
5. Солідний рак. Щільна біло-сіра пухлина, росте швидко та рано дає метастази. Співвідношення строми і паренхіми приблизно 50 на 50%.
6. Дрібноклітинний рак. Клітини пухлини нагадують лімфоцити, які не утворюють жодних структур. Пухлина росте швидко, рано дає метастази.
7. Скір (фіброзний рак). Пухлина щільна на дотик (за рахунок переваги в ній строми), високого ступеня злоякісності, рано дає метастази. Часто зустрічається в молочній залозі та шлунку.
8. Медулярний мозкоподібний рак. У пухлині переважає паренхіма над стромою, вона м’яка на дотик, біло-рожевого кольору, нагадує тканину головного мозку. Пухлина високого ступеня злоякісності, часто зазнає некрозу, рано дає множинні метастази.
Аденокарцинома – рак із залозистого епітелію називають залозистим раком, або аденокарцинома. Він зустрічається в органах, де є відповідний епітелій, і може бути також триступеневого диференціювання. Особливою формою низькодиференційованої аденокарциноми є рак-скір, який містить велику кількість фіброзної строми, що стискує паренхіму пухлини.
Недиференційовані форми епітеліальних злоякісних пухлин представлені:
-
дрібноклітинним
-
великоклітинним
-
перснеподібноклітинним
-
медулярним раками.
Епітеліальні пухлини (органоспецифічні).
Хоріонепітеліома – злоякісна пухлина з трофобласту, яка виникає з плаценти після аборта, трубної вагітності та пологів. Пухлина має вигляд строкатого губчастого вузла в міометрії. Хоріонепітеліома може бути і тератогенного походження – в яєчнику, яєчку, середостінні, стінці сечового міхура і такі пухлини називаються ектопічними.
Пухлина складається з:
-
елементів цитотрофобласту
-
синцитіотрофобласту
-
світлих епітеліальних клітин Лангханса
-
гігантских поліморфних темних клітин синцитія.
В пухлині відсутня строма, судини мають вигляд порожнин, які вистелені клітинами пухлини. Це призводить до ранніх метастазів.
Хоріонепітеліома – гормональноактивна, ріст супроводжується виділенням гонадотропіну, який виявляється у сечі хворої.
Пухлини мезенхімальні: визначення, класифікація, приклади злоякісних пухлин кісток, критеріїв злоякісності.
Мезенхімальними називають пухлини, які виникають з елементів (тканин) мезенхімального походження: сполучна тканина, судини, м’язова тканина, кістки, хрящ, синовіальні та серозні оболонки, кровотворна система. Першоджерелом цих пухлин є поліпотентна мезенхімальна клітина. Пухлини можуть складатись з одного виду тканини (фіброзна або жирова) або з декількох (жирова, фіброзна, судинна), в останньому випадку вони називаються мезенхімомами.
Класифікація:
-
пухлини сполучно тканинного походження
-
Судинного походження
-
М‘язового походження
-
Кістково-суглобового походження.
-Остеогенна саркома – надзвичайно злоякісна первинна пухлина кісток. В основному уражуються діти віком понад 5 років. Остеогенна саркома розвивається з поліпотентної сполучної тканини. Переважними клітинними елементами є остеоцити. Залежно від її локалізації в межах кістки розрізняють остеогенні саркоми : центральні, медулярні, параосальні остеосаркоми,множинний остеосаркоматоз, остеосаркоми м'яких тканин.Остеогенна саркома виникає переважно в ділянці метафізів довгих трубчастих кісток, рідше у діафізі та плоских кістках. Найчастіше уражується дистальний метафіз стегнової кістки та проксимальний метафіз великої гомілкової кістки, а також плечова кістка. Для остеогенних сарком типовим є ураження тільки однієї кістки. Метастазування в інші кістки зустрічається рідко.
-Саркома Юінга — пухлина кісток злоякісного характеру. В основному, вражає лопатку, ключицю, таз, ребра, хребет, а також нижню частину трубчастих довгих кісток. Її основу складає не остеогенна, а ретикулоендотеліальна тканина, що заповнює кістковомозковий простір. Частіше страждають діти віком 10-14 років, але може виникати у дітей до 5 років.
Гістологічна та TNM класифікації молочної залози, їх значення.
КЛАСИФІКАЦІЯ ЗА СИСТЕМОЮ TNM:
Т — Первинна пухлина
Тx — недостатньо даних для оцінки первинної пухлини
Т0 — первинна пухлина не визначається
Тis — carcinoma in situ: внутрішньоканальцева або часточкова carcinoma in
situ, або хвороба Педжета соска без ознак пухлини.
Примітка: Якщо при хворобі Педжета визначається пухлина, то вона кла-
сифікується згідно з її розмірами Т1 — пухлина до 2 см у найбільшому вимірі Т2 — пухлина до 5 см у найбільшому вимірі
Т3 — пухлина понад 5 см у найбільшому вимірі
Т4 — пухлина будь-яких розмірів із прямим поширенням на грудну стінку або шкіру
Примітка: Грудна стінка – це ребра, міжреберні м’язи, передній зубчастий
м’яз, за винятком грудних м’язів.
Т4a — із поширенням на грудну стінку
Т4b — із набряком (включаючи симптом “лимонної кірки”), або вираз-
куванням шкіри грудної залози, або сателітними вузлами у шкірі
тієї ж залози
Т4c — критерії Т4a та Т4b разом Т4d — запальна форма раку
Примітка: Втягнення шкіри, ретракція соска та інші шкірні симптоми, крім тих, що
стосуються Т4, можуть спостерігатися при Т1,Т2, Т3, не впливаючи на класифікацію
N — Регіонарні лімфатичні вузли.
Nx — недостатньо даних для оцінки стану регіонарних лімфатичних вузлів
N0 — немає ознак ураження регіонарних лімфатичних вузлів
N1 — виявлені метастази в рухомих аксилярних лімфовузлах на боці уражен-
ня
N2 — виявлені метастази в рухомих аксилярних лімфовузлах на боці уражен- ня,
фіксовані поміж собою або з навколишніми структурами
N3 — виявлені метастази у внутрішніх грудних лімфатичних вузлах на боці
ураження.
М — Віддалені метастази
Мx — недостатньо даних для визначення віддалених метастазів
М0 — віддалені метастази не визначаються
М1 — наявні віддалені метастази
Гістологічна класифікація:
1. Неінфільтруючі:
а) внутріпротоковий рак
б) дольковий рак
2. Інфільтруючі:
а) інфільтруючий протоковий рак
б) інфільтруючий протоковий рак із переважанням внутріпротокового компоненту
в) інфільтруючий дольковий рак
г) залозистий рак
д) медулярний рак
е) папілярний рак
ж) тубулярний рак
з) аденокістозний рак
и) секреторний (ювенільний) рак
к) апокринний рак
л) рак з метаплазією (плоскоклітинного типу, веретеноклітинного типу, хондроїдного та остеоїдного типу, змішаного типу)
м) інші
3. Хвороба Педжета (соска).
Гістологічна та TNM класифікації легень, їх значення.
Гістологічна класифікація всесвітньої організації охорони здоров'я (1981 р.) Дисплазія/карцинома in situ
Плоскоклітинний рак (30%)
МРЛ (18,2%):
• Вівсяноклітинний рак
• Проміжно-клітинний рак
• Комбінований вівсяноклітинний рак Аденокарцинома (30,7%):
• Ацинарна аденокарцинома
• Папілярна аденокарцинома
• Бронхіолоальвеолярний рак
• Солідний рак з утворенням муцину
Крупноклітинний рак (9,4%):
• Гігантськоклітинний рак (0,3%)
• Світлоклітинний рак Залозисто-плоскоклітинний рак (1,5%)
• Карциноїдні пухлини (1,0%)
Рак бронхіальних залоз:
• Мукоепідермоїдний рак (0,05%)
• Аденокістозний рак (0,04%)
-
Інші
Міжнародна класифікація раку легені по системі TNM (1986 р.)
Первинна пухлина (Т):
ТХ – первинна пухлина не може бути оцінена або на присутність первинної пухлини вказують злоякісні клітки в мокротинні або бронхіальних змивах, але вона не візуалізована комп'ютерними методами або бронхоскопією
Т0 – немає свідчень первинної пухлини
Tis – карцинома in situ
Т1 – пухлина 3 см або менше в максимальному вимірі, оточена легеневою або вісцеральною плеврою без бронхоскопічного свідчення проникнення ближче дольового бронха (тобто не в головний бронх)
Т2 – пухлина більше 3 см у максимальному вимірі. Втягує головний бронх, відстань від біфуркації трахеї 2 см або більше. Проникає у вісцеральну плевру. Викликає ателектаз або пневмоніт усього легені
Т3 – пухлина будь-якого розміру, що проникає безпосередньо в який- небудь із органів: грудну стінку (включаючи надключичні пухлини), діафрагму, медіастінальну плевру або перикард. Пухлина в головному бронху на відстані менш 2 см від біфуркації трахеї, але не поширюється на трахею
Т4 – пухлина будь-якого розміру, що проникає безпосередньо в який- небудь із органів середостіння: серце, великі судини, трахею, стравохід, тіло хребця, біфуркацію трахеї; або пухлина зі злоякісним плевральним випотом або випотом у перикард. Сателітний вузол (вузли) у долі, що містить первинну пухлину
Лімфатичний вузол (N):
NХ – регіональні лімфатичні вузли не можуть бути оцінені
N0 – немає метастазів у локальних лімфатичних вузлах
N1 – метастази в іпсілатеральних перибронхіальних і/або іпсілатеральних лімфатичних вузлах кореня легені, включаючи безпосереднє поширення пухлини на ці вузли
N2 – метастази в іпсілатеральних медіастінальних і/або біфуркаційних лімфатичних вузлах
N3 – метастази в контрлатеральних медіастінальних, кореневих, іпсілатеральних або контрлатеральних драбинно-м’язевих або надключичних лімфатичних вузлах.
Віддалені метастази (М):
МХ – присутність віддаленого метастазу не може бути встановлена М0 – віддалені метастази відсутні
М1 – віддалений метастаз
Гістологічна та TNM класифікації шлунка, їх значення.
Гiстологiчна фоpма. Pак шлунка pозвивається iз покpивного високого пpи- зматичного епiтелiю шлунка i залоз слизової оболонки. В 1982 pоцi ВООЗ запpо- понувала таку класифiкацiю:
-
Аденокаpцинома: а) папiляpна; б) тубуляpна; в) муцинозна; г) пеpстнепо- дібно-клiтинна.
-
Hедифеpенцiйований pак.
-
Залозисто-плоскоклiтинний рак.
-
Плоскоклiтинний рак. 5. Дрібноклітинний pак. 6. Карциноїд. Найбiльш часто зустpiчається аденокаpцинома, котра складає бiля 80% усiх новоутвоpень. На дpугому мiсцi за частотою знаходиться недифеpенцiйований pак — 10–12%. Iншi фоpми пухлини зустpiчаються в поодиноких відсотках спо- стеpежень. Саркоми солітарного характеру (мезенхімального та неврогенного походжен- ня) в шлунку мають характерні особливості будови і розвитку. З раком шлунка вони мають майже однакові клінічні прояви і лікування. Лімфоми шлунка зустрічаються дуже рідко. Найбільш часто серед них виника- ють неходжкінські лімфоми. Решта — це лімфогранульоматоз, лімфоми нодуляр- ного та дифузного росту. Карциноїд. Зустрічається в шлунку досить рідко, складаючи 2–3% новоутво- рення. Локалізується в різних частинах шлунка. Макроскопічно має вигляд екзо- фітної пухлини. Іноді пухлина буває агресивною.
Класифікація за TNM
Т – первинна пухлина.
ТХ – недостатньо даних для оцінки первинної пухлини.
Т0 – первинна пухлина не визначається.
Тis – преінвазивна карцинома (carcinoma in situ): інтраепітеліальна пухлина без
ураження власної пластинки слизової оболонки.
Т1 – пухлина інфільтрує власну пластинку слизової оболонки або підслизову основу.
Т2 – пухлина інфільтрує м’язеву оболонку або субсерозну.
Т2а – пухлина інфільтрує м’язеву оболонку.
Т2b – пухлина інфільтрує субсерозну оболонку.
Т3 – пухлина проростає серозну оболонку (вісцеральну очеревину) без інвазії в сусідні
структури.
Т4 – пухлина поширюється на сусідні структури
N – регіонарні лімфатичні вузли.
NХ – недостатньо даних для оцінки регіонарних лімфатичних вузлів.
N0 – нема ознак метастатичного ураження регіонарних лімфатичних вузлів. N1 – метастази в 1–6 лімфатичних вузлах.
N2 – метастази в 7–15 лімфатичних вузлах.
N3 – метастази більше ніж в 16 лімфатичних вузлах.
М– віддалені метастази.
MX – недостатньо даних для визначення віддалених метастазів.
М0 – немає ознак віддалених метастазів. М1 – є віддалені метастази.
Гістологічна та TNM класифікації товстої кишки, їх значення.
Класифікація раку ободової та прямої кишок за системою TNM - 6 (2002) TNM – Клінічна класифікація
T – ПЕРВИННА ПУХЛИНА
Tis – carcinoma in situ: внутрішньоепітеліальна пухлина або інвазія базальної мембрани.
T0 – первинна пухлина не визначається.
T1 – пухлина інфільтрує підслизовий шар. T2 – пухлина інфільтрує м’язовий шар .
T3 – пухлина проникає через м’язовий шар у субсерозний шар або в тканину неперитонізованих ділянок навколо ободової і прямої кишок.
T4 – пухлина безпосередньо поширюється на сусідні органи або структури і (або) проростає вісцеральну очеревину.
Tх – недостатньо даних для оцінки первинної пухлини
Примітка: пряме поширення при T4 включає розповсюдження на інші сегменти ободової і прямої кишок шляхом проростання серози, наприклад, проростання пухлини сліпої кишки в сигмоподібну.
N – РЕГІОНАРНІ ЛІМФАТИЧНІ ВУЗЛИ
Регіонарними є параколічні і параректальні, а також лімфовузли, розміщенні вздовж здухвинної, правої товстокишкової, середньої товстокишкової, лівої товстокишкової, нижньої мезентеріальної і верхньої прямокишкової артерій.
N0 – немає ознак метастатичного ураження реґіонарних лімфатичних лімфовузлів
N1 – метастази в 1-3-х параколічних або параректальних лімфатичних вузлах N2 – метастази в 4 і більше параколічних або параректальних лімфатичних
вузлах
N3 – метастази в лімфатичних вузлах розташованих вздовж зазначених судин
(див. вище)
Nх – недостатньо даних для оцінки стану реґіонарних лімфатичних вузлів
M – ВІДДАЛЕНІ МЕТАСТАЗИ
M0 – немає ознак віддалених метастазів
M1 – є ознаки віддалених метастазів
Mх – недостатньо даних для оцінки віддалених метастазів
pTNM категорія pT, pN, pM – відповідає категоріям T, N, M.
Гістологічна класифікація
I. ЕПІТЕЛІАЛЬНІ ПУХЛИНИ
А. Доброякісні
1. Аденома: а) тубулярна (залозистий поліп); б) ворсинчаста; в) тубулярно-ворсинчаста.
2. Аденоматоз (аденоматозний поліпоз кишечнику).
Б. Злоякісні
1. Аденокарцинома.
2. Слизова аденокарцинома.
3. Перснеподібноклітинний (мукоцелюлярний) рак.
4. Плоскоклітинний рак.
5. Залозисто-плоскоклітинний рак.
6. Недиференційований (медулярний, трабекулярний) рак.
7. Некласифікований рак.
II. НЕЙРОЕНДОКРИННИЙ РАК
III. НЕЕПІТЕЛІАЛЬНІ ПУХЛИНИ
А. Доброякісні (лейоміома, неврілемома, ліпома і ліпоматоз, гемангіоми та ін.).
Б. Злоякісні (найчастіше — лейоміосаркома).
Гістологічна та TNM класифікації печінки, їх значення.
Міжнародна гістологічна класифікація (ВООЗ, 1993 р.)
1. Епітеліальні пухлини:
-
гепатоцелюлярний рак;
-
холангіоцелюлярний рак;
-
змішаний гепато-холангіоцелюлярний рак;
-
гепатобластома;
-
цистаденокарцинома жовчних шляхів;
-
недиференційований рак.
2. Неепітеліальні пухлини:
-
інфільтративна гемангіоендотеліома;
-
гемангіосаркома;
-
ембріональна саркома;
-
інші.
3. Різні інші види пухлин:
-
тератома;
-
карциносаркома;
-
інші.
4. Некласифіковані пухлини.
5. Пухлини кровотворної та лімфоїдної тканин.
Гепатоцелюлярний рак виникає із печінкових клітин і складає 55–75% всіх первинних пухлин органа. Завдяки вираженому клітинному атипізму він віддалено нагадує будову гепатоцитів. В таких клітинах спостерігаються суттєві метаболічні та функційні порушення. Гістологічна структура таких пухлин являє собою папілярну або трабекулярну поліморфію. Клітини паренхіми можуть продукувати жовч або хільозну рідину. За гістологічною класифікацією ВООЗ серед гепатоцелюлярного раку виділяють компактну, ацінарну, скірозну та фіброламелярну форми.
Холангіоцелюлярний рак виникає із епітелію вивідних протоків печінки. Епітеліальні ракові клітини бувають циліндричної або кубічної форми, утворюють трубочки або сосочки, іноді схожі з нормальними канальцями. Спостерігається значне переважання строми над паренхімою пухлини. Утворення жовчі або іншої рідини паренхіматозними клітинами цієї пухлини не спостерігається.
Гепатохолангіоцелюлярний рак (синонім - злоякісна гепатохолангіома) побудований печінковими клітинами та епітелієм вивідних протоків.
Гепатобластома. Дуже рідкісне злоякісне захворювання. Виникає і розвивається гепатобластома в дитячому віці (до 4 років). У хворих старшого віку діагностується дуже рідко. За походженням виділяють два типи гепатобластом: епітеліальний та змішаний.
Класифікація ГЦК за системою TNM
Т — первинна пухлина
Тх — недостатньо даних для оцінки первинного новоутворення
T0 — первинне новоутворення не визначається
T1 — солітарна пухлина <2 см у найбільшому вимірі без проростання судин
T2 — солітарна пухлина <2 см у найбільшому вимірі з проростанням судин або множинні пухлини <2 см без проростання судин, обмежені однією часткою, або — солітарна пухлина >2 см в найбільшому вимірі без проростання судин
T3 — солітарна пухлина >2 см із проростанням судин або множинні пухлини <2 см з проростанням судин, обмежені однією часткою, або обмежені однією часткою множинні пухлини, кожна з яких >2 см з/без проростання судин
T4 — множинні пухлини в обох частках печінки або пухлина, що уражає головну гілку портальної або печінкової вени, або пухлина з розповсюдженням на сусідні органи, крім жовчного міхура, або пухлина, що проростає вісцеральну очеревину.
N — регіонарні лімфатичні вузли (вузли воріт печінки або гепатодуоденальної зв’язки)
Nx — недостатньо даних для оцінки регіонарних лімфатичних вузлів
N0 — немає ураження регіонарних лімфатичних вузлів
N1 — є метастатичне ураження лімфатичних вузлів воріт печінки або гепатодуоденальної зв’язки.
М — віддалені метастази
Мх — недостатньо даних для визначення віддалених метастазів
M0 — немає даних про наявність віддалених метастазів
M1 — є віддалені метастази
G-гістопатологічна градація
Gx — Ступінь диференціації не може бути визначений
G1 — Високий ступінь диференціації
G2 — Середній ступінь диференціації
G3 — Низький ступінь диференціації
G4 — Недиференційована пухлина
Стадії ГЦК:
-
Стадія I: T1N0M0
-
Стадія II: T2N0M0
-
Стадія IIIA: T3N0M0
-
Стадія IIIB: T1N1M0, T2N1M0, T3N1M0
-
Стадія IVA: T4N(будь-яке)M0
-
Стадія IVB: T(будь-яке)N(будь-яке)M1
Гістологічна та TNM класифікації підшлункової залози, їх значення.
Міжнародна гістологічна класифікація (ВООЗ, 1993 р.)
І. Епітеліальні пухлини:
А. Доброякісні:
а) Аденома;
б) Цистаденома.
В. Злоякісні:
а) Аденокарцинома;
б) Плоскоклітинний рак;
в) Цистаденокарцинома;
г) Ацинарноклітинний рак;
д) Недиференційований рак.
ІІ. Пухлини острівців підшлункової залози.
ІІІ. Неепітеліальні пухлини.
ІV. Некласифіковані пухлини.
V. Пухлини кровотворної та лімфоїдної тканин.
VI. Метастатичні пухлини.
VII. Інші
Аденокарцинома підшлункової залози зустрічається в 80% випадків. Вона буває світлоклітинною пухлиною з високим, середнім та низьким ступенем диференціації.
Плоскоепітеліальний рак походить із епітелію вивідних проток залози. Зустрічається рідко.
Ацинарноклітинний рак виникає із залозистих клітин екзокринної системи залози. Серед всіх ракових новоутворень залози зустрічається в 1–3% спостережень.
Недиференційований рак. Пухлина побудована різко анаплазованими клітинами. Вони мають різну величину та виражений поліморфізм.
Апудоми належать до злоякісних пухлин із клітин дифузної ендокринної системи: інсулінома, глюкагонома, віпома, соматостатинома та інші.
Класифікація раку ПШЗ за системою TNM
Т – первинна пухлина
Тх — недостатньо даних для оцінки первинного новоутворення
T0 — первинне новоутворення не визначається
Tis — Рак in situ (також включає підшлункову інтраепітеліальну неоплазію III ступеня)
Т1 — пухлина обмежена підшлунковою залозою, до 2 см у найбільшому вимірі
Т1a — пухлина не більша за 0,5 см у найбільшому вимірі
Т1b — пухлина понад 0,5 см, але до 1 см у найбільшому вимірі
Т1c — пухлина понад 1 см, але до 2 см у найбільшому вимірі
Т2 — пухлина обмежена підшлунковою залозою, понад 2 см, але до 4 см у найбільшому вимірі
Т3 — пухлина обмежена підшлунковою залозою, понад 4 см у найбільшому вимірі
Т4 — пухлина проростає черевний стовбур аорти або верхню брижову артерію і/або загальну печінкову артерію
N – Регіонарні лімфатичні вузли
Nx — недостатньо даних для оцінки регіонарних лімфатичних вузлів
N0 — немає ураження регіонарних лімфатичних вузлів
N1 — наявні метастази в регіонарних від 1 до 3-х лімфатичних вузлах
N2 — наявні метастази у 4-х і більше лімфатичних вузлах
М — віддалені метастази
Мх — недостатньо даних для визначення віддалених метастазів
M0 — немає даних про наявність віддалених метастазів
M1 — є віддалені метастази
G-гістопатологічна градація
Gx — Ступінь диференціації не може бути визначений
G1 — Високий ступінь диференціації
G2 — Середній ступінь диференціації
G3 — Низький ступінь диференціації
G4 — Недиференційована пухлина
Стадії раку ПШЗ:
-
Стадія IА: T1N0M0
-
Стадія IВ: T2N0M0
-
Стадія II: T3N0M0
-
Стадія III: T1N1M0, T2N1M0, T3N1M0
-
Стадія IVA: T4N(будь-яке)M0
-
Стадія IVB: T(будь-яке)N(будь-яке)M1
Гістологічна та TNM класифікації нирки, їх значення.
Міжнародна гістологічна класифікація (ВООЗ, 2002 р.)
-
Світлоклітинний – 60-80%.
-
Хромофільний (папілярний) – 7-14%.
-
Хромофобний – 4-10%.
-
Онкоцитарний – 2-5%.
-
Рак збірних протоків – 1-2%.
Детальна гістологічна класифікація:
1. Нирково-клітинні пухлини
-
Світлоклітинна нирково-клітинна карцинома
-
Мультилокулярна світлоклітинна нирково-клітинна карцинома
-
Папілярна нирково-клітинна карцинома
-
Хромофобна нирково-клітинна карцинома
-
Карцинома зі збиральних трубочок Белліні
-
Медулярна карцинома нирки
-
Карциноми, асоційовані із транслокацією хромосоми Xp11
-
Карцинома, асоційована із нейробластомою
-
Муцинозна тубулярна і веретеноклітинна карцинома
-
Нирково-клітинна некласифікована карцинома
-
Папілярна аденома
-
Онкоцитома
2. Метанефрогенні пухлини
-
Метанефрогенна аденома
-
Метанефрогенна аденофіброма
-
Метанефрогенна стромальна пухлина
3. Нефробластичні пухлини
-
Нефрогенні залишки
-
Нефробластома
-
Кістозна частководиференційована нефробластома
4. Мезенхімальні пухлини
-
Виникають переважно у дітей
-
Світлоклітинна саркома
-
Рабдоїдна пухлина
-
Врождена мезобластична нефрома
-
Осифікована пухлина нирки у дітей
-
-
Виникають переважно у дорослих
-
Лейоміосаркома (включаючи ниркову вену)
-
Ангіосаркома
-
Рабдоміосаркома
-
Злоякісна фіброзна гістіоцитома
-
Гемангіоперицитома
-
Остеосаркома
-
Ангіоміоліпома
-
5. Епітеліоїдна ангіоміоліпома
-
Лейоміома
-
Гемангіома
-
Лімфангіома
-
Юкстагломерулярноклітинна пухлина
-
Реномедулярна інтерстиціальноклітинна пухлина (шваннома)
-
Солітарна фіброзна пухлина
6. Змішані мезенхімальні та епітеліальні пухлини
-
Кістозна нефрома
-
Змішана епітеліальна та стромальна пухлина
-
Синовіальна саркома
7. Нейроендокринні пухлини
-
Карциноїд
-
Нейроендокринна карцинома
-
Примітивна нейроектодермальна пухлина
-
Нейробластома
-
Феохромоцитома
8. Пухлини гемопоетичної та лімфоїдної тканини
-
Лімфома
-
Лейкоз
-
Плазмоцитома
9. Герміногенні пухлини
-
Тератома
-
Хоріокарцинома
10. Метастатичні пухлини
Нирково-клітинний рак – зачіпає основні структурні одиниці нирок – нефрони. Саме у нефронах відбувається фільтрація токсичних речовин з крові, що і викликає переродження тканин. Це найпоширеніший різновид хвороби. Становить 85%. Виділяють кілька видів залежно від форми утворення та його клітин: медулярний рак, світлоклітинний (85%), тубулярний, папілярний (14%).
Перехідно-клітинний (2%) – виникає у системі балій та канальців, у які потрапляє відфільтрована сеча після нефронів.
Нефробластоми – сюди відносять пухлини з ниркової паренхіми, в якій розташовані нефрони. Виникають у новонароджених.
Саркоми – з’являються з судин, сполучних волокон та нервів (лейоміосаркоми, ангіосаркоми).
Нейроендокринні пухлини – формуються з окремих клітин, які виробляють гормональні речовини.
Герміногенний характер – з’являється з ембріональних клітин-попередників статевих залоз, що мігрували під час внутрішньоутробного розвитку.
Класифікація НКР за системою TNM
Т — первинна пухлина
Тх — первинна пухлина не може бути оцінена
Т0 — немає даних про первинну пухлину
Т1 — пухлина ≤7 см у найбільшому діаметрі, обмежена ниркою
Т1а — пухлина ≤4 см у найбільшому діаметрі, обмежена ниркою
Т1b — пухлина >4 см, але ≤7 см у найбільшому діаметрі, обмежена ниркою
Т2 — пухлина >7 см у найбільшому діаметрі, обмежена ниркою
Т2а — пухлина >7 см, але ≤10 см у найбільшому діаметрі, обмежена ниркою
Т2b — пухлина >10 см у найбільшому діаметрі, обмежена ниркою
Т3 — пухлина поширюється на великі вени або інвазія в навколониркову клітковину, але не в суміжну надниркову залозу і не виходить за межі фасції Героти
Т3а — пухлина поширюється на ниркову вену чи її сегментарні гілки, або пухлина проростає в паранефральну клітковину чи/або нирковий синус, але не виходить за межі фасції Героти
Т3b — пухлина поширюється на нижню порожнисту вену нижче діафрагми
Т3с — пухлина поширюється на нижню порожнисту вену або її стінку вище діафрагми
Т4 — пухлина поширюється за межі фасції Героти (включає проростання в суміжну надниркову залозу)
N — регіонарні лімфатичні вузли
Nх — регіонарні лімфатичні вузли не можуть бути оцінені
N0 — немає ознак метастазування в регіонарні лімфатичні вузли
N1 — метастаз в одному лімфатичному вузлі
N2 — метастазування більше ніж в один регіонарний лімфатичний вузол
М — віддалені метастази
М0 — немає віддалених метастазів
М1 — віддалені метастази
G-гістопатологічна градація
Gx — Ступінь диференціації не може бути визначений
G1 — Високий ступінь диференціації
G2 — Середній ступінь диференціації
G3 — Низький ступінь диференціації
G4 — Недиференційована пухлина
Стадії НКР:
-
Стадія I: T1N0M0
-
Стадія II: T2N0M0, T1N1M0
-
Стадія IIIA: T2N1M0
-
Стадія IIIB: T3N0M0, T3N1M0
-
Стадія IVA: T4N0M0, T4N1M0, T(будь-яке)N2M0
-
Стадія IVB: T(будь-яке)N(будь-яке)M1
Які пухлини зустрічаються у дітей? Приклади епітеліальних пухлин у дітей.
Класифікація пухлин у дітей:
-
лейкози
-
лімфоми
-
пухлини ЦНС
-
пухлини вегетативної нервової системи
-
ретинобластома
-
пухлини нирок
-
пухлини печінки
-
пухлини кісток
-
пухлини м'яких тканин
-
герміноклітинні пухлини
-
епітеліальні пухлини
-
інші рідкісні або неспецифічні новоутворення.
Структура онкологічної захворюваності дітей:
-
1 місце - лейкемії - 1/3 всіх пухлин (1/4 - гострий лімфобластний лейкоз),
-
2 місце - пухлини головного і спинного мозку (переважно астроцитарні) - 20-25%,
-
3 місце - злоякісні лімфоми - 11%,
-
4 місце - пухлини ембріональної природи (нефробластома, нейробластома, ретинобластома, гепатобластома) - 10%,
-
5 місце - злоякісні пухлини м'яких тканин, серед яких переважає рабдоміосаркома - 6%,
-
6 місце - герміноклітинні пухлини - 2%,
-
7 місце - різні варіанти первинних карцином - 2%.
Особливості пухлин дитячого віку:
-
Основними пухлинами дитячого віку є дизонтогенетичні пухлини.
-
Злоякісні пухлини у дітей зустрічаються рідше, ніж у дорослих.
-
Неепітеліальні пухлини у дітей переважають над епітеліальними.
-
У дитячому віці зустрічаються незрілі пухлини, здатні до дозрівання (реверсії).
Онкозахворювання, які є винятковими для дітей:
-
Нейробластома (7% випадків)
-
Пухлина Вільмса (5% випадків)
-
Рабдоміосаркома (3-4% випадків)
-
Ретинобластома (3% випадків)
Злоякісна епітеліальна пухлина - вид злоякісної пухлини, що розвивається з клітин епітеліальної тканини різних органів (шкіри, слизових оболонок і внутрішніх органів). Карциноми у дітей зустрічаються досить рідко (0,8-6%, доходить до 10% від усіх злоякісних пухлин у дітей). До групи підвищеного онкологічного ризику включають дітей віку від 12 років, що підтверджує думку дитячих онкологів, які відносять злоякісні епітеліальні пухлини в дитячому віці до пухлин «дорослого типу». Карциноми в дитячому віці за своїм клінічним перебігом відрізняються від аналогічних у дорослих. У дітей спостерігається менш агресивний, ніж у дорослих, перебіг раку щитовидної залози, шлунка, кишечника, молочної та слинної залоз, але в той же час відзначається загальна тенденція до раннього регіонарного і пізнього віддаленого метастазування. У всіх дітей із злоякісними епітеліальними пухлинами незалежно від локалізації, на перший план виходять ознаки загального пухлинного симптомокомплекса (млявість, сонливість, неспокійний сон, підвищена дратівливість, погіршення апетиту і пов'язане з цим схуднення, безпричинна блювота, порушення стільця, підвищення температури без очевидних інших проявів певного захворювання, безпричинні болі в кінцівках, болі в животі, блідість шкірних покривів, шкіра сірувато-біла, іноді з жовтяничним відтінком або крововиливами, на шкірі можуть визначатися різні припухлості), а пізніше - симптоми, характерні для вогнища ураження.
У дітей частіше зустрічається:
-
рак щитовидної залози
-
рак печінки (гепатоцелюлярний рак і гепатобластома)
-
інші карциноми (рак шлунково-кишкового тракту, рак нирки, рак шкіри та ін.) досить рідкісні.
Назвіть п’ять найчастіших пухлин у дорослих людей в Україні.
За локалізацією найбільш поширеним:
-
серед чоловіків є рак легенів, шкіри, передміхурової залози, шлунка;
-
серед жінок є рак молочної залози, рак тіла і шийки матки та ободової кишки, шкіри.
За 2017 рік серед провідних локалізацій патології виявилися:
-
Рак молочної залози – 47,9 на 100 тис. населення;
-
Злоякісні новоутворення шкіри – 38,8 на 100 тис. населення; з них меланома шкіри – 8,9 на 100 тис. населення;
-
Рак трахеї, бронхів, легенів – 30,7 на 100 тис. населення;
-
Рак ободової кишки – 28,9 на 100 тис. населення;
-
Рак шлунку – 18,5 на 100 тис. населення;
-
Рак передміхурової залози – 23,5 на 100 тис. населення;
-
Рак тіла матки – 18,7 на 100 тис. населення;
-
Онкологічні захворювання іншої локалізації – 188,9 на 100 тис. населення).
Епідеміологія пухлин. Соціальне значення показників захворюваності на пухлини.
Епідеміологія пухлин
Завдяки результатам епідеміологічних досліджень було встановлено, що тютюнокуріння має причинно-наслідковий зв’язок із раком легень. Порівняння частоти раку товстої кишки залежно від особливостей харчування у країнах Заходу й Африці дало змогу з’ясувати, що жири та клітковина в раціоні відіграють не останню роль у виникненні цього типу пухлин.
-
Завдяки епідеміологічним дослідженням окремих екологічних, національних (можливо, спадкових) і культурних чинників, що впливають на частоту специфічних неоплазій, є можливість краще зрозуміти причини утворення пухлин.
-
Певні захворювання, наявність яких підвищує ризик розвитку пухлин, також дають ключ до пояснення патогенезу онкологічних захворювань.
Подальще обговорення спершу узагальнює сумарну частоту виникнення пухлин, що розкриває всю масштабність проблеми, а далі розглядає конкретні чинники, залежні від пацієнта та навколишнього середовища, що впливають на рівень схильності до онкологічних захворювань.
Соціальне значення показників захворюваності на пухлини
За даними ВООЗ, станом на 2012 р. у світі щорічно реєструють близько 14,1 млн нових випадків злоякісних пухлин, що призводить до 8,2 млн летальних наслідків (приблизно 22 500 смертей на день). Більше того, у зв’язку зі зростанням чисельності населення ВООЗ передбачає, що до 2035 р. кількість осіб зі злоякісними пухлинами та смертність зростуть до 24 і 14,6 млн відповідно (враховуючи нинішній рівень смертності). Додаткові перспективи стосовно ймовірності розвитку окремих форм злоякісних пухлин можна визначити з урахуванням показників смертності та випадків захворювання у межах нації. У США у 2016 р. було виявлено приблизно 1,69 млн нових випадків злоякісних пухлин та зафіксовано 595 тис. смертей.
Протягом кількох десятиліть рівень смертності від різних типів злоякісних пухлин був надзвичайно мінливим. Із 1995 р. частота їх виявлення у чоловіків і жінок загалом була стабільною, але рівень смертності від онкологічних захворювань у чоловіків знизився приблизно на 20%, у жінок – на 10%. Серед чоловіків 80% цього показника припадає на рак легень, передміхурової залози, та товстої кишки; серед жінок близько 60% - за рахунок зменшення кількості летальних наслідків від колоректального раку і раку грудної залози. Так, обмежене використання тютюнових виробів сприяло зниженню частоти смерті від раку легень, а завдяки вдосконаленій діагностиці й лікуванню знижено рівень смертності від колоректального раку, раку передміхурової залози та грудної залози.
Ймовірність виникнення злоякісних пухлин з віком зростає. Більшість смертей внаслідок злоякісних пухлин трапляються в осіб віком 55-75 років; водночас рівень смертності від онкологічних захворювань після 75-річного віку знижується. Підвищення частоти пухлин у процесі старіння, напевне, можна пояснити фактом накопичення соматичних мутацій, що є передумовою виникнення злоякісних неоплазій. Зниження рівня компетенції імунної системи, що супроводжує процес старіння, також може відігравати важливу роль.
Незважаючи на те що злоякісні пухлини здебільшого уражують старші групи населення, трохи більше ніж 10% усіх смертей припадає на дітей віком до 15 років. Найвищою летальністю у дітей супроводжуються лейкемії, пухлини ЦНС, лімфоми та саркоми м’яких тканин і кісток.
Назвіть карциноми з найкращими показниками виживаності. Поясніть від чого це залежить.
Злоякісні неоплазії, що виникають з епітеліоцитів – називають карциномами (рак) – незалежно від типу тканини, з якої вони розвиваються.
Карциному, що на зрізі подібна до залозистого епітелію, - називають аденокарциномою, а ту, що утворена із плоского (сквамозного) епітелію, - плоскоклітинною карциномою.
Залежно від того, який тип клітин вражає мутація, виділяють карциноми:
-
Базальноклітинні. Зростають на шкірі, відрізняються повільним розвитком та рідко дають метастази. Схожі на червоні гладкі плями, вкриті скоринкою. Виживаність висока при ранньому виявленні.
-
Плоскоклітинні. Формуються на внутрішньому епітелії та слизових оболонках. При цьому клітини перероджуються та за будовою нагадують багатошаровий шкірний епідерміс. Вони можуть продукувати кератин. Тоді мова йде про плоскоклітинний зроговілий рак. Він більш диференційований та сприятливий за прогнозом, тобто виживаність висока при ранній діагностиці. Незроговілий рак вважається агресивним, виживаність нижча.
-
Аденокарциноми. Це утворення, що беруть початок з залозистих клітин, присутніх у епітелії.
Карцинома легенів – п’ятирічна виживаність становить близько 20%.
Рак молочної залози – 90% пацієнток живуть 10 років після закінчення лікування на 1-ій та 2-ій стадіях захворюваності.
Карциноми товстого кишківника (найбільш характерні для прямої кишки) – ефективне лише на ранніх стадіях лікування, найбільша виживаність у пацієнтів на 2-ій стадії і найнижча на 4-ій стадії.
Карцинома простати – при 1-ій і 2-ій стадії п’ятирічна виживаність становить 100%, при 4-ій стадії пацієнтів з віддаленими метастазами – 29% (захворюваність 215 на 100 тис. населення, а смертність 41 на 100 тис. населення).
Рак шлунку – п’ятирічна виживаність пацієнтів з 1-ою стадією становить 70%, з 2-ою – 50-60%, з 3-ою – 25%.
Рак печінки – ймовірність 5-річної виживаності становить 30-40%. Однак таких хворих мало, а загальна 5-річна виживаність у хворих на рак печінки становить всього 7%.
Від чого залежить:
-
органу ураження;
-
стадії захворювання;
-
ступеню диференціації пухлини.
Які види метастазування існують. Вкажіть для яких пухлин типові ті чи інші види метастазування.
Метастазування – це поширення пухлини на віддаль від місця первинної локалізації, що у будь якому разі характеризує пухлину як злоякісну, оскільки, згідно із визначенням, доброякісні пухлини не метастазують. Здатність до інвазії уможливлює проникнення злоякісних пухлин у кровоносні й лімфатичні судини та порожнини тіла, що є передумовою їх поширення. Зазвичай у майже 30% пацієнтів уже наявні клінічні ознаки метастазування під час діагностики солідних пухлин (за винятком ракових пухлин шкіри, окрім меланоми). Інші 20% мають клінічно «приховані» метастази на момент встановлення діагнозу.
Загалом, що більший розмір і вищий рівень анаплазії вихідної пухлини, то ймовірнішим є її метастатичне поширення, але всі правила мають свої винятки.
Злоякісні пухлини поширюються в організмі одним із 3 способів:
(І) дисемінація в межах порожнини тіла; (2) лімфогенне поширення;
(3) гематогенне поширення.
Дисемінація шляхом обсіменіння можлива, коли неоплазії проникають у природну порожнину тіла. Такий спосіб дисемінації є специфічною ознакою раку яєчників, що часто уражує очеревину. «Імпланти» можуть вкривати всю поверхню очеревини і всетаки не проникати в тканини, розташовані глибше.
Пухлини ЦНС, такі як медулобластома й епендимома, можуть проникати у шлуночки головного мозку та імплантуватись в оболони головного чи спинного мозку, будучи підхопленими потоком спинномозкової рідини (ліквору).
Лімфогенне поширення є більш характерним для карцином, тоді як гематогенне властиве здебільшого саркомам.
Оскільки лімфатична і кровоносна системи мають морфофункціональний взаємозв'язок, усі форми карцином можуть дисемінувати через одну або обидві зазначені системи.
Ймовірність інфільтрації лімфатичного вузла раковими клітинами насамперед залежить від локалізації первинної ракової пухлини та природних магістралей регіонарної лімфатичної системи.
У деяких випадках ракові клітини можуть інфільтрувати лімфатичні вузли за ходом лімфатичних проток, минаючи безпосередньо близькі до місця локалізації первинної пухлини лімфатичні вузли; «скіп-метастаз».
Ракові клітини можуть інфільтрувати всі лімфатичні вузли за ходом грудної лімфатичної протоки, щоб урешті решт досягти кровоносного русла.
«Сторожовий» лімфатичний вузол це найближчий регіонарний вузол, що першим «зустрічає» потік лімфи від первинної пухлини.
Він може бути ідентифікований методом уведення синіх барвників чи мічених радіоактивних ізотопів поблизу первинної локалізації пухлини. → Біопсія «сторожових» лімфатичних вузлів допомагає з'ясувати ступінь поширення пухлини
Слід зазначити, що збільшення лімфатичних вузлів біля первинної пухлини, хоч і має викликати підозру стосовно її метастатичного поширення
Але все рівно потрібно проводити гістологічне дослідження пухлини в разі виявлення гіперплазії регіонарного лімфатичного вузла (вузлів).
Гематогенний шлях поширення більш властивий для сарком, але й карциноми здатні так метастазувати. Як і очікували, пухлинні клітини менш інтенсивно проникають в артерії, ніж у вени. Потрапивши у венозне русло, в якому кров тече за ходом вен, що дренують місце первинної локалізації неоплазії, пухлинні клітини часто осідають у першій капілярній сітці, яка трапляється на їхньому шляху.
Оскільки всі елементи системи ворітної вени впадають у печінку, а вся кров із порожнистих вен потрапляє в легені, печінка й легені найчастіше є ділянками вторинної інфільтрації у процесі гематогенної дисемінації пухлинних клітин.
Значенні молекулярної та генетичної діагностики пухлин. Що таке таргетна терапія?
Молекулярна діагностика. У зв’язку з тим що кожен Т- чи В-лімфоцит має унікальну групу генів, які кодують антигенні рецептори, завдяки визначенню методом ПЛР транслокацій у генах Т-клітинних рецепторів чи імуноглобулінів існує можливість встановлення наявності моноклональної (неопластичної) та поліклональної (реактивної) проліферації. Багато гемопоетичних новоутворень, а також декілька солідних пухлин характеризуються конкретними транслокаціями, тому діагноз можна верифікувати шляхом їх виявлення. Наприклад, флюоресцентну гібридизацію in situ (FISH) або метод ПЛР можна використовувати для виявлення транслокацій, типових для саркоми Юїнга і деяких лекемій та лімфом. Ідентифікація транскриптів BCR-ABL на основі ПЛР може підтвердити діагноз хронічної мієлоїдної лейкемії. Нарешті, деякі гематологічні неоплазії визначаються точкових мутацій у конкретних онкогенах. Наприклад, діагностика іншої мієлоїдної неоплазії, яку називають справжньою поліцитемією, потребує ідентифікації специфічних мутацій у гені JAK2, який кодує нерецепторну тирозинкіназу.
Генетична діагностика (діагностика спадкової схильності до виникнення пухлин). Мутації в лінії зародкових клітин кількох генів – супресорів росту пухлин, наприклад BRCA1, підвищують ризик розвитку окремих типів пухлин у конкретного пацієнта. Отже, виявлення таких мутантних алелів дає можливість лікарю разом із пацієнтом розробити протокол скринінгового обстеження, а також провести профілактичні оперативні втручання. Більше того, цей метод діагностики допомагає проводити генетичну консультацію родичів, які входять у групу підвищеного ризику.
Таргетна терапія – це лікування препаратами, які блокують ріст та розповсюдження ракових клітин, шляхом впливу на специфічні молекули, які приймають участь у рості та розвитку пухлинної клітини. Такий вид лікування може бути набагато ефективніше багатьох інших видів терапії раку, включаючи хіміотерапію та променеву терапію, так як таргетна терапія направлена саме на конкретні молекули, які знаходяться у самій раковій клітині. І ще важлива особливість – таргетна терапія значно менше впливає на здорові клітини організму.
Раковим клітинам, як і будь яким іншим клітинам організма для життя та розмноження необхідний кисень, а таргетні препарати перекривають його доступ до пухлинних тканин. Механізм дії заключається в тому, що ці препарати інгібують ріст мікросудин у тканинах злоякісної пухлини, не даючи розвиватися первинній пухлині та її метастазам.
Які імуногістохімічні показники визначають в пухлинах для прогнозування ефективності лікування?
Імуногістохімія або ІГХ — аналітичний метод визначення протеїнів (антигенів) у клітинах біологічних тканин на основі реакції антиген-антитіло.
Імуногістохімічні показники, які визначають в пухлинах для визначення ефективності лікування називають пухлинними маркерами (ПМ).
Пухлинними маркерами прийнято вважати речовини, які продукуються пухлинними клітинами або організмом у відповідь на розвиток пухлини.
Визначення ефективності лікування з допомогою ПМ. При цьому потрібно брати до уваги кількість позитивних і негативних випадків динаміки рівня кожного маркера. У хворих на рак товстої кишки показовою є концентрація раково-ембріонального антигену (РЕА), яка підвищена у 85% пацієнтів і зменшується при проведенні радикального лікування. Регулярні визначення рівнів цього маркера можна використовувати для контролю ефективності лікування, тривалості безрецидивного періоду або стабілізації процесу. Повторне наростання рівня РЕА (мінімум у 2 рази) свідчить про неефективність лікування, прогресування захворювання.
ВООЗ рекомендує наступні інтервали взяття проб для аналізу: 1 раз на місяць протягом першого року після лікування, 1 раз у 2 місяці протягом другого року й 1 раз у 3 місяці протягом третього року спостереження. Спорадичні дослідження рівнів ПМ недоцільні. Необхідно відзначити, що найбільш важливим показником є динаміка змін, а не абсолютні показники концентрації. Так, при моніторингу хворих на рак щитовидної залози визначають у сироватці крові рівні тиреоглобуліну — глікопротеїду, що продукується не тільки нормальними, але і неопластичними клітинами щитовидної залози. Його не виявляють у крові пацієнтів, у яких проведено тиреоїдектомію і відсутні метастази раку щитовидної залози. Його поява в сироватці крові у таких пацієнтів свідчить про наявність рецидиву або метастазів.
Окрім РЕА (при раку товстої кишки) та глікопротеїду (при раку щитовидної залози), пухлинними маркерами, які застосовуються для визначення ефективності лікування можуть бути простатичний специфічний антиген (ПСА), альфафетопротеїн (АФП) та тканинний поліпептидний антиген (ТПА).
Які імуногістохімічні показники визначають в пухлинах для прогнозування клінічного перебігу пухлин?
Імуногістохімічні показники які визначаються в пухлинах для прогнозування клінічного перебігу прийнято називати прогностичними маркерами.
Прогностичні маркери це один із видів пухлинних маркерів що є речовинами, які продукуються пухлинними клітинами або організмом у відповідь на розвиток пухлини. Від речовин, що продукуються нормальними клітинами, вони відрізняються якісно (пухлиноспецифічні) або кількісно (пухлиноасоційовані, які продукуються також непухлинними клітинами, але в значно менших концентраціях). Використовуються прогностичні маркери для визначення прогресування злоякісності пухлини і клінічного прогнозування процесу. Виявлення прогностичних маркерів ІГХ методами корелює з
сприятливістю прогнозу, що пов’язано з поширеністю і агресивністю пухлинного процесу.
До прогностичних маркерів які виявляються ІГХ методами належать: молекули міжклітинної адгезії, маркери проліферації та апоптозу, ростові фактори тощо.
Роль генетичних досліджень для діагностики пухлин.
Основна роль генетичних досліджень для діагностики пухлин - це раннє виявлення онкогенних генетичних маркерів та спадкової схильності, до того як процес перейде з молекулярного рівня на клітинний та тканинний; попередження розвитку злоякісних пухлин та виявлення нових закономірностей взаємодії між зовнішніми факторами та генами які причетні до запускання канцерогенезу; розробка цільової терапії спадкових пухлин.
Пухлини є генетичними хворобами соматичних клітин, їх механізми дуже складні, тому ці хвороби важко класифікувати. Мутації, що спричиняють розвиток злоякісних новоутворень, можуть трапитися в статевих або соматичних клітинах. У першому випадку вони існували вже в гаметі, а отже, присутні у всіх клітинах організму, в другому — виникають у соматичній клітині як результат постійного мимовільного або спровокованого мутаційного процесу. Виникнення пухлини часто починається в соматичних клітинах з мутації того самого локуса, в якому вже є мутація гаметного походження. Неможливо чітко розмежувати етапи формування злоякісних новоутворень людини, обумовлені спадковістю або чинниками середовища. Однак у деяких випадках це вдається зробити за допомогою комплексу методів дослідження: популяційно-статистичного, генеалогічного, близнюкового, генетичних маркерів, біохімічного та в дослідах на тваринах
Популяційні дослідження свідчать, що поширеність таких форм злоякісних новоутворень, як рак молочної залози, рак шлунку, в різних популяціях різниться.
Вивчення родоводів свідчать, що коли жінка хвора на рак молочної залози, то в її родич І ступеня спорідненості ризик виникнення тієї самої форми раку зростає в два-три рази. Подібні результати одержані також у випадку раку шлунку.
Спадкова схильність до злоякісних новоутворень меншою мірою виявляється у близнюкових дослідженнях.
В даний час все більш широке поширення в діагностиці спадкових пухлинних синдромів отримують методи секвенування(Секвенування - це процес визначення нуклеотидних послідовностей ДНК і РНК.)
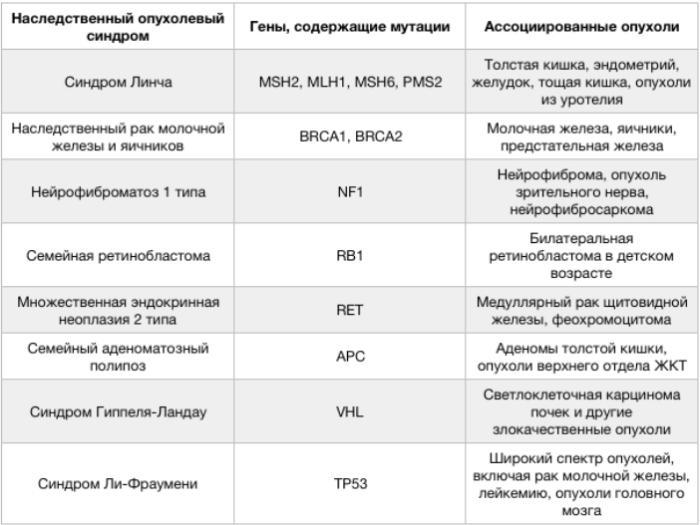
Що таке спадкові пухлини? Наведіть приклади.
Спадковий пухлинний синдром (спадкові пухлини) - це стан, пов'язаний з формуванням пухлини в результаті успадкування мутацій в генах, асоційованих з онкогенезом.
Одним з найбільш поширених спадкових пухлинних синдромів є синдром Лінча, або спадковий колоректальний рак без поліпозу.
У нашій країні велике значення має висока поширеність спадкового раку молочної залози і яєчників. Серед всіх випадків раку молочної залози спадкові складають 5-10%, серед випадків раку яєчників - 10-15%.
До інших спадкових форм пухлин належать: рак підшлункової залози (мутація BRCA2),
неполіпозний рак товстої кишки (MSH2 и MLH1), ретинобластома ( схильність через мутацію в RB1), меланоми, шваноми, карциноїдні пухлини, медулярний рак щитоподібної залози.
Які молекулярні механізми формування пухлин ви знаєте?
Вивчення процесу молекулярного канцерогенезу є ключовим моментом як для розуміння природи пухлин, так і для пошуку нових і ефективних методів лікування онкологічних захворювань.Канцерогенез - складний багатоетапний процес, глибока реорганізація нормальних клітин організму. З усіх запропонованих на цей момент теорій канцерогенезу, мутаційна теорія заслуговує найбільшої уваги. Відповідно до цієї теорії, пухлини є генетичними захворюваннями, патогенетичним субстратом яких є молекулярне пошкодження генетичного матеріалу клітини (точкові мутації, хромосомні аберації і т. д.).
Молекулярні механізми відповідальні за пухлинну індукцію клітини характеризуються дією на протоонкогени та на гени-супресори пухлин, до них належать:
-мутації протоонкогена або гена-супресора пухлин зі зміною структури специфічного продукту експресії гена;
-підвищення рівня експресії протоонкогена при мутації його регулюючої послідовності (точкова мутація);
-зниження рівня експресії гена-супресора пухлин при мутації його регулюючої послідовності (точкова мутація);
-перенесення гена в активно транскрибуючу частину хромосоми (хромосомні аберації).
Що таке гістологічна диференціація раку?
Гістологічна диференціація раку - це ступінь зрілості тканин карциноми, наскільки її гістоморфологія відрізняється від тієї тканини з якої вона розвинулася.
Диференціація раку визначає не тільки його мікроморфологічну картину, але й ступінь злоякісності пухлини ( схильність до інфільтративного росту, метастазування ). Більш диференційовані злоякісні новоутворення будуть мати меншу злоякісність (Наприклад: високодиференційована аденокарцинома), менш диференційовані - більшу злоякісність (Наприклад: перстневидноклітинний рак). Разом з тим, менше диференційовані злоякісні пухлини будуть мати більшу чутливість до променевої терапії. Високодиференційована карцинома мало чим відрізняється від похідної тканини ( крім клітинного і тканинного атипізму ) і може навіть виконувати її функції
( наприклад синтезувати слиз, ферменти, гормони і.т.д), тому встановити її тканинне походження не викликає труднощів. Низькодиференційований рак має значну відмінність від похідної тканини, тому для його гістогенетичного диференціювання необхідно застосовувати імуногістохімічний аналіз, але іноді, визначити з якої тканини пішла пухлина неможливо.
За класифікацію TMN, є такі ступені диференціації раку та інших злоякісних пухлин:
G1 - низька (високодиференційовані пухлини);
G2 - середня (середньодиференційовані пухлини);
G3 - висока (недиференційовані пухлини).
Отже, за ступенем гістологічної та клітинної зрілості карциноми, ми можемо морфологічно її діагностувати, прогнозувати перебіг та визначати пріоритетні методи лікування.
Що таке гістологічна диференціація саркоми?
Гістологічна диференціація раку - це ступінь зрілості тканин саркоми, наскільки її гістоморфологія відрізняється від тієї тканини з якої вона розвинулася.
За класифікацію TMN, є такі ступені диференціації сарком:
G (gradus) – гістопатологічна градація – ступінь клітинної диференціації (ступінь злоякісності):
Gx – ступінь диференціації не може бути визначений,
G1 – високий ступінь диференціації,
G2 – середній ступінь диференціації,
G3 – низький ступінь диференціації,
G4 – недиференційована пухлина.
Які критерії використовують для визначення гістологічної диференціації раку?
