
- •1. Рівняння Клапейрона:
- •2. Рівняння Менделєєва-Клапейрона:
- •1. Ізотермічний процес
- •2. Ізобарний процес
- •Контрольні питання
- •Література
- •Термодинаміка План
- •Контрольні питання
- •Література
- •Агрегатні стани речовини План
- •2. Питома теплота плавлення
- •3. Питома теплота пароутворення
- •Контрольні питання:
- •Література
- •Електростатика План
- •2. Діелектрики в електричному полі
- •Контрольні питання
- •Література
- •Електродинаміка План
- •Контрольні питання
- •Література
- •Електромагнетизм План
- •Контрольні питання
- •Література
- •Коливання та хвилі План
- •Контрольні питання
- •Література
- •Оптика План
- •Геометрична (променева) оптика
- •Хвильова оптика
- •Контрольні питання
- •Література
- •Елементи теорії відносності План
- •Контрольні питання
- •Література
- •Атом і атомне ядро План
- •Контрольні питання
МІНІСТЕРСТВО ОСВІТИ І НАУКИ
СУМСЬКИЙ ДЕРЖАВНИЙ УНІВЕРСИТЕТ МАШИНОБУДІВНИЙ КОЛЕДЖ
ФІЗИКА
ОПОРНІ КОНСПЕКТИ
ДЛЯ СТУДЕНТІВ І КУРСУ
ВСІХ СПЕЦІАЛЬНОСТЕЙ
Розглянуто і затверджено
на засіданні циклової комісії
природничо – математичних дисциплін
протокол № 10 від 05.06.08.
2008
ЗМІСТ
1. Молекулярна фізика………………………………………………3.
2. Термодинаміка……………………………………………………...8.
3. Агрегатні стани речовини……………………………………….10.
4. Електростатика……………………………………………………17.
5. Електродинаміка………………………………………………….28.
6. Електромагнетизм ……………………………………………… .40.
7. Коливання та хвилі……………………………………………….51.
8. Оптика……………………………………………………………….62.
9. Елементи теорії відносності……………………………………72.
10. Квантова оптика…………………………………………………75.
11. Атом і атомне ядро……………………………………………...79.
Молекулярна фізика
План
-
Структура речовини.
-
Особливості міжмолекулярної взаємодії.
-
Броунівський рух.
-
Ідеальний газ.
-
Основне рівняння МКТ ідеального газу.
-
Дослід Штерна.
-
Рівняння стану ідеального газу.
-
Ізопроцеси в газах.
-
Адіабатний процес.
10.Термодинамічна шкала температур.

Методами механіки аналізується поведінка окремих молекул у речовині, усереднені результати переносяться на сукупність молекул - речовину.
Структура речовин
Найпростіші речовини поодинокі хімічні елементи (гелій, аргон, неон, графіт, алмаз) складаються з електрично нейтральних атомів, а метали з позитивних іонів та вільних
Графік рівнодійної електронів.
Складні речовини утворені з молекул (груп атомів одного чи кількох елементів), найпростіша - молекула водню, Н2. Можна умовно говорити про існування "одноатомних молекул".
Особливості молекулярного руху і міжмолекулярної взаємодії
Особливості руху молекул зумовлені особливостями взаємодії, результуюча яких при більших молекулярних відстанях (газ) дорівнює нулю, при менших відстанях (рідина) відмінна від нуля і максимальна при малих відстанях (кристал).
Уявлення про молекулярну будову речовин і про безперервний
рух молекул основа молекулярно-кінетичної теорії будови речовини (МКТ).
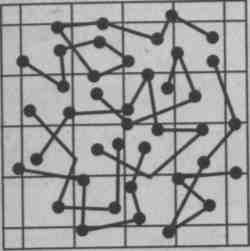 Дифузія
(змішана,
чи гетеродифузія) це проникнення молекул
деякої речовини в ділянки простору, в
яких уже знаходяться молекули іншої
речовини. Максимальна швидкість дифузії
в газах, мінімальна в
твердих тілах.
Дифузія
(змішана,
чи гетеродифузія) це проникнення молекул
деякої речовини в ділянки простору, в
яких уже знаходяться молекули іншої
речовини. Максимальна швидкість дифузії
в газах, мінімальна в
твердих тілах.
Броунівський рух.
Ботанік Броун, розглядаючи під мікроскопом краплю рідини з урівноваженими в ній частинками (насіння,, спори, пилок), виявив їх безладний рух. Броунівські частинки (посередники між молекулами і спостерігачем) рухаються під ударами невидимих у мікроскоп молекул.
Броунівський рух
Ідеальний газ
Це ідеалізоване поняття: сукупність величезної кількості молекул, розмірами і взаємодією яких можна знехтувати. Єдина їх взаємодія - пружні зіткнення.
Реальні гази (наприклад, азот) наближено розглядаються як ідеальний газ при достатньо низькому тиску та високій температурі.
Основне рівняння МКТ газу
Тиск газу p на внутрішню поверхню посудини- результат безладних ударів безлічі молекул. При цьому:
 а)
p~n,
а)
p~n,
![]() -
концентрація молекул,
-
концентрація молекул,
N - загальне число молекул у посудині,
V- об'єм посудини.
б) p~m0 (m0 – маса молекул);
в) p~![]() (
(![]() – середня
швидкість молекул);
– середня
швидкість молекул);
г) Nx
=
Ny
=
Nz=![]() N
N
а, б, в,
г): p~![]()
але
[p]≠[![]() ]
]
тому
p=![]()
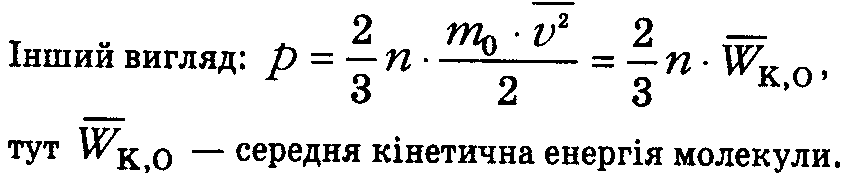
Наслідки основного рівняння
-
p~nT, p=knT, чи p=nkT
k=1,38![]()
звідси:
Т
~ ![]() ,
отже температура
— кількісна
міра середньої енергії руху молекул
речовини.
,
отже температура
— кількісна
міра середньої енергії руху молекул
речовини.
-
Середня квадратична швидкість молекули газу:

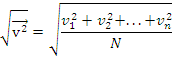
Для повітря при кімнатних температурах:
![]()
Експериментальні дослідження швидкостей молекул газу
У газі при будь-якій сталій температурі існує великий розкид швидкостей молекул. Модель такого розкиду - розкид швидкостей бігунів. Група людей біжить до залізничних платформ, що повільно рухаються, розтягнувшись по коридору . Внаслідок різних швидкостей окремих бігунів вони опиняються в різних відсіках залізничного состава :
праворуч швидкі, ліворуч - повільні, посередині - 3 середніми швидкостями.
Дослід Штерна
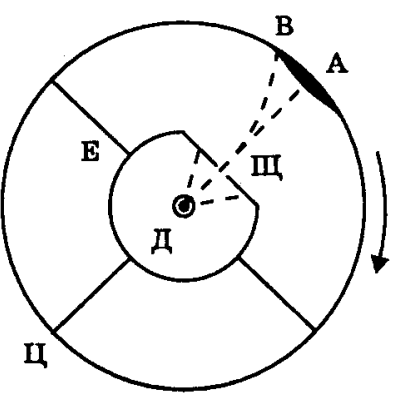 Атоми
Ag
("срібний
газ") з поверхні розжареної
дротини Д через щілину Щ летять до
внутрішньої поверхні циліндра Ц. Цей
циліндр разом з внутрішнім циліндром
Е (екран)
обертається з деякою кутовою швидкістю
ω.
За час
пробігу атомів від щілини циліндр Ц
прокручується, тому на ньому осаджується
шар срібла змінної товщини з максимумом
посередині. Швидкість молекул, потрапивших
у деяку точку В:
Атоми
Ag
("срібний
газ") з поверхні розжареної
дротини Д через щілину Щ летять до
внутрішньої поверхні циліндра Ц. Цей
циліндр разом з внутрішнім циліндром
Е (екран)
обертається з деякою кутовою швидкістю
ω.
За час
пробігу атомів від щілини циліндр Ц
прокручується, тому на ньому осаджується
шар срібла змінної товщини з максимумом
посередині. Швидкість молекул, потрапивших
у деяку точку В:
![]()
![]()


 Рівняння
стану ідеального газу
Рівняння
стану ідеального газу
Мікростани (поведінка окремих молекул газу) не можна контролювати. Макростани (прояви рухів безлічі молекул у посудині об'ємом V) можна контролювати шляхом вимірювання Т.
Величини р, V, Т- параметри стану. Математичний вираз, що містить всі параметри - рівняння стану.
1. Рівняння Клапейрона:
![]()
Коефіцієнт пропорційності в ньому різний для різних газів.
![]()
Аналогічно і для інших речовин, наприклад:
![]()
Авогадро установив:
а)
число
молекул у ![]() моль-1
(стала
Авогадро);
моль-1
(стала
Авогадро);
б) об'єм моля будь-якого газу при нормальному тиску і кімнатній температурі:
![]()
2. Рівняння Менделєєва-Клапейрона:
Для різних газів в однакових кількостях коефіцієнт пропорційності в рівнянні стану один і той же (універсальний):
а) для одного моля:
![]()
![]()
б) для V молів: pV= ν RT.
Ізопроцеси в газах
Процес — це послідовна зміна станів або розвинення деякого явища. (Процес відбувається, протікає; явище виникає в результаті процесу, спостерігається).
Ізопроцеси — це три процеси, що відбуваються при сталості одного з параметрів стану.
1. Ізотермічний процес
(розширення або стиснення газу при Т=const:
У цилиндрі під поршнем — повітря в об'ємі V1 при p1 і T1.
Повільним підняттям поршняна ∆h збільшують об'єм до V2.
При Т2 = Т1 тиск p2 <р1
По Клапейрону:
![]()
![]() (закон
Бойля-Маріотта)
(закон
Бойля-Маріотта)
2. Ізобарний процес
(розширення або стиснення газу при р = const).
Розширення газу від V1 до V2 - результат нагрівання. Тиск залишається сталим лише у випадку, якщо ефект зменшення густини ударів молекул об поверхню циліндра компенсується збільшенням енергії окремих ударів: у скільки разів збільшиться V, у стільки разів повинно зрости Т, щоб
р = const.
![]() (закон
Гей-Люссака)
(закон
Гей-Люссака)
3. Ізохорний процес (грец. "chora" — простір) (нагрівання або охолодження газу в замкненому об'ємі, тобто при V- const).
У скільки разів збільшиться Т, у стільки разів зросте р:
![]()
![]() (закон
Шарля)
(закон
Шарля)
Закон Шарля з використанням температури по Цельсію
![]()
![]()
Адіабатний процес
Це процес у системі без її теплообміну з оточенням. Аналогічно тому, як ∆Wмех= А, ∆Wтепл =Q - кількість теплоти (міра зміни енергії системи шляхом теплообміну).
Q не може "міститись" у тілі, не може "затрачуватись"; система може одержати або віддати Q.
Ознака адіабатного процесу: Q=0.
Забезпечити умову адіабатного процесу можна двома способами:
а) теплоізолювавши систему (вата, поролон, вакуум);
б) зменшивши час протікання процесу. (Одягнений у кожух чи "дублянку" може надовго "потонути" у кучугурі снігу, а людина, яка вибігла з сауни неодягненою, зможе пірнути в кучугуру лише на кілька секунд без шкоди для себе).
Адіабата подібна до ізотерми, але крутіша.
При адіабатному стисненні більшість газів нагрівається (наприклад нагрівання ніпеля насоса при нагнітанні повітря у камеру велосипедного колеса), а при адіабатному розширенні охолоджується (наприклад навіть улітку працюючий від стисненого повітря відбійний молоток вкривається інеєм). Виняток - водень і гелій: охолоджуються при стисненні, нагріваються при розширенні (зворотний ефект Джоуля-Томсона).
Температурна шкала Кельвіна (термодинамічна шкала)
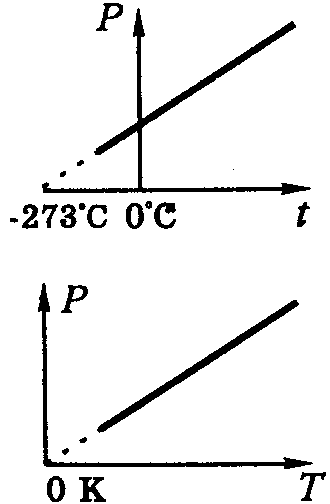 Експериментальний
графік закону Шарля (для різних
газів, аж до гелію), умовно продовжений
до перетину з віссю температур.
Експериментальний
графік закону Шарля (для різних
газів, аж до гелію), умовно продовжений
до перетину з віссю температур.
Тиск газу зник би при t= -273°С.
Той же графік у координатах p→T, де T=(t+273)K.
