
Дист лекции Кудряшов / Фазовое_равновесие
.pdfТЕРМОДИНАМИКА ГЕТЕРОГЕННЫХ РАВНОВЕСИЙ
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
Условия равновесия гетерогенной системы описываются правилом фаз Гиббса. Любая гетерогенная система характеризуется определенным числом фаз, компонентов и числом степеней свободы.
Фазой (Ф) называется совокупность всех гомогенных частей системы, одинаковых во всех точках по составу и по всем химическим и физическим свойствам и отделенная от других частей поверхностью раздела.
В более коротком определении фаза – это однородная часть неоднородной системы, которая может быть извлечена из системы каким-либо механическим способом. Каждая фаза может быть разделена на отдельные части, но это не увеличивает число фаз в системе. Например, в насыщенном растворе поваренной соли при наличии на дне сосуда любого числа кристаллов соли и пара над раствором будет находиться одна кристаллическая, одна жидкая и одна паровая фазы. Из определения следует, что в любой системе практически может быть только одна газовая фаза (только при высоких давлениях в ряде газовых смесей наблюдается расслоение).
Число составных частей – это число тех видов частиц, составляющих систему, которые могут существовать отдельно и вне системы. В водном растворе поваренной соли можно насчитать много видов частиц (молекулы соли и воды, гидратированные ионы Na+, Cl-, H+, OH-). В действительности же в системе содержится две составные части: вода и поваренная соль, так как ни один из перечисленных выше ионов не может быть извлечен из данной системы в отдельности.
Компонентами (К) называют независимые составные части системы, т.е. те вещества, наименьшее число которых необходимо и достаточно для образования всех возможных фаз данной системы, находящейся в равновесном состоянии. Число компонентов равно числу составных частей минус число связей, которыми могут быть химическая реакция или тождественность составов фаз. При определении числа компонентов их химическая природа не имеет значения, поэтому абсолютно не важно какие именно вещества выбираются в качестве компонентов. Например, при разложении карбоната кальция образуется твердый оксид кальция и углекислый газ. Число составных частей системы – 3, а компонентов – 2. Одно уравнение связи: Kp =рСО2. Если происходит разложение NH4Cl на газообразные аммиак и хлористый водород, то уравнений связи будет 2 – Kp=pNH3 pHCl и pNH3= pHCl. В связи с этим число составных частей системы – 3, а компонентов – 1.
Число степеней свободы (f) – это число термодинамических параметров, определяющих состояние и природу системы, которые можно произвольно менять в известных пределах без изменения числа и вида фаз в системе. Обычно такими параметрами являются температура, давление, концентрации, мольные объемы компонентов. В некоторых случаях свойства системы могут определяться и другими переменными факторами – электрическим потенциалом, магнитным полем, поверхностным натяжением и т. п.
В зависимости от числа термодинамических степеней свободы различают системы инвариантные (нон-, безвариантные), моновариантные (одновариантные), дивариантные

(би-, двухвариантные), поливариантные (многовариантные). В первых – сохранение равновесия требует неизменности всех параметров, во вторых – неизменности всех, кроме одного, и т.д.
Термодинамические условия равновесия. В равновесной гетерогенной системе температура во всех фазах должна быть одинаковой, так как в противном случае система не будет находиться в состоянии теплового равновесия. Это же относится и к давлению, так как в противном случае система не будет находиться в механическом равновесии.
Согласно второму началу термодинамики в состоянии равновесия при р,T=const изменение энергии Гиббса равно нулю. Энергия Гиббса является функцией давления, температуры и состава:
G = f(p, T, n1, n2, n3, ….., nk)
Изменение энергии Гиббса можно вычислить по уравнению
|
dG |
|
|
|
dG |
|
|
|
|
|
dG |
|
|
|
|
|
||||
dG |
|
|
|
|
|
|
|
dT + |
|
|
|
dn |
|
|||||||
= |
|
|
|
|
|
dp + |
|
|
|
|
|
|
|
|
|
|
||||
|
|
dp |
|
|
|
|
|
dT |
|
|
|
|
|
|
dn |
|
|
|
|
i |
|
|
|
|
|
|
p ,n |
,n |
,....,n |
|
|
|
|
|
|
|
|||||
|
|
T ,n |
,n |
,....,n |
|
|
|
k |
1 |
p,T ,n |
,.....,n |
|
|
|||||||
|
|
|
|
k |
|
|
1 |
2 |
|
|
|
|
k |
|
||||||
|
|
|
|
1 |
2 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
||
|
dG |
|
|
dn |
|
|
|
|
|
|
|
|
||
+ |
|
|
|
|
i + |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
dni p ,T ,n |
n |
i |
|
|
|
|
|
|
|
|
|||
|
|
|
j |
|
|
|
|
|
|
|
|
|
||
|
|
dG |
dG |
|
|
dG |
|
|
||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Но так как |
|
|
|
= V, |
|
= S, |
|
|
= μi, |
|||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
dT p |
|
dn |
|
|
||||
|
|
dp T |
|
|
i |
T , p,n j ni |
|
|||||||
|
|
|
|
|
||||||||||
то это уравнение принимает вид:
dG = Vdp – SdT + ∑μidni
При p, T = const
dG = ∑μidni
Для равновесных систем
+
dG = 0 и ∑μidni = 0
Для выполнения этих соотношений необходимо, чтобы химический потенциал любого компонента во всех фазах должен быть одинаковым.
Условия термодинамического равновесия любой изолированной системы записываются следующими уравнениями (подстрочные индексы обозначают компоненты,
надстрочные – фазы):
T' = T'' = T''' = ….. = TФ p' = p'' = p''' = ….. = pФ
1'
=
'' 1
= 1''' = ….. = 1Ф
………………………..
'K = 'K' = 'K'' = ..... = ФK
Правило фаз. Рассмотрим систему, состоящую из К компонентов, каждый из которых находится во всех Ф фазах. В качестве независимых переменных можно принять температуру, давление и концентрации. Если концентрации компонентов заданы в массовых или молярных процентах (или в молярных долях), то нет необходимости указывать концентрации всех компонентов, так как концентрация какого-либо компонента в данной фазе будет определена, если задана концентрация остальных компонентов, т.е. достаточно указать (К—1) концентраций. Таким образом, для каждой

фазы независимыми являются (К—1) концентраций. Так как число фаз равно Ф, то для всех фаз число независимых концентраций равно Ф(К—1), кроме того, для рассматриваемой системы независимыми переменными являются температура и давление, следовательно, число всех независимых переменных равно Ф(К—1) + 2.
Определим число уравнений, связывающих эти Ф(К—1)+2 независимые переменные.
Ряды уравнений, составленных на основании равенств: T' = T'' ; Т' = T''' ; ….. ; Т' = TФ
p' = p'' ; p' = p''' ; ….. ; p' = pФ
представляют собой ряды тождеств, поскольку температура и давление являются независимыми переменными, определяющими состояние системы. Уравнения,
составленные на основании равенств химических потенциалов: |
|
|
|||||||||
{ |
' |
'' |
' |
|
|
''' |
' |
|
|
Ф |
|
|
|
|
|
|
|||||||
|
1 |
= 1 ; |
1 |
= |
|
1 |
; ….. , 1 |
= 1 |
|
||
|
' |
'' |
|
' |
|
|
''' |
' |
|
Ф |
|
|
2 |
= 2 ; |
2 = |
2 ; ….., |
2 |
= |
2 |
||||
К |
…………………………………….. |
|
|||||||||
|
' |
'' |
|
' |
|
|
''' |
|
' |
|
Ф |
|
K |
= K |
; K |
= |
K ; ….., |
K |
= |
K |
|||
Ф – 1 не являются рядами тождеств, так как химический потенциал одного и того же
компонента в различных фазах описывается различными функциями концентраций, температуры и давления. В явном виде эти функции не известны.
Каждая строка этой алгебраической системы состоит из Ф—1 независимых уравнений. Всякое другое уравнение, отражающее равенство двух химических потенциалов, входящих в эту строку, может быть получено комбинацией уже имеющихся уравнений, а поэтому не будет независимым уравнением. Число строк в этой системе равно К, а общее число уравнений, связывающих Ф(К—1)+2 переменных, равно К(Ф—1). Отсюда следует, что не все Ф(К—1)+2 переменные будут независимыми. Известно, что если имеется система независимых уравнений, причем число неизвестных больше числа уравнений, то число независимых переменных равно числу всех переменных минус число уравнений. В данном случае число независимых переменных, определяющих состояние системы, равно:
Ф(К—1) + 2 – К(Ф—1) = –ФК – Ф + 2 – ФК + К = К – Ф + 2
Это число и будет числом термодинамических степеней свободы (вариантностью) системы. Обозначая его символом f, получаем
f = К – Ф +2
или
f = K' – q – Ф +2,
где K' – число составляющих системы, а q – число ограничений, накладываемых на систему.
Полученные уравнения является математической формой выражения правила фаз Гиббса, оно может быть сформулировано следующим образом:
число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только температура и давление, равно числу независимых компонентов системы минус число фаз плюс два.
Если в какой-либо фазе один из компонентов отсутствует, то число переменных уменьшится на единицу (концентрация этого компонента в рассмотренной фазе), но тогда в системе уравнений будет отсутствовать соответствующий химический потенциал и, следовательно, число уравнений уменьшится тоже на единицу. Разность же между этими величинами (число переменных минус число уравнений) останется той же. Это означает, что число степеней свободы и в этом случае определяется по приведенной выше формуле, т.е. эта формула выражает правило фаз и в том случае, когда компоненты присутствуют не во всех фазах.
В соответствии с вышесказанным вариантность системы для примера разложения карбоната кальция будет равна 1, т.к. тут присутствует две твердые фазы (не путать с агрегатным состоянием!) и одна газовая. Для разложения NH4Cl вариантность также будет равна 1, т.к. компонентов 1, а число фаз – 2: твердая и газообразная.
Если состояние системы определяется кроме температуры, давления и концентраций еще одним внешним фактором, приобретающим при равновесии то или иное, но, разумеется, одинаковое значение во всех фазах, например электрическим потенциалом, то число независимых переменных увеличится на единицу и будет равно (К–1)+3. Число уравнений, связывающих параметры, остается прежним (Ф–1)К, и число степеней свободы определится выражением:
f = 3 + (K – 1)Ф – (Ф – 1)К = К – Ф +3
В общем случае, если число внешних факторов, одинаковых во всех фазах системы, равно п, правило фаз имеет вид
f = К – Ф + п
Если какой-либо внешний фактор, характеризующий систему, поддерживается постоянным, то число переменных становится на единицу меньше. Так, при p = const (или Т = const) правило фаз записывается следующим образом:
fусл. = К – Ф + 1
Вариантность такого рода называется условной, и можно говорить об условно инвариантном, условно моновариантном равновесии и т.д. В таком виде правило фаз Гиббса широко применяется при изучении диаграмм состояния систем, образованных практически нелетучими веществами, к которым относятся соединения, содержащие силикаты. В этом случае давление пара настолько мало, что им можно пренебречь и данные системы можно считать полностью конденсированными. Влияние давления на эти системы очень невелико.
При постоянстве двух внешних факторов, например р и Т = const, правило фаз приобретает вид
fусл. = К – Ф
ФАЗОВЫЕ ПРЕВРАЩЕНИЯ В ОДНОКОМПОНЕНТНЫХ СИСТЕМАХ
Однокомпонентными системами являются такие системы, в которых отдельные фазы представлены одним и тем же веществом. Согласно правилу фаз Гиббса, число фаз в равновесной однокомпонентной системе равно:
Ф = 1 + 2 – f = 3 – f.
Наибольшее число степеней свободы для однокомпонентной системы существует при наименьшем числе фаз, которое в то же время не может быть менее единицы. Тогда
fmax = K + 2 – Ф = 1 + 2 – 1 = 2.
Основными параметрами такой системы являются температура и давление. Наименьшее число степеней свободы должно равняться нулю (отрицательным по определению оно быть не может). Тогда число фаз в однокомпонентной системе будет наибольшим:
Фmax = 1 + 2 – 0 = 3
Следовательно, ни одно индивидуальное вещество не может образовать равновесную систему, состоящую более чем из трех фаз. Так, невозможно подобрать такие значения Р и Т, при которых кремнезем (SiO2) существовал бы одновременно, например, в виде α-кварца, β-кварца, α-тридимита и α-кристобалита, находящихся в равновесии.
Для графического изображения состояния системы при различных значениях T, P и V используют систему координат из трех взаимно перпендикулярных осей, каждая из которых отвечает значениям одной переменной. Любое состояние однокомпонентной системы, отвечающее той или иной совокупности величин T, P, V, изображается в такой системе координат одной точкой. Совокупность экспериментально полученных точек дает диаграмму, состоящую из нескольких более или менее сложных поверхностей, расположенных определенным образом в пространстве. Точки, не лежащие на этих поверхностях, не имеют физического смысла. Справедливость последнего вполне очевидна, ибо каждому сочетанию Т и P соответствует единственно возможное значение V для данной фазы. Подобные диаграммы называются объемными (или полными) диаграммами состояния.
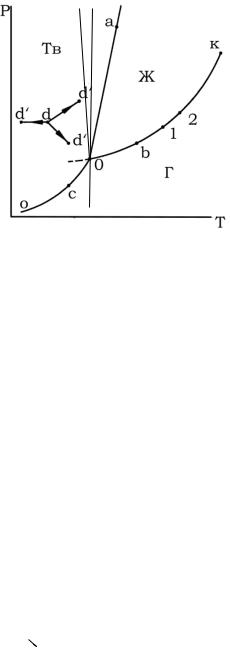
Однако полными диаграммами состояния обычно не пользуются, так как они громоздки и неудобны в обращении, а их изготовление весьма трудоемко. Всех этих недостатков лишены проекции таких диаграмм на одну из плоскостей, проходящих через оси координат. Наиболее употребительными параметрами, определяющими условия существования системы, являются Т и Р, так как они хорошо поддаются измерению и регулированию. Откладывая значения этих двух переменных по двум осям прямоугольной системы координат, строят двумерную (плоскую) диаграмму, которая приведена на рис. 1. Этот рисунок представляет собой проекцию полной диаграммы на плоскость Р–Т. Следует подчеркнуть, что на рис. 1 представлен вариант диаграммы простейшей однокомпонентной системы, которая характеризуется отсутствием полиморфных превращений и где понятие фазы совпадает с понятием агрегатного состояния.
Каждая точка на плоскости диаграммы выражает условия, при которых находится система, т.е. она представляет сочетание определенных величин температуры и давления. Благодаря этому вся диаграмма может быть разделена на несколько областей, каждая из которых охватывает всевозможные сочетания Т и Р, отвечающие равновесному существованию определенной фазы. Так, на рис. 1 область Г отвечает условиям равновесного существования газообразной фазы, область Ж – жидкой фазы и область Тв – твердой фазы. Точки, отражающие состояние и условия существования системы,
называются фигуративными точками.
В соответствии с правилом фаз число степеней свободы однофазной однокомпонентной системы будет равно:
f = К + 2 – Ф = 1 + 2 – 1 = 2.
Такая система является бивариантной. При наличии одной фазы можно произвольно, разумеется, в известных пределах (не переходя границ соответствующей области), менять давление и температуру, не изменяя числа и вида фаз в системе. Подобные произвольные изменения условий графически могут быть представлены смещением фигуративной точки, например d (рис. 5.1), на некоторое расстояние в любом направлении, допустим, в одну из точек d '.
a’
Рис. 1. Диаграмма состояния однокомпонентной системы в координатах давление
— температура
Пограничные линии ОК, Оа (Оа’), Оо принадлежат обеим соприкасающимся областям, и каждая точка на этих линиях может отвечать как совместному существованию двух фаз, так и наличию только одной из них. Следует иметь в виду, что всякий фазовый переход при постоянных Т и Р сопровождается изменением энтальпии системы, вследствие чего, например, в точке а жидкость и кристаллы сосуществуют лишь в том случае, если энтальпия системы выше энтальпии твердого состояния, но ниже энтальпии жидкого состояния, т. е. когда фазовый переход еще не завершен. Если переход еще не начался или уже завершен, то система представляет собой одну фазу. Следовательно, кривая Оа (Оа’)отвечает равновесному сосуществованию твердой и жидкой фаз; кривая Оо – твердой и газообразной фаз; кривая ОК – жидкой и газообразной фаз.
Двухфазная однокомпонентная система является моновариантной: f = K + 2 – Ф = 1 + 2 – 2 = 1.
Следовательно, если изменить условия существования системы, сохраняя равновесие между двумя фазами, например, жидкостью и паром (точка b на рис. 5.1), то можно произвольно изменить лишь один параметр состояния, например температуру. Давление же при этом следует изменить на вполне определенную величину так, чтобы фигуративная точка системы b смещалась строго по кривой ОК (точка 1 или 2).
Точка О отвечает равновесному сосуществованию трех фаз при данных температуре и давлении. Эту точку называют тройной. Любое изменение температуры или давления выводит фигуративную точку из положения О, и она попадает в области, где возможно равновесное сосуществование либо двух фаз, либо одной фазы. Равновесное сосуществование трех фаз возможно лишь при строго определенном сочетании значений температуры и давления. Для такого состояния число степеней свободы равно нулю, система инвариантна (нонвариантна):

f = K + 2 – Ф = 1 + 2 – 3 = 0.
Кривая испарения заканчивается точкой К, которая называется критической точкой и где исчезает всякое различие между жидкостью и паром. В этой точке на систему наложено дополнительное ограничение – тождественность свойств жидкости и пара, поэтому система в критической точке также инвариантна.
Таким образом, плоская диаграмма состояния однокомпонентной системы позволяет определить возможное число и характер фаз при выбранных условиях.
Рассмотрим двухфазную однокомпонентную систему. Химический потенциал чистого вещества определяется только температурой и давлением.
При равновесии ΔG=0, так что любому заданному значению одной из интенсивных переменных Р или Т соответствует определенное значение другой переменной. Это находится в соответствии с правилом фаз Гиббса, согласно которому такая система (К=1, Ф=2, f=1) одновариантна. Таким образом, в координатах Р–Т существует равновесная кривая ΔG=0 (см. рис. 1.1). При этом изобарно-изотермические потенциалы (энергия Гиббса) единицы массы чистого вещества в двух фазах, находящихся в равновесии, равны между собой. При изменении потенциала одной фазы для сохранения состояния равновесия в системе необходимо изменить потенциал другой фазы на ту же величину.
Например:
Gn + dGn = Gж + dGж
или dGn = dGж, где Gn – изобарно-изотермический потенциал вещества в парообразном состоянии, Gж – изобарно-изотермический потенциал вещества в жидком состоянии. Это изменение можно проследить на рис. 1 по кривой равновесия жидкость-пар (ОК). Перемещение из точки 1 в точку 2 по кривой ОК возможно при условии, что одновременно меняется температура и соответственно давление; следовательно, G меняется за счет давления и температуры. Так как энергия Гиббса для однокомпонентной системы является функцией двух переменных – G=f(P,T), то изменения энергии Гиббса вещества в каждой фазе с изменением температуры и давления выражаются уравнениями:
для пара – dGn = Vn·dP – Sn∙dT,
для жидкости – dGж = Vж∙dP – Sж∙dT
Но так как пар и жидкость находятся в равновесии, то dGn = dGж, поэтому можно
записать равенство:
Vn ∙dP – Sn ∙dT = Vж∙dP – Sж ∙dT.
После преобразования и разделения переменных получим:
dP |
|
S |
п |
S |
ж |
|
S |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
ф.п. |
dT |
V |
п |
V |
ж |
V |
|
||
|
|
|
||||||
|
|
|
|
ф.п. |
||||
|
|
|
|
|
|
|
|
Для любых фазовых переходов это уравнение можно записать в следующем виде:
|
dP |
|
S ' ' S ' |
. |
|
||||
|
dT |
V ' ' V ' |
|
||||||
|
|
|
|
|
|||||
Взаимное превращение фаз рассматривалось здесь как равновесное и |
|||||||||
изотермическое, поэтому |
|
|
|
|
|
|
|
|
|
|
Sф.п. |
|
H ф.п. |
. |
|
||||
|
|
Тф.п. |
|
||||||
|
|
|
|
|
|
|
|
|
|
Из этих двух уравнений получим: |
|
|
|
|
|
|
|
|
|
|
dP |
|
|
Hф.п. |
|
|
, |
||
|
|
|
|
|
V |
|
|
||
|
dT Т |
ф.п. |
|
|
|
||||
|
|
|
|
ф.п. |
|
||||
где Н – мольная (удельная) теплота фазового превращения, поглощаемая или выделяемая при переходе моль вещества из фазы 1 в фазу 2; Т ф.n. – температура фазового превращения; ΔVф.n. – разность мольных (удельных) объемов двух фаз.
Это уравнение называется уравнением Клапейрона–Клаузиуса. Оно справедливо только для фазовых переходов первого рода. Фазовые переходы первого рода характеризуются в точке превращения непрерывным изменением энергии Гиббса и скачкообразным изменением ее первых производных по параметрам состояния – энтропии и объема. К ним относятся плавление, испарение, возгонка и большинство полиморфных превращений. В случае фазовых превращений второго рода, т.е. превращений, которые характеризуются непрерывным изменением энергии Гиббса и ее первых производных по параметрам состояния, но резким изменением ее вторых производных, уравнение Клапейрона-Клаузиуса теряет смысл. Для таких превращений, примерами которых служат переходы магнитных веществ из ферромагнитного состояния в парамагнитное, переходы различных материалов в сверхпроводящее состояние и т.п., числитель и знаменатель в правой части уравнения Клапейрона-Клаузиуса обращаются в нуль, и оно принимает неопределенный вид - 0/0. При фазовых переходах второго рода вместо уравнения Клапейрона-Клаузиуса пользуются соотношениями Эренфеста.
Рассмотрим наиболее распространенные процессы фазовых переходов первого
рода.
Плавление. Плавлением называется процесс перехода вещества из кристаллического твердого состояния в жидкое, которое обусловлено скачкообразным изменением его внутреннего строения. При фиксированной температуре тело стремится минимизировать свободную энергию – энергию Гельмгольца - А = U - TS. При низких температурах второе слагаемое – связанная энергия (произведение температуры и энтропии) - несущественно, и в результате всё сводится к минимизации внутренней энергии U. Состояние с минимальной энергией — это кристаллическое твёрдое тело. При повышении температуры, второе слагаемое становится всё важнее, и при некоторой температуре оказывается выгоднее разорвать некоторые связи. В ходе повышения температуры энергия U слегка возрастает, но при этом сильно растет и энтропия, что в результате приводит к понижению свободной энергии. Существует некоторая корреляция между температурой плавления и энергией кристаллической решетки. Для соединений, кристаллизующихся в решетках одного и того же типа, с увеличением энергии решетки возрастает и температура плавления.
Процесс плавления кристалла можно рассматривать как накопление в нем вакансий. При повышении температуры возрастает амплитуда тепловых колебаний структурных единиц в кристаллической решетке вокруг положения равновесия и время от времени возникают дефекты решетки. Каждый такой дефект требует определённого количества энергии, поскольку он сопровождается разрывом некоторых межатомных связей. Стадия рождения и накопления дефектов называется стадией предплавления. Когда амплитуда превысит среднее межатомное расстояние, начинается переход твердого тела в новое агрегатное состояние — жидкость, пар. Возникающие в кристалле вакансии склонны к флуктуационному слиянию; при их скоплении образуются линии и поверхности разрыва, которые обособляют друг от друга группировки различного, но небольшого размера. Если с повышением температуры химические связи в решетке разрываются постепенно и равномерно, то кристалл тоже постепенно размягчается и превращается вначале в очень вязкую жидкость, структура которой близка к структуре исходного твердого тела. Так

размягчаются кварц, полевые шпаты, шлаки. Если же с повышением температуры решетка резко расширяется и химические связи в ней разрываются быстро и неравномерно, то в кристалле вблизи точки плавления возникают хаотически расположенные микроучастки метастабильной жидкой фазы, после чего он сразу же полностью (конгруэнтно) или частично (инконгруэнтно) переходит в легкоподвижную жидкость. Так плавится большинство кристаллов кальциевых соединений.
Плавление это эндотермический процесс. Теплотой плавления или скрытой теплотой плавления называется количество теплоты, которое необходимо сообщить веществу, нагретому до температуры плавления, чтобы его расплавить. Теплота плавления – всегда положительна. Объем (мольный, удельный) жидкой фазы (Vж) в общем случае может быть больше или меньше объема того же количества твердой фазы (Vтв.). Отсюда в соответствии с уравнением (5.24) величина dP/dT (тангенс угла наклона линии Оа к оси температур на рис. 1) или обратная ей dT/dP, характеризующая изменение температуры плавления с увеличением давления, может быть положительной или отрицательной.
Величина dT/dP положительна для большинства веществ. Однако для некоторых веществ она имеет отрицательное значение, так как при температуре плавления Vж<Vтв. К наиболее важным таким веществам относится вода. Хорошо известно, что при нормальных условиях плотность льда (величина обратная удельному объему) меньше плотности воды, поэтому температура плавления льда понижается с увеличением давления. При плавлении большинства веществ их плотность уменьшается, поэтому для них температура плавления с давлением возрастает.
Влияние давления на точку плавления вообще невелико. При повышении давления
на 1 атм. температура плавления воды понижается на 0,00750С (
dP dT
133 |
атм |
|
K |
||
|
), висмута
на 0,00360С (Vж<Vтв), у олова и свинца температура плавления повышается соответственно на 0,00330С и 0,00830С (Vж>Vтв). Поэтому кривая плавления Оа (Оа’) до довольно высоких давлений практически является прямой линией близкой к вертикальной линии. Для большей наглядности диаграмм кривой плавления обычно придают более сильный наклон и большую кривизну для линий возгонки и испарения. В связи с тем, что линия плавления практически прямая линия, то в первом приближении можно считать,
что |
dP |
сonst , то производную можно заменить конечными разностями, а учитывая что |
|
dT |
|||
|
|
плотность это величина обратная удельному объему, то можно получить следующую упрощённую формулу для фазового перехода из твердого в жидкость:
P P |
|
|
|
|
|
|
H |
|
|
, |
||
2 |
1 |
|
Т |
|
|
|
|
пл. . |
|
M |
||
T T |
|
|
1 |
|
|
|
|
1 |
||||
|
|
|
|
|
|
|
|
|
|
|
||
2 |
1 |
|
|
пл. |
|
|
ж |
|
|
тв . |
|
|
где пл.Н – мольная теплота плавления, |
Т |
пл. |
|
– температура плавления; Т1 и Т2 – |
||||||||
температуры плавления при давлениях Р1 и Р2 соответственно, М молекулярный вес, а ρж. и ρтв. плотности жидкой и твердой фазы.
Испарение и возгонка. Объем (мольный, удельный) пара всегда больше объема жидкости (твердого тела), т.е. для любых веществ ΔVф.n>О (за исключением критического состояния, когда ΔVф.n=0). Следовательно, dP/dT, а значит dT/dP также всегда положительны, поэтому температура испарения всегда повышается с ростом давления.
При температурах, далеких от критической, плотность насыщенного пара, т.е. пара, находящегося в равновесии с жидкостью, во много раз меньше плотности жидкости, обратная величина – мольный (удельный) объем пара – во много раз больше мольного (удельного) объема жидкости. Поэтому в уравнении Клапейрона–Клаузиуса значение ΔVф.n.≈ Vnapa и тогда это уравнение принимает вид:
dP |
|
|
Hисп. |
. |
(5.25) |
|
dT |
Т |
исп. |
V |
|||
|
|
|
пара. |
|
|
|
При допущении, что вдали от критической температуры насыщенный пар подчиняется законам идеальных газов Vпара=RT/P, уравнение (5.24) принимает вид:
d ln P |
|
H |
исп. |
|
|
|
|||
dT |
|
RТ |
2 |
|
|
|
|||
.
(5.26)
Разделив переменные, получим:
|
H |
|
|
|
d ln P |
исп. |
dT |
||
RT |
2 |
|||
|
|
|||
|
|
|
||
.
(5.27)
В небольшом температурном интервале можно допустить, что скрытая теплота парообразования или возгонки постоянна. Тогда можно проинтегрировать уравнение (5.27) следующим образом:
при определенном интегрировании в пределах Р1 и Р2 и Т1 и Т2 получим:
ln
|
P |
|
|
|
2 |
|
|
|
P |
|
|
|
|
||
1 |
= Нисп. / R (1 / Т1 – 1 / Т2) ,
(5.28)
а при неопределенном интегрировании –
lnP = – Нисп. / RT + const . (5.29)
Из уравнения (5.28) видна линейная зависимость lnP от 1/Т, причем угловой коэффициент прямой
tg α = – ΔH исп. / R . |
(5.30) |
Наиболее грубым допущением, принятым при выводе |
уравнения (5.28) и |
снижающим точность расчетов, служит предположение о независимости Н исп. от Т, хотя известно, что в соответствии с уравнением Кирхгофа
|
dΔH исп. / dT = ΔC |
(5.31) |
При температурах далеких от критической можно считать, что |
|
|
|
ΔC = ΔCp = Cp п. – Cp ж. |
(5.32) |
При этом следует учитывать, что величина Ср является функцией температуры, |
||
поэтому зависимость |
Нисп. от Т можно выразить уравнением: |
|
|
Н исп. = аТ + 1/2ΔвТ2 +1/3ΔсТ3 - с'/Т + В , |
(5.33) |
где а, в, с, |
с' – разность эмпирических констант, описывающих зависимости |
|
теплоемкостей пара и жидкости от температуры, а В – постоянная интегрирования, которая определяется обычно по значению теплоты испарения при температуре 298 К.
Тогда взаимосвязь между давлением насыщенного пара и температурой будет
описываться следующим уравнением: |
|
lnP = 1/R(Δa lnТ +1/2 в T + 1/6 ΔcT2 +1/2Δc'1/T2- B/T) + const. |
(5.34) |
Все сказанное выше относительно испарения действительно и для |
процессов |
возгонки, только вместо Нисп. нужно использовать величину Нвозг..
Зная зависимость давления насыщенного пара от температуры можно аналитически и графически найти теплоту испарения, сублимации и даже теплоту плавления в тройной точке. Для этого можно воспользоваться теми же формулами, что и при определении теплового эффекта эндотермической реакции по изобаре Вант-Гоффа.αβ
