
Дист лекции Кудряшов / Хим равновесие - 1
.pdfХ И М И Ч Е С К О Е С Р О Д С Т В О. Х И М И Ч Е С К О Е Р А В Н О В Е С И Е.
Вопрос о химическом сродстве веществ или об их способности вступать в химическую реакцию является одним из важнейших. Данное понятие не очень четко сформулированное возникло еще во времена алхимии. Составлялись специальные таблицы, в которых было указано, какие вещества могут взаимодействовать друг с другом. Понятие же химического равновесия для алхимиков не играло никакой роли, так как реакции, с которыми они имели дело – растворение металлов в кислотах, прокаливание карбонатов, восстановление земель, т.е. оксидов металлов, – действительно чаще всего проходили до конца из-за удаления образующихся газов из реакционной зоны.
Исторически основоположником учения о химическом равновесии считается Клод Луи Бертолле. Участвуя в экспедиционном походе Наполеона в Египет, он обратил внимание на отложения твердой соды на берегах соляных озер, большое число которых можно до сих пор созерцать в пустыне Сахара. Свои наблюдения он изложил в своей книге «Исследование законов сродства». Сода, по его мнению, образовывалась при взаимодействии известняка и хлорида натрия. Обычно этот процесс идет в обратном направлении. По мнению Бертолле слабое сродство реакции образования соды усиливалось большим количеством соли. По аналогии с механикой он рассматривал равновесие как статический результат действия двух противоположных сил.
В середине 19-ого века трудами тщательные исследования многими учеными (Бертло, Бекетов, Сент-Жиль) достаточно медленных обратимых химических реакций (например, реакция этерификации этилового спирта) норвежкими физхимиками Гульдбергом и Вааге было сформулировано общее для всех подобных реакций, протекающих в растворах или газах условие химического равновесия, которое они назвали законом действующих масс:
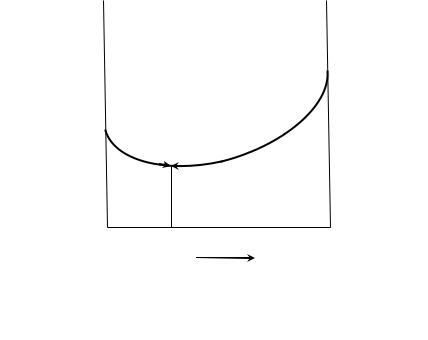
Если имеется простая химическая реакция, то скорость такой реакции пропорциональна текущим концентрациям исходных веществ в степенях стехиометрических коэффициентов. Обратимую реакцию часто можно рассматривать как совокупный результат прямой и обратной реакции. Рассмотрим реакцию:
aA+bB cC+dD
Скорость прямой реакции, по мере расходования исходных веществ,
будет уменьшаться:
r1 = k1cAa cBb,
а скорость обратной реакции будет увеличиваться в связи с образованием
продуктов реакции:
r2 = k2cСс cDd.
(См. рис. 1)

К моменту наступления равновесия скорости прямой и обратной реакции становятся одинаковыми, т.е.
r1 = r2 k1[A]a [B]b = k2[C]с [D]d,
где в квадратные скобки заключены равновесные концентрации, или
|
k |
|
D |
C |
|
K |
|
|
|
d |
c |
|
1 |
a |
B |
||
|
k |
2 |
|
A |
B |
|
|
|
|
|
|
,
Это уравнение Гульдберг и Вааге назвали законом действующих масс. Величина K, названная впоследствии Вант-Гоффом константой равновесия, не
зависит |
от исходного соотношения реагентов и продуктов реакции, но |
изменяется |
с температурой. Из данного определения константы равновесия, |
очевидно, что это величина может принимать только положительные значения. Кроме того из этого определения можно сделать вывод, что если K >> 1, т.е. равновесные концентрации реагентов или хотя бы одного из них очень малы, или могут быть приравнены к нулю, то это будет реакция, которая идет практически до конца. Если K = 0 или К << 1, т.е. концентрации продуктов реакции очень малы или равны нулю, то эта реакция практически неосуществима. Как будет показано ниже твердые вещества, если они участвуют в химической реакции в закон действующих масс не входят. Смысл введенного Гульдбергом и Вааге условия равновесия, в согласии со статическими представлениями Бертолле, состоял в том, что при равновесии силы сродства прямой и обратной реакции выравниваются. Однако силы сродства определяются не массами реагирующих веществ, как полагал Бертолле, а «действующими массами» - массами в единице объема, т.е. концентрациями. Если выбрать в качестве единицы объема литр, как это принято в химии, то получим молярную концентрацию.
r
r1
r2
τ
Рис. 1. Зависимость скорости реакции от времени.
При данном выводе допущений. Например, мы пропорциональна текущим
закона действующих масс был использован ряд рассматривали простые реакции, когда скорость концентрациям исходных веществ в степенях
стехиометрических коэффициентов. Рассмотрим термодинамическое обоснование закона действующих масс.
Уравнение изотермы химической реакции (изотерма Вант-Гоффа)
Если в результате обратимой химической реакции при постоянстве V, T или P,T в системе установилось химическое равновесие, то концентрации исходных веществ и продуктов реакции, изменявшиеся в ходе реакции, далее уже более не изменяются. Состояние равновесия является динамическим, т.е. как уже было сказано в системе одновременно протекают прямая и обратная реакции. Неизменность состава системы во времени при постоянстве V, T или P,T является необходимым, но не достаточным признаком химического равновесия. Реакция может протекать с очень малой скоростью, которую в реальных условиях невозможно измерить. Иногда скорость реакции может вообще оказаться равной нулю. Например, смесь водорода и кислорода могут бесконечно долго существовать при комнатной температуре в замкнутом объеме. Однако, если внести какой-нибудь инициатор реакции например катализатор или поднять температуру до 5100С – температуры самовоспламенения водорода, то она произойдет с взрывом. В таких случаях говорят, что система находится в метастабильном неустойчивом равновесии.
Очень важно уметь отличать состояние истинного химического равновесия от метастабильных состояний. Устойчивые химические равновесия характеризуются следующими условиями:
1.В отсутствие внешних воздействий химический состав остается неизменным.
2.При внешнем воздействии (изменении V, P или T) система переходит в другое состояние. Эти признаки характерны и для метастабильных состояний;
3.Подвижность равновесия – самопроизвольное восстановление равновесия после прекращения внешнего воздействия (возвращение V, P или T к первоначальным значениям). Возращение метастабильной системы в исходное состояние необязательно;
4.Малое внешнее воздействие на систему вызывает малое изменение ее состояния, например малое изменение состава системы. Для метастабильного равновесия малое внешнее воздействие на систему может вызвать значительное изменение ее состояния. Смесь водорода с кислородом превращается в жидкую воду.
5.Возможность подхода к состоянию равновесия с двух противоположных сторон. Это существенно отличает истинное химическое равновесие от метастабильных состояний.
6. Изобарный (изохорный) потенциал системы при постоянных значениях P и T (V, T) или, в котором протекала химическая реакция, уменьшался и принял минимальное значение.
Рассмотрим для примера классический пример газофазной реакции, которую тщательно исследовал знаменитый немецкий физхимик Макс Боденштейн в начале прошлого века:
H2 + I2 2HI
G2
G1
dG=0
0% HI |
% HI |
100% HI |
(H2+I2) |
|
(2HI) |
Рис.2 Изменение изобарного потенциала по мере протекания реакции
Если имеется только смесь стехиометрических количеств йода и водорода (100%), то, как показано на рис.2, ее изобарный потенциал характеризуется величиной G1. По протекания реакции, т.е. по мере образования HI и изменения составов слева направо, изобарный потенциал G уменьшается.
Когда достигается равновесный состав, G прекращается. К этому же равновесному составу можно подойти и с другой стороны. Если взять чистый иодоводород (100%), то его разложение также будет идти с уменьшением G. При равновесии G достигает минимального значения и dG=0, d2G>0.
Для того чтобы оценить возможность самопроизвольного протекания реакции и охарактеризовать удаленность системы от состояния равновесия, а также найти величину полезной работы, которую можно получить при обратимом проведении реакции, надо рассчитать G для превращения стехиометрических количеств веществ в реакционной смеси данного состава при постоянстве P и T или A при постоянстве V и T.
Рассмотрим самопроизвольно протекающую газофазную реакцию при постоянстве P и T:
aA+bB cC+dD
Будем считать, что участвующие в ней вещества являются идеальными газами и находятся в таких количествах, что убыль реагентов и образование

продуктов реакции в смеси по стехиометрии не приводят к изменению состава и условий существования системы. Это означает, что если в исходной смеси идеальных газов парциальные давления были pA, pB, pC, pD, то после одного пробега реакции, т.е. после превращения стехиометрических количеств веществ эти давления практически не изменятся.
Изменение энергии Гиббса данной реакции равно разности между энергией Гиббса продуктов и исходных веществ.
∆ G P,T = Gпрод. – Gисх. = с GС + d GD - a GA - b GB,
где Gi – мольные энергии Гиббса, соответствующих компонентов или их химические потенциалы.
Для идеальных газов:
|
|
|
0 |
~ |
|
|
|
|
(T ) RT ln Р |
||
i |
i |
||||
|
|
i |
, где
~ |
|
P |
|
P |
|
P |
|
i |
i |
||
i |
|
P |
0 |
|
1атм |
|
|
|
|||
|
|
|
|
||
|
|
i |
|
|
|
Pi
(атм.),
Тогда:
|
|
|
|
|
0 |
~ |
0 |
~ |
|
0 |
|
|
|
~ |
0 |
~ |
|
|
|
∆ G P,T = d D RT ln PD |
c C |
RT ln PC - a A RT ln PA b B |
RT ln PB . |
||||||||||||
|
|
Раскрывая скобки, получим уравнение, которое называется изотермой |
|||||||||||||||
химической реакции или изотермой Вант-Гоффа: |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
~ d |
~ c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
P |
|
|
|
|
||
|
|
|
|
|
|
|
∆ G P,T = r GT |
RT ln |
~ a ~ b |
|
|
, |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
P |
P |
|
|
|
|
|
|
|
|
|
|
|
|
- a A |
|
|
A |
B |
тек . |
|
|
|||
|
|
где |
r GT |
d D |
c C |
b B , а индекс «тек.» |
указывает на то, что |
||||||||||
|
|
|
|
|
0 |
0 |
0 |
0 |
|
|
|
|
|
|
|
|
|
берутся текущие парциальные давления в рассматриваемой газовой смеси. |
|||||||||||||||||
|
|
Если исходная смесь все компоненты в стандартных условиях, т.е. pA = |
|||||||||||||||
p |
B |
= p |
C |
= p |
= 1 атм, то ∆ G |
P,T = |
G . Следовательно |
G |
- стандартное |
||||||||
|
|
D |
|
|
|
r |
|
T |
|
|
|
|
r |
T |
|
||
изменение энергии Гиббса. |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
Уравнение изотермы Вант-Гоффа позволяет оценить принципиальную |
|||||||||||||||
возможность протекания реакции. Если |
|
∆ G P,T >0, то реакция идет в сторону |
|||||||||||||||
образования исходных веществ, если ∆ G P,T <0, то реакция идет в прямом |
|||||||||||||||||
направлении. |
Если |
∆ G P,T =0, то наступает равновесие. В этом состоянии |
|||||||||||||||
давления всех компонентом становятся равновесными: |
|
|
|
|
|||||||||||||
0 = r GT |
RT ln |
||
|
|
|
|
|
|
|
|
r GT |
- RT ln |
||
|
|
|
|
|
~ d |
~ c |
|
PD |
PC |
||
|
|
|
|
~ a ~ b |
|||
PA |
PB |
рав н.. |
|
|
~ d |
~ c |
|
|
|
||
P |
|
P |
|
|
|
||
|
D |
|
C |
|
|
, |
|
~ a ~ b |
|
||||||
|
P |
|
P |
|
|
|
|
A |
|
B |
рав н.. |
|
|||
|
|
|
|
|
|
|
|
~ d |
|
~ c |
|
|
|
|
|
PD |
PC |
|
, |
|
|||
|
|
|
|
|
|
||
~ a |
|
~ b |
|
|
|||
PA |
PB |
рав н.. |
|
||||
GT
e RT ,
Правая часть этой формулы зависит только от температуры, следовательно и и левая часть будет константой при постоянной температуре. Эту константу называют стандартной термодинамической константой равновесия:
|
|
~ d |
~ c |
|
|
P |
P |
||
|
D |
C |
|
|
K p |
~ a ~ b |
|||
|
|
P |
P |
|
|
A |
B |
||
|
|
G |
|
|
|
|
|
|
|
|
|
T |
|
|
e |
RT |
, |
||
|
рав н..
Выражение констант равновесия через давления, концентрации или активности называют в настоящее время законом действующих масс. В данном выражении индекс «р» означает, что константа равновесия выражена через равновесные давления.
Полученные выражения являются частным случаем уравнения изотермы Вант-Гоффа и позволят связать константу равновесия со стандартным
изменением энергии Гиббса реакции. Благодаря этому можно рассчитать |
p , |
|
K |
|
|
не проводя трудоемких экспериментов по изучению равновесия, как это делал Макс Боденштейн.
В соответствии с вышесказанным, исходя из того, что |
G |
RT ln K |
, |
r |
T |
p |
|
уравнение изотермы Вант-Гоффа можно записать еще двумя способами:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
~ d |
~ c |
|
|
|
|
|
|
|
|
|
|
|
∆ G P,T = |
|
|
|
|
|
P |
P |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
D |
|
C |
|
|
|
|
|
|||||
|
|
|
|
|
RT ln K p + RT ln |
~ a |
~ b |
|
, |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
B |
тек . |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
~ d |
~ c |
|
|
|
|
~ d |
|
~ c |
|
|
||
|
|
|
|
|
|
|
|
|
P |
|
P |
|
|
|
P |
|
P |
|
||||
|
|
|
|
∆ G P,T = RT ln |
D |
|
C |
|
|
|
|
|
D |
|
C |
|
|
|||||
|
|
|
|
~ a |
~ b |
, + RT ln ~ a |
~ b |
, |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
P |
|
P |
рав н. |
|
|
|
P |
|
P |
тек . |
||
|
|
|
|
|
|
|
|
|
A |
|
B |
|
|
|
A |
|
B |
|||||
|
|
|
~ d ~ c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
P |
|
через |
П, то |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Если обозначить |
~ a ~ b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
D |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
B |
тек . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
∆ G P,T = |
RT ln K |
p + RT ln П = RT ln |
|
. |
||||||||||||||
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
П |
|
|
В связи с тем, что ∆ G P,T = -Wmax,' |
p ,T , |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
W |
' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
то |
|
|
|
|
|
max, p ,T = |
RT ln |
П |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Величина |
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
которую можно |
||
|
max, p ,T |
т.е. максимальная полезная работа, |
||||||||||||||||||||
|
W |
|
' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
получить при обратимом проведении реакции называется химическим сродством или сродством реакции, а уравнение изотермы Вант-Гоффа называют иногда уравнением химического сродства.
Если рассматривать химическую реакцию как термодинамически необратимый процесс, заканчивающийся состоянием химического равновесия, то чем больше по модулю величина химического сродства, тем больше
отклонение в ту или иную сторону от равновесия. Если Wmax,' |
p ,T >0, то реакция |
||
протекает в прямом направлении, если |
|
max, p ,T < 0, то реакция течет в обратном |
|
|
W |
' |
|
|
|
|
|
направлении.
Зависимость химического сродства от значения П не позволяет сравнивать между собой сродство различных химических реакций. Для устранения этого затруднения можно ввести По произведение реакции в

стандартных условиях, когда парциальные давления каждого из участников реакции – реагентов и продуктов реакции равно стандартному значению 1 атм.
W
'
max, p,T
=
|
K |
|
|
|
p |
||
RT ln |
|
||
П |
|||
|
|||
=
RT ln
K |
0 |
|
p |
||
|
/
В России стандартное сродство чаще всего заменяют |
|
, |
||||
r GT |
||||||
отличающегося от него только знаком. |
|
|
|
|
|
|
|
|
K |
|
|
|
|
Следует отметить, что если r GT |
>0, т.е. |
p <1, то данная реакция не |
||||
|
||||||
идет самопроизвольно при данной температуре в стандартных условиях.
Принципиальная осуществимость процесса определяется знаком |
∆ GP,T. В |
|||
таблицах приводят значения r GT |
. Зная порядок величины |
r GT |
, можно |
|
|
|
|
|
|
иногда распространить вывод, строго применимый только к стандартным
условиям и |
на |
любые другие. Так, |
если r GT >>0, можно сказать, что и |
|||||
∆ GP,T > 0 и реакция невозможна при любых разумных составах смеси. |
||||||||
Очевидно, |
что |
если r GT при |
|
данной |
температуре |
имеет большое |
||
отрицательное |
значение, т.е. |
K |
|
очень |
велика, то |
принципиально |
||
p |
||||||||
|
||||||||
осуществима при этой температуре не только в стандартных условиях, но и в любых других.
Способы выражения констант равновесия. Эмпирические константы равновесия.
В выражении констант равновесия всегда используются данные о составе равновесной реакционной смеси, т.е. исключительно в момент равновесия. При этом состав реакционной смеси может быть выражен через парциальные давления, концентрации, мольные доли и количества молей компонентов. Константы равновесия, выраженные через опытно определяемые количественные характеристики состава равновесной смеси, называют эмпирическими.
Стандартная термодинамическая константа равновесия безразмерная величина:
|
|
~ d |
~ c |
|
|
|
PD |
PC |
|
||
K p |
|
|
|
, |
|
~ a ~ b |
|||||
|
PA |
PB |
рав н.. |
|
|
где |
~ |
|
Pi |
|
Pi |
- |
обезразмеренное |
парциальное |
давление |
Pi |
|
|
|||||||
P 0 |
1атм |
||||||||
|
|
|
i |
|
|
|
|
|
|
соответствующего компонента. Если в выражение для стандартной термодинамической константы равновесия подставить просто парциальные давления, то получим эмпирическую константу равновесия, которая будет иметь размерность давления в степени Δν= d+c –(a+b):

|
|
|
|
|
P |
d |
P |
c |
|
|
|
|
|
|
|
||
|
|
|
|
K Р |
a |
b . |
|
|
|
|
|
|
|||||
|
|
|
|
|
D |
|
C |
|
|
|
|
|
|
|
|||
|
|
|
|
|
P P |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
A |
|
B |
|
|
|
|
|
|
|
|||
0 |
0 |
|
o |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– давление в 1 |
атм., выраженное в соответствующих |
|||||||||||||||
K P K Р P |
|
, где P |
|||||||||||||||
единицах: |
K P |
0 |
|
|
|
|
|
|
|
|
выражена в атм. |
Δν |
, если |
||||
K Р , если эмпирическая константа K P |
|
||||||||||||||||
|
|
|
|
|
|
|
|
Δν |
|
|
0 |
5 |
|
|
|
||
эмпирическая константа K P выражена в Па |
, то |
K P K |
. |
|
|
||||||||||||
|
|
Р 1,013 10 |
|
|
|
||||||||||||
Используя уравнение состояния идеального газа, выразим парциальные
давления через концентрации:
K |
Р |
|
|
|
p |
i |
|
|
|
|
P |
d |
|
|
||
|
D |
|
P |
a |
|
|
||
|
A |
|
c |
i |
|
|
|
|
P |
c |
|
|
|
|
C |
|
|
P |
b |
|
|
|
|
B |
|
|
RT |
|
|
с |
|
|
|
с |
. Тогда:
d |
с |
c |
|
|
|
D |
C |
(RT ) |
|
||
|
|||||
a |
с |
b |
|
||
|
|
||||
A |
B |
|
|
||
|
|
|
=
K |
|
(RT ) |
|
c |
|
||
|
|
|
Величина
K |
c |
|
, как и
K |
p |
|
зависит только от температуры, но не зависит от
общего давления. Если парциальные давления выражены в атм., а концентрации в моль/л, то в данном выражении следует использовать универсальную газовую постоянную в подходящей размерности R=0,082 л∙атм /моль К .
Парциальное давление можно выразить через общее давление по закону
Дальтона: Pi= xi P, где
Тогда :
|
|
n |
|
x |
|
i |
|
ni |
|||
i |
|
||
|
|
- мольная доля соответствующего компонента.
|
|
|
P |
d |
P |
c |
|
K |
|
|
|
|
|
||
|
D |
C |
|||||
|
|
|
|
||||
|
Р |
|
P |
a |
P |
b |
|
|
|
|
|
|
|
||
|
|
|
A |
B |
|
||
x |
d |
x |
|
D |
|||
|
|
||
x |
a |
x |
|
A |
|||
|
|
c |
|
|
C |
P |
|
b |
|
|
|
|
|
B |
|
|
=
K |
P |
|
|
||
x |
|
|
n |
d |
n |
|
D |
|||
|
|
||
n |
a |
n |
|
A |
|||
|
|
c C b B
|
P |
|
|
|
n |
|
|
|
i |
||
|
|
|
|
|
|
|
|
|
=
|
P |
|
|
|
|||
K n |
n |
|
|
|
i |
|
|
|
|
.
Из этих формул можно выразить эмпирические константы через термодинамическую:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
0 |
|
o RT |
|
o |
P |
|
|
|
o |
|
|||||||
|
|
|
|
|
i |
|
|
||||||||||||
K P K p P |
|
; K C K p 0 |
|
|
|
; K x K P |
P |
0 |
|
|
; K n |
K P |
|
P |
|
|
|||
|
|
|
|
P 0 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В случае реальных газов при высоких давлениях проявляются |
|||||||||||||||||||
силы взаимодействия |
между |
молекулами |
|
и |
K p |
будет зависеть от |
|||||||||||||
давления. |
Поэтому |
вместо |
давления |
необходимо |
использовать |
||||||||||||||
исправленное давление – фугитивность fi |
: |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
~ |
|
~ |
|
f |
i |
|
|
|
|
|
|
|
|
o RT ln f |
, где |
f |
|
|
|
и f |
|
P |
|
, |
||
i |
i |
|
|
i |
i |
|||||||||
|
i |
i |
|
|
|
P |
0 |
|
i |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
~ fi
~ |
|
|
P |
i |
|
i |
|
; GP,T i i 0
Тогда константу химического равновесия, которая не будет
зависеть от давления можно выразить через |
fi |
: |
||||
К 0 |
|
~f D ~f D |
|
|
||
|
D |
E |
|
|
|
|
~f A |
~f B |
|
|
|||
f |
|
|
|
|||
|
|
|
|
|||
|
|
A |
B |
|
|
|

где |
K P |
f (P), K |
f (P), |
Для реакций формулами:
|
|
|
P |
|
D P |
|
E |
|
|
|
|
|
|
||||
K |
|
|
|
D |
E |
|
||
f |
|
|
|
A P |
|
B |
||
|
|
P |
||||||
|
|
|
|
|
||||
|
|
|
|
|
A |
B |
|
|
но |
K f |
|
f (P) |
|||||
в растворах
|
|
|
D |
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||
|
|
D |
|
|
E |
K |
|
K |
|
||
|
|
|
A |
|
|
B |
P |
||||
|
|
|
|
||||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
A |
|
B |
|
|
|
|
|
||
.
химический потенциал выражается
i |
i |
RT ln ci |
для идеальных растворов и |
i |
|
o |
|
|
|
ai- активность i-ого компонента или Соответствующими выражениями для констант
o |
RT ln аi для реальных, где |
i |
исправленная концентрация. равновесия в растворах будут:
|
|
|
c |
|
D |
c |
|
E |
K |
|
|
|
D |
|
E |
||
|
|
|
|
|
||||
|
c |
|
c |
|
A |
c |
|
B |
|
|
|
|
A |
|
B |
|
|
и
|
|
|
a |
|
D |
a |
|
E |
|
|
|
|
|
||||
K |
|
|
D |
E |
||||
|
|
|
||||||
a |
|
|
A |
|
|
B |
||
|
|
a |
a |
|||||
|
|
|
|
|
||||
|
|
|
A |
B |
||||
|
|
|
|
|
||||
.
