
Дист лекции Кудряшов / Растворы3
.pdf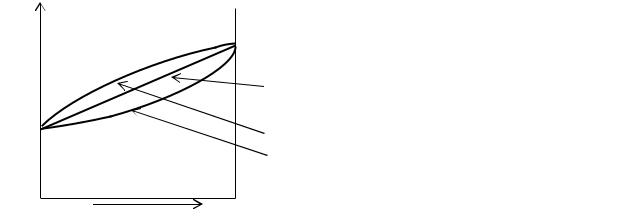
Особенности равновесий в системах пар – непрерывные растворы летучих жидкостей.
Рассмотрим бинарные жидкие системы, в которых оба компонента летучи. При смешении таких жидкостей могут наблюдаться 3 случая:
1)Неограниченная взаимная растворимость жидкостей. Образуется одна жидкая фаза, т.е. компоненты могут образовывать раствор при любых соотношениях. Например, система «этанол – вода».
2)Ограниченная взаимная растворимость жидкостей. Например, система «анилин – вода». Образуются две фазы: «раствор анилина в воде» и «раствор воды в анилине».
3)Полная (практически) взаимная нерастворимость жидкостей друг в друге. Например, система «бензол – вода». Образуются две фазы: «чистый бензол» и «чистая вода».
Условия равновесия в двухфазных двухкомпонентных системах
определяются следующими равенствами:
Неограниченная взаимная растворимость жидкостей.
Зависимость давления насыщенного пара от состава жидкости.
Рассмотрим сначала наиболее простой случай, когда жидкость и пар представляют собой идеальные растворы.
Рассмотрим зависимость общего давления насыщенного пара от
состава жидкой фазы: |
ж |
. Для идеального раствора справедлив закон |
Pобщ f x2 |
для обоих компонентов:
Pi Pi 0 xi ,
|
|
0 |
x |
0 |
x |
0 |
|
0 |
x |
P |
0 |
(P |
0 |
0 |
)x |
ж |
P P P P |
P |
P |
(1 x ) P |
|
|
P |
|
|||||||||
1 |
2 |
1 |
1 |
2 |
2 |
1 |
2 |
2 |
2 |
1 |
2 |
1 |
2 |
|||
(1)
Как видно из формулы (1) это линейная зависимость.
Если растворы неидеальны, то вместо концентрации необходимо использовать исправленную концентрацию – активность:
P P 1
Так как зависимости.
P2
|
i |
|
0 |
a |
P |
|
1 |
1 |
f x |
|
|
ж |
|
i |
,
0 |
a |
P |
|
2 |
2 |
то
P (1 x ) |
||
0 |
|
|
1 |
1 |
2 |
зависимость
P |
|
x |
0 |
|
|
2 |
2 |
2 |
P |
|
|
общ |
|
|
f
P |
|
0 |
|
1 |
|
x |
ж |
|
|
2 |
|
1
( |
2 |
|
2 |
1 |
|
1)x2 . |
||
|
P |
0 |
|
P |
0 |
ж |
||
|
|
|
|
|
|
|
||
отклоняется от линейной
P жидкость
P10 пар
1 |
x2 |
|
P 0 Линия насыщенного пара Робщ=f(xж), 2 давление пара над
идеальным раствором над реальным
с положительными отклонениями с отрицательными отклонениями от идеальности.
2
Рассмотрим |
теперь зависимость общего давления насыщенного пара |
||
от состава пара: |
п |
|
для идеального раствора. Экспериментально |
Pобщ f x2 |
|||
установлено, что состав насыщенного пара над раствором отличается от состава жидкости, с которой он находится в равновесии. Определим
парциальное давление |
каждого компонента через закон Рауля: Pi |
Pi |
0 |
xi |
и |
|
|
|
|
|
|
через закон Дальтона: Pi |
Pобщ xi . |
|
|
|
|
|
п |
|
|
|
|
P |
0 |
x |
ж |
P |
x |
п |
P |
|
|
||||
1 |
1 |
1 |
общ 1 |
|||
P |
0 |
x |
ж |
P |
x |
п |
P |
|
|
||||
2 |
2 |
2 |
общ 2 |
|||
Разделив первое выражение на второе, получим: |
|
|
||||||
|
|
|
|
|
|
. |
|
x2 . |
|
|
|
|
|||||
Из полученного выражения видно, что в общем случае |
x2 |
|||||||
|
|
|
|
|
|
|
п |
ж |
Составы жидкости и пара могут совпасть, если давления насыщенных паров
над чистыми компонентами одинаковы: |
1 |
= P2 |
. Когда это условие не |
|
|
P |
0 |
0 |
|
|
|
|
|
|
выполняется, то пар будет обогащен более легко летучим компонентом, т.е.:
если |
1 |
> P2 |
, то |
1 |
> |
1 |
. Этот факт отражен в первом законе Коновалова, |
|||
|
P |
0 |
0 |
|
x |
ж |
|
x |
п |
|
|
|
|
|
|
|
|
|
|||
который справедлив и для неидеальных растворов:
Насыщенный пар по сравнению с равновесным с ним раствором относительно богаче тем компонентом, добавление которого к системе повышает общее давление пара или понижает температуру кипения при данном давлении.
Из закона Дальтона и закона Рауля можно получить:
Из (2) можно выразить
хж
2
|
|
|
|
0 |
x |
ж |
|
|
|
|
|
|
|
0 |
x |
ж |
|
|
|
|
|
||
x |
п |
|
P |
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
||||||
|
2 |
|
2 |
P |
|
|
|
2 |
|
|
2 |
|
|
|
x |
|
|||||||
|
2 |
|
|
P |
|
|
|
|
0 |
P |
0 |
P |
0 |
ж |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
общ |
|
|
1 |
|
|
2 |
|
|
|
|
1 |
|
|
2 |
|||||
: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
0 |
x |
п |
|
|
|
|
|
|
|
||
|
|
|
|
ж |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
||||
|
|
|
x |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
2 |
|
0 |
|
P |
0 |
P |
0 |
x |
п |
|
||||||||||
|
|
|
|
|
|
P |
|
||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
||||||||||||
|
|
|
|
|
|
|
2 |
|
|
2 |
|
|
|
|
1 |
|
|
|
|
||||
(2)
(3)
Подставляя (3) в (1) получаем зависимость давления насыщенного пара над раствором от состава пара:
P 0 P 0
P 1 2 (4)
P20 P20 P10 x2п
Из выражения (4) видно, что
через точку |
1 |
при x2 =0 и |
2 |
при |
||
|
P |
0 |
п |
P |
0 |
|
|
|
|
|
|
||
эта зависимость гипербола, проходящая x2п =1
P |
|
жидкость |
|
0 |
Пограничная кривая жидкости |
|||
|
|
|||||||
|
|
|
||||||
|
|
|
.m |
|
P2 |
Р =f(xж), (1). |
||
|
|
|
|
|
|
|
|
общ |
|
с |
a |
|
|
b |
|
пограничная кривая пара Робщ=f(xп), |
|
|
|
|
||||||
P 0 |
|
|
d |
|
(2)для идеального раствора. |
|||
|
|
|
|
|
||||
1 |
|
|
|
пар |
|
|
Гетерогенная область жидкость+ |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
пар. |
||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
x2 |
|
|
|||
|
|
|
|
|
|
|
||
На рис. представлена P-x диаграмма для идеального раствора. Вернее сказать проекция P-x фазовой диаграммы, снятой при постоянной температуре. На ней представлены зависимости общего давления пара от состава жидкости (1) и от состава пара (2). Поскольку более летучим компонентом является компонент 2, то за исключением точек пересечения этих кривых, все точки кривой пара смещены вправо от кривой жидкости.
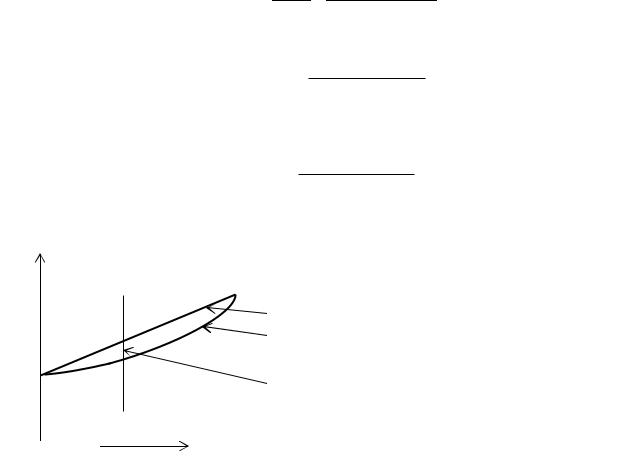
Линии жидкости и пара делят все поле диаграммы на три области. Выше кривой жидкости находится область условий (давлений и составов), при которых существует жидкий раствор, ниже линии пара – область условий, при которых существует, только пар. Между этими линиями находится область существования жидкости и равновесного с ней пара. точка b лежит правее точки a. Изобары проведенные между линиями жидкости и пара называются коннодами (ab, cd) – линиями, соединяющими составы фаз, находящихся в равновесии: Точка a(c) – состав жидкости, находящейся в равновесии с паром, имеющей состав b(d). Любая точка на диаграмме называется фигуративной. Она полностью характеризует состояние системы. Так точка m соответствует жидкому однофазному раствору состава xm. При уменьшении давления эта точка будет перемещаться вниз. В точке a жидкость начнет испаряться, появится первый пузырек пара состава xb. Система станет двухфазной. При последующем уменьшении давления фигуративная точка m, показывающая валовый состав гетерогенной системы, будет опускаться вниз. При этом количество паровой фазы будет увеличиваться, количество жидкой фазы уменьшаться. Происходить это будет по правилу рычага, которое мы рассмотрим несколько позже. Когда давление опустится до точки d , то почти вся жидкость перейдет в пар. Последняя капля жидкости имеет состав xс, а состав пара будет соответствовать первоначальному составу жидкости xm.
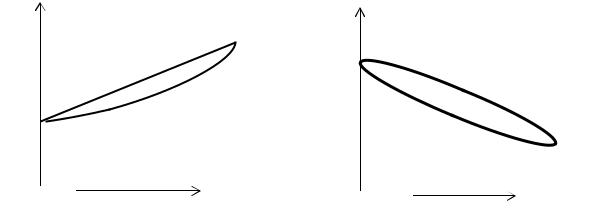
Рассмотренный процесс называется изотермической перегонкой. Однако удобнее проводить перегонку при постоянном давлении, например при одной атмосфере. Для этого используют проекцию Т-x фазовой диаграммы. При переход от P-x проекции к Т-x проекции необходимо учесть, что, более легко летучий компонент 2 имеет более низкую температуру кипения. А так как температура кипения нелинейно зависит от давления насыщенного пара, то кривая жидкости (1) в координатах Т-x не будет прямой линией, и диаграмма будет иметь форму двояковыпуклой линзы.
P |
жидкость |
|
P 0 |
Т |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|||||
|
|
|
|
|
||||
|
|
|
|
|
|
|||
|
|
|
2 |
|
пар |
|
|
|
|
1 |
|
|
0 |
|
|
||
|
|
|
Т1 |
|
2 |
|
||
|
2 |
|
|
|
ж+п |
|
||
P 0 |
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
1 |
пар |
|
|
|
1 |
|
|
|
|
|
|
|
|
Т20 |
|||
|
|
|
|
|
жидкость |
|
||
|
|
|
|
|
|
|
||
1 |
|
|
2 |
1 |
|
|
|
|
x2 |
|
|
|
|||||
x2 |
2 |
|||||||
|
|
|||||||
|
|
|
||||||
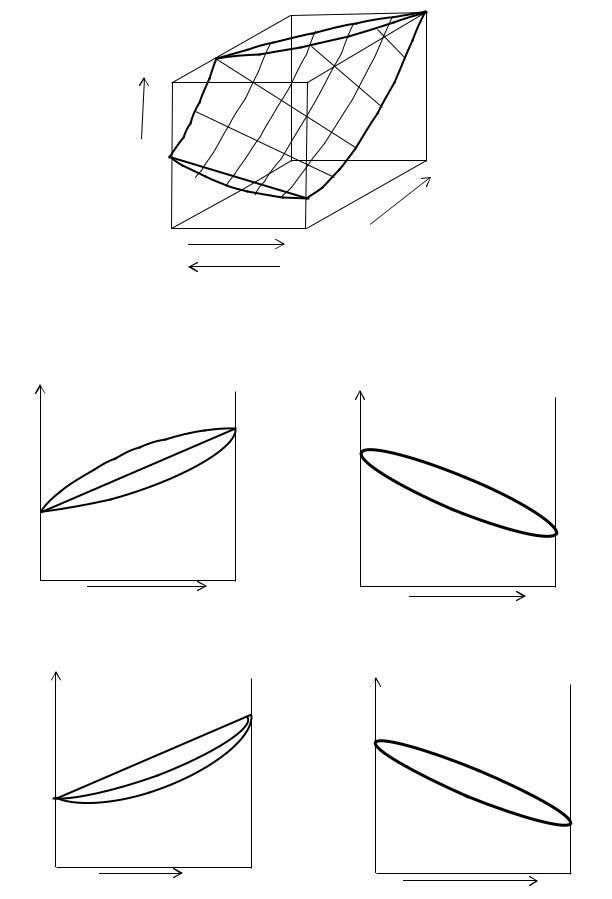
На левом рисунке линия 1 называется кривой испарения: линия 2 – кривой конденсации: Т=f(xп). P-x проекции к Т-x проекции
Т1
Т2
P
P2
P10 Т
0 |
1 |
|
х1 |
х2
Из этой трехмерной диаграммы хорошо виден переход P-x проекции к Т-x проекции. Эти проекции еще называют диаграммами кипения.
Для неидеальных растворов P-x и Т-x несколько отличаются от таковых для идеальных растворов. При положительных отклонениях от идеальности:
P жидкость
P10 пар
1 x2
Т=const
При отрицательных:
P жидкость
P10 пар
1
x2
P20
2
P20
2
Т
Т10 пар ж+п
жидкость
1
x2 P=const
Т
Т10 пар ж+п
жидкость
1 x2
Т20
2
Т20
2
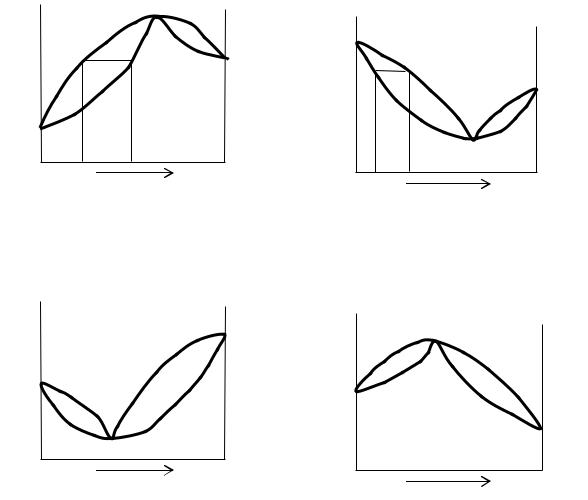
При значительных отклонениях от идеальности зависимость общего давления пара над раствором от его состава имеет экстремум. Если это минимум, то это отрицательные отклонения от идеальности, а если это максимум, то это положительные отклонения от идеальности. Если на на Т-x диаграмме экстремумы ярко выражены, то с достаточно большой вероятностью можно сказать, что, если это максимум, то это отрицательные отклонения от идеальности, а если это минимум, то это положительные отклонения от идеальности.
P ж |
Аз |
|
Т |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
a |
b |
P 0 |
Т1 |
|
|
|
|
|
|
a |
п |
|||
|
|
|
2 |
|
b |
||
|
|
|
|
|
|
Т20 |
|
|
|
|
|
|
|
|
|
P10 |
хж |
хп |
п |
|
|
|
|
1 |
|
|
п |
ж |
Аз ж |
||
|
|
2 |
1 |
х |
х |
2 |
|
|
|
x2 |
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|
x2 |
|
|
Т=const |
|
|
|
P=const |
||
Положительные отклонения от идеальности
P |
P20 |
Т |
Аз |
ж |
п |
||
P 0 |
Аз |
Т10 |
|
1 |
|
|
|
|
п |
ж |
0 |
|
|
|
Т2 |
1 |
2 |
1 |
2 |
|
|||
|
x2 |
||
|
|
x2 |
|
Т=const |
|
P=const |
|
Отрицательные отклонения от идеальности
Растворы, отвечающие экстремальным точкам, называются азеотропными.
Термодинамическое обоснование законов Коновалова.
Согласно второму закону Гиббсаа-Дюгема для бинарного раствора можно записать:
x1ж d 1 x2ж d 2 0 ,
При равновесии |
i |
|
i |
, а |
i |
i,п RT ln |
||||
|
|
ж |
|
п |
|
|
п |
|
0 |
|
получим уравнение Дюгема-Маргулиса: |
|
|
|
|||||||
|
x |
ж |
d ln P |
x |
ж |
d ln P |
0 |
|||
|
|
2 |
||||||||
|
1 |
|
|
1 |
|
|
2 |
|
||
или: |
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
ж |
dP |
x |
ж |
dP |
0 |
|
|
|
|
1 |
2 |
|
|||||
|
|
|
|
|
|
|
||||
|
|
|
|
1 |
P |
|
2 |
P |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
1 |
|
|
2 |
|
|
Pi
. Взяв производную,
Отсюда можно получить:
Из закона Дальтона
|
dP |
|||
|
1 |
|
|
|
P P |
x |
п |
||
i |
||||
i |
общ |
|
||
|
dP |
|
||
|
1 |
|||
|
|
|||
|
dР |
|
||
|
|
2 |
|
|
x |
ж |
P |
|
2 |
|
||
|
1 |
dP |
|
|
ж |
|
|
x |
P |
2 |
|
|
|
||
1 |
2 |
|
|
следует, что
|
x |
ж |
x |
п |
|
|
|
||
|
2 |
1 |
||
|
|
|||
|
x |
ж |
х |
п |
|
|
2 |
||
|
1 |
|
||
P |
|
x |
1 |
|
|
|
|
|
P |
|
x |
2 |
|
|
п
1 п
2
, а
Согласно закону Дальтона
dP |
|
dP |
|
dP |
|
|
общ |
1 |
2 |
||||
|
|
|
||||
dx |
|
dx |
|
dx |
|
|
2 |
|
2 |
|
2 |
|
P |
|
P |
|
общ |
|
1 |
|
dP |
|
|
dP |
2 |
1 |
1 |
|
dx |
|
|
dР |
|
|
||
2 |
|
2 |
|
P2 , |
dP |
|
x |
|
x |
|
|
|
dP |
|
x |
|
x |
|
|
|
||
|
|
ж |
п |
|
п |
ж |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
2 1 |
|
2 |
1 |
|
|
2 |
|
2 |
|
ж |
2 |
|
|
|||
|
|
dx |
|
х |
ж |
х |
п |
|
|
dx |
|
(1 х |
)х |
п |
||||
|
|
|
|
2 |
|
|
|
2 |
2 |
|
||||||||
|
2 |
1 |
|
|
2 |
|
|
|
|
|||||||||
Рассмотрим случай, когда |
dPобщ |
dx2 0 (диаграмма с азеотропом и |
|
||||
положительными отклонениями от идеальности, левая часть). |
Так как |
||||||
dP |
dx 0 всегда, то |
х п x ж |
, т.е. соблюдается 1 закон Коновалова. Для |
||||
2 |
2 |
2 |
2 |
< 0 |
, то так как dP2 dx2 0 всегда, то |
х2 |
< x2 , т.е. |
правой части, когда |
dPобщ dx2 |
||||||
|
|
|
|
|
|
п |
ж |
соблюдается 1 закон Коновалова. Повторим его еще раз:
Насыщенный пар по сравнению с равновесным с ним раствором относительно богаче тем компонентом, добавление которого к системе повышает общее давление пара или понижает температуру кипения при данном давлении.
Рассмотрим случай, когда
dPобщ dx2
0
, т.е. экстремум. Так как dP2 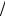 dx2 0
dx2 0
всегда, то
хп xж
2 2
и соответственно
х |
п |
x |
ж |
|
|
||
1 |
1 |
||
, т.е. соблюдается 2 закон
Коновалова, который гласит, что:
В точках экстремумов общего давления пара (или температуры) жидкость и пар имеют одинаковый состав.
Применение правила фаз
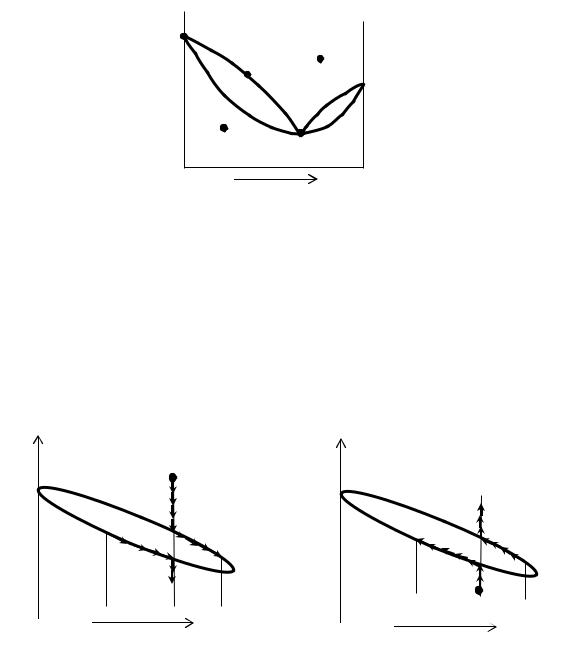
Так как P-x диаграммы снимаются при постоянной температуре, а Т-x диаграммы - при постоянном давлении, то правило фаз Гиббса будет выглядеть следующим образом:
f = K – Ф + n – q, где f – число степеней свободы, K – число компонентов, Ф – число фаз, n - число внешних параметров, влияющих на термодинамическую систему, обычно 1, q - число ограничений.
f = K – Ф + 1 – q
Т |
3 |
|
|
|
Т10 |
2 |
п |
1 |
|
|
|
|
||
|
|
|
|
Т20
|
4 |
|
|
Аз |
ж |
1 |
x2 |
2 |
|
|
f1 = K – Ф + 1 – q =2-1+1-0=2 f2 = K – Ф + 1 – q =2-2+1-0=1 f3 = K – Ф + 1 – q =1-2+1-0=0 f4 = K – Ф + 1 – q =2-1+1-0=2 fАз = K – Ф + 1 – q =2-2+1-1=0
Изображение процессов нагревания и охлаждения на Т-x диаграмме.
Т |
|
|
п |
|
|
l |
|
Т |
0 2 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Т10 |
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
Т |
|
|
|
|
|
|
|
|||||||
|
ж+п |
|
2 |
|
|
1 |
|
ж+п |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
1 |
|
|
|
|
Т20 |
|
|
|
|
|
|
|
|
|
|
Т20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
ж |
хж |
x хп |
|
|
ж |
хж |
|
|
k |
хп |
||||||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
1 |
|
|
|
|
|
|
|
|
x |
|
|||||||||||
|
|
|
x2 |
2 |
1 |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
x2 |
|
|
2 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Если пар состава х (точка l) охлаждать, то, не меняя своего состава, он охладится до температуры, соответствующей точке пресечения пунктирной линии с кривой конденсации. Противоположное окончание конноды (изотермы), проходящей через эту точку будет показывать состав первой капли жидкости, сконденсировавшейся из пара. Состав пара будет меняться по линии конденсации (2), а состав жидкости по линии испарения (1). При этом количество пара будет уменьшаться, количество жидкости увеличиваться. Состав последнего пузырька будет соответствовать составу хп, а состав жидкости стане равным первоначальному составу пара в точке l.
Если нагревать жидкость состава точки k, то повернув стрелки в обратном направлении, получим, что жидкость будет нагреваться, не меняя своего состава до пересечения с линией испарения (1). Здесь образуется
первый пузырек пара, состав которого по мере повышения температуры будет менять свой состав по линии конденсации (1) от хп до первоначального состава жидкости точки k. Жидкость будет менять свой состав по линии испарения. Количество жидкости будет уменьшаться, и состав последней капли жидкости будет соответствовать составу хж. Этот состав будет находиться в равновесии с составом, отвечающим точке k.
Правило рычага.
Это правило позволяет определить количество пара и жидкости в гетерогенных смесях.
Т |
|
|
|
0 |
2 |
п |
|
Т1 |
1 ж+п |
|
|
|
o |
b |
|
|
a |
||
|
|
||
|
|
|
|
ж |
хж |
|
|
Т20 |
|
х0 |
хп |
|
||
1 |
|
||||
|
|
x2 |
2 |
||
|
|
|
|||
Пусть в системе содержится M молей смеси. I – молей пара. M-I – молей жидкости. Составим материальный баланс по компоненту 2. Этот компонент будет распределяться между жидкостью и паром.
M х0= хп+( M-I) хж
Раскрывая скобки, найдем:
;
|
|
|
|
|
|
|
|
; |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Диаграммы состав раствора - состав пара.
Т |
|
|
|
|
1 |
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
xп |
|
|
0 |
|
|
п |
|
|
|
|
|
|
|
B |
|
|
||
Т1 |
|
|
|
|
|
|
|
|
|
|
b’ |
|
xп |
|
|
|
b |
a |
a’ |
|
|
|
|
ж |
|
|
|
|
|
|
|
|
|
|
Т20 |
|
Линия равного состава |
||
|
|
|
|
|
|||
|
|
|
|
|
жидкости и пара |
|
|
xж xж |
xп |
xп |
xж |
x |
|
||
1 |
|
|
x2 |
2 |
0 |
ж |
|
|
|
xж |
1 |
||||
|
|
|
|
|
|||
Обычно диаграмма состав раствора – состав пара строится по легколетучему компоненту.
Т |
|
|
|
1 |
|
|
Аз |
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
x2 |
|
|
Т1 |
|
|
|
пар |
|
|
ж |
|
Т20 |
|
|
|
|
1 |
|
2 |
|
0 |
x |
1 |
|
x2 |
|
|
|
||
|
|
|
|
|
2 |
|
|
|
|
|
|
жидкость |
|
Т |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
Т10 |
|
|
|
|
|
|
b |
a |
п |
0 |
|
|
|
|
Т |
x |
|
|
||
|
|
|
|
|||
|
|
|
2 |
2 |
|
|
|
|
|
|
пар |
|
|
п |
ж |
Аз ж |
|
|
|
|
1 х |
х |
2 |
|
0 |
x |
1 |
|
|
x2 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
жидкость |
|

Практическое применение равновесий между жидкостью и паром.
Перегонка и ректификация
На практике используют различие в составах раствора и равновесного с ним пара. Обычно разделение проводят при постоянном давлении.
Простая перегонка
В лаборатории обычно проводится в колбах Вюрца. Суть метода заключается в постепенном испарении жидкости с непрерывным отводом и конденсацией образующихся паров. Постепенно в колбе остается только высококипящий компонент. Получить чистый легколетучий компонент при простой перегонке не удается. Высококипящего вещества в чистом виде также получается очень мало. Целесообразно простую перегонку применять при очень большой разнице в составах жидкости и пара.
|
|
|
|
|
|
|
|
холодная |
|
|
|
|
|
|
|
|
|
|
|
|
|
вода |
|
|
|
|
|
|
|
|
Перегоня |
|
|
|
ввод |
|
|
|
|
||
|
|
|
|
|
|
ввод |
|
|
|
|
|||
|
|
|
емая |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
жидкость |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
вывод |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
дистиллят |
||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Более эффективным методом является фракционная перегонка. Этот процесс заключается в многократном повторении процессов испарения и конденсации. В результате можно получить практически чистые более легколетучий и менее легколетучий компоненты.
В промышленности и в лаборатории используют ректификацию. Это сложный неравновесный процесс, в ходе которого происходит непрерывный обмен веществом между находящимися в контакте паром и жидкостью. Этот процесс проводят в ректификационных колоннах. В этих колоннах пар от кипящего раствора поднимается вверх и встречает на своем пути стекающую жидкость, образующуюся при конденсации пара. Эта жидкость называется флегмой (слизь).
