
Дист лекции Кудряшов / Фазовое_равновесие
.pdf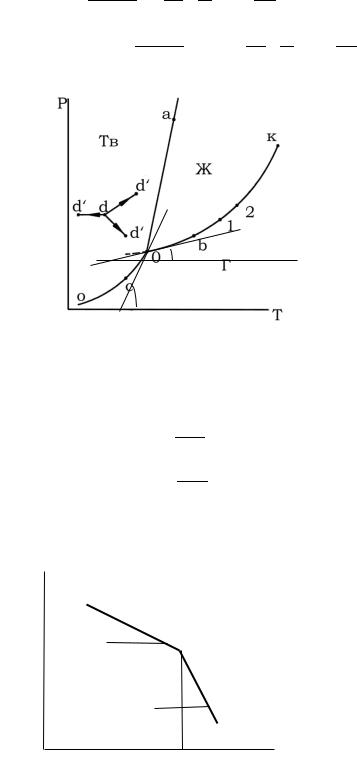
Например, если эмпирическое уравнение имеет вид: lnP=A+B/T +ClnT +DT+ET-2 ,
|
|
|
d ln K |
P |
|
B |
|
C |
D |
2E |
, |
||||||||
|
|
|
|
|
|
2 |
|
|
|
3 |
|||||||||
|
|
|
dT |
|
|
|
|
T |
|
|
T |
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
2 |
|
|
|
|
|
|
а |
Hисп.( субл.) |
RT |
2 |
d ln K p |
RT |
|
|
B |
|
C |
|||||||||
|
|
|
dT |
|
|
T |
2 |
T |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
то
D |
2E |
|||
T |
3 |
|
||
|
||||
|
|
|
||
α
β
Рис.2
Графически теплоту испарения и теплоту сублимации можно определить по формулам:
|
|
|
|
RT |
2 |
|
H |
|
|
tg |
|
исп. |
|
||||
r |
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
RT |
2 |
|
H |
|
|
tg |
|
субл. |
|
||||
r |
|
|
P |
|
|
|
|
|
|
|
По закону Гесса теплота сублимации в тройной точке равна сумме теплот испарения и плавления. Откуда можно найти теплоту плавления. Подобно данному методу можно определить теплоту плавления из графика lnP от 1/Т
lnp
α
o
β
1/Tтр.т. 1/T
ΔH пл.= ΔH субл.- ΔH исп.=R(tgβ-tgα)
Существуют также простые эмпирические формулы для расчета теплот фазовых переходов.Наиболе часто используются следующие:
а) Уравнение Трутона

Н |
исп |
Дж / моль К |
|
Т |
|
89,12 |
|
н.к. |
|
||
|
|
||
б) Теплота плавления органических веществ
Н пл Т пл
54.4 12,6
Дж / моль К
.
Зная зависимость давления насыщенного пара от температуры можно рассчитать, как было показано выше температуры плавления, кипения и сублимации. Отсюда можно найти изменение внутренней энергии.
Для плавления: U H Для сублимации и возгонки: U H RT Т.к. рассматриваются только равновесные фазовые переходы, при постоянных Р и Т
G 0 |
. А следовательно Sф.п. |
|
H |
ф.п. |
. Из этого положения можно также вычислить |
||
|
|||||||
|
|
||||||
|
T |
||||||
|
|
|
|
|
|
||
A |
|
|
|
|
|
|
|
фазового перехода, |
|
|
|
|
|
||
а) при плавлении, |
A G 0 |
|
|
|
|
||
б) при испарении: |
|
|
|
|
|
|
|
|
|
|
|
A G RT |
RT |
||
|
|
|
|
|
|
|
|
Полиморфные превращения. Некоторые вещества способны существовать в двух или нескольких формах с различной кристаллической структурой и свойствами при одном и том же химическом составе. Такие формы называются полиморфными модификациями. Взаимные превращения полиморфных модификаций называются полиморфными превращениями.
Различные модификации одного и того же вещества обозначают греческими буквами: Модификации принято считать от низких температур к высоким: α, β, γ. Для кремнезема у специалистов в области силикатов принято наоборот более высокотемпературную модификацию обозначать буквой α; модификации, образующиеся при более низких температурах, называют соответственно модификациями β и γ.
Взаимные превращения двух кристаллических модификаций, которые могут протекать самопроизвольно и в прямом и в обратном направлении в зависимости от условий (температура и давление) называются энантиотропными превращениями. Взаимные превращения двух кристаллических модификаций, которые могут протекать самопроизвольно только в одном направлении, называются монотропными превращениями.
Не всегда такие переходы осуществляются легко, часто наблюдается задержка превращения, в результате чего фаза становится термодинамически метастабильной. Однако на практике метастабильные фазы могут быть чрезвычайно устойчивыми и внешне не проявлять своей метастабильности. Достаточно напомнить метастабильный характер стекла, которое может сотнями лет не переходить в устойчивое кристаллическое состояние.
