
- •Ірина підгаєцька
- •Передмова
- •2.Заповніть таблицю:
- •3. Встановіть, яким типом хімічного зв’язку утворена речовина і запишіть її формулу у відповідну колонку таблиці – ki, BaCl2, n2, so2, o2, h2o:
- •4. Закінчить рівняння хімічних реакцій:
- •1. Заповніть пропуски в схемі класифікації дисперсних систем.
- •2. Розташуйте дисперсні системи в порядку зростання розмірів частинок, якими вони утворені:
- •3. Розташуйте назви речовин відповідно до певної дисперсної системи -
- •4. Заповніть пропуски :
- •5. Здійснити перетворення речовин:
- •1. Порівняйте ковалентний полярний та водневий зв’язки, заповніть таблицю, скориставшись довідником:
- •4. Розрахуйте відносну молекулярну масу кристалічної соди, формула якої Na2сo3*10h2o:
- •5. Вправа на повторення:
- •За розчинністю речовини поділяються на:
- •7. Заповніть пропуски в формулі електронної оболонки атому Кальцію, скаладіть графічну та електронну формули:
- •1. Визначить масову частку солі в розчині, який утворився внаслідок розчинення 20 г солі в
- •180 Г води.
- •2. Визначить масу солі, яка знаходиться в 200 г розчину з масовою часткою солі 10%.
- •4. Визначить масу солі в розчині, маса води в якому становить 180 г, масова частка солі 10%.
- •1. До розчину барій хлориду масою 200 г з масовою часткою солі 10% додали 200 г води. Визначить масову частку солі в новоутвореному розчині.
- •200 Г h2o w-? 200 г розчину 10% BaCl2
- •2. З розчину барій хлориду масою 200 г з масовою часткою солі 10% випарили 100 г води. Визначить масову частку солі в новоутвореному розчині.
- •100 Г h2o 200 г розчину 10% BaCl2 w-?
- •3. До розчину барій хлориду масою 200 г з масовою часткою солі 10% додали розчин барій хлориду масою 500 г з масовою часткою солі 20%. Визначить масову частку солі в новоутвореному розчині.
- •500 Г розчину 20%BaCl2 w-? 200 г розчину 10% BaCl2
- •4. Який об,єм водню виділиться при взаємодії цинку з хлоридною кислотою масою 20 г з масовою часткою кислоти 3,65%?
- •1. Встановіть відповідність між поняттям та його визначенням:
- •2. Перед вами схеми приладів для дослідження речовин на електропровідність. Чому в першому і другому випадках електрична лампочка не горить?
- •3. Серед запропонованих формул виберіть формули сильних та слабких електролітів та запишіть їх у відповідні колонки таблиці - NaCl; h2s; h2so4; CuSo4; h2co3; koh; h2so3:
- •2. Напишіть рівняння дисоціації наступних речовин (користуйтесь таблицею
- •1. Назвіть умови, за яких реакції йонного обміну відбуваються до кінця:
- •2. В молекулярному, повному та скороченому йонному рівнянні взаємодії розчинів ферум(ііі) хлориду та арґентум нітрату заповніть пропуски:
- •3. Складіть молекулярні, повні та скорочені йонні рівняння:
- •4.Складіть молекулярне та повне йонне рівняння за скороченим йонним
- •2. Серед запропонованих речовин виберіть назви електролітів та неелектролітів - спирт, розчин калій гідроксиду, магній оксид, сульфатна кислота; розчин купрум(іі) сульфату:
- •3. Правильне записане молекулярне, повне та скорочене йонне рівняння взаємодії натрій карбонату та сульфатної кислоти у випадку:
- •4. Запишіть молекулярне, повне та скорочене йонне рівняння взаємодії між розчинами:
- •5. За скороченним йонним рівнянням складіть молекулярне та повне йонне рівняння:
- •2. Розчинення – це:
- •3. Електроліти відрізняються від неелектролітів тим, що ___________________________
- •4. Запишіть молекулярне, повне та скорочене йонне рівняння взаємодії між розчинами
- •5. За скороченним йонним рівнянням складіть молекулярне та повне йонне рівняння:
- •6. Яка маса солі утвориться при взаємодії розчину барій гідроксиду із сульфатною кислотою масою 200 г з масовою часткою кислоти 9,8 %?
- •7. З розчину натрій хлориду масою 500 г з масовою часткою солі 20% випарили 300 г води. Визначить масову частку солі в новоутвореному розчині.
- •1. Встановіть відповідність між типом реакції та її визначенням:
- •2. Встановіть відповідність між рівнянням хімічної реакції та її типом:
- •3. Закінчить рівняння хімічної реакцій, вкажіть їх тип:
- •4. Вправа на повторення:
- •Послідовність дій при складанні електронного балансу в окисно- відновних реакціях:
- •1. Вкажіть кількість відданих або приєднаних електронів в наступних рівняннях напівреакції:
- •3. Складіть електронний баланс, вкажіть окисника і відновника, процеси окиснення і відновлення, розставте коефіцієнти в рівняннях окисно – відновних реакцій:
- •1. Запишіть формулу, якою визначається швидкість хімічних реакцій:
- •2. В якій з колб реакція відбувається швидше? Вкажіть чинник, який впливає в даному випадку на різну швидкість. Відповідь обґрунтуйте.
- •3. В якій з колб реакція відбувається швидше? Вкажіть чинник, який впливає в даному випадку на різну швидкість. Відповідь обґрунтуйте.
- •4. В якій з колб реакція відбувається швидше? Вкажіть чинник, який впливає в даному випадку на різну швидкість. Відповідь обґрунтуйте.
- •5. У дві пробірки налили хлоридну кислоту однакової концентрації. У першу занурили залізну пластинку масою 1г, а в другу насипали 1г залізних ощурок. Реакція закінчується:
- •6. Каталізатор – це речовина, яка:
- •1. Встановіть відповідність між типом реакції та його визначенням:
- •2. Виберіть окисно – відновну реакцію, встановіть процеси окиснення і відновлення, окисника і відновника:
- •4. Встановіть відповідність між рівнянням хімічної реакції та його типом:
- •5. Хлоридна кислота масою 400 г з масовою часткою кислоти 7,3 % прореагувала з кальцій гідроксидом. Обчисліть масу солі, яка утворилась внаслідок реакції.
- •1. Заповніть порівняльну таблицю спільних та відмінних ознак органічних і неорганічних сполук:
- •2. Складіть графічні та електронні формули атому Карбону в стані спокою та збудженому стані.
- •3. Перерахуйте 3 ознаки, які обумовили присутність атому Карбону в усіх органічних сполуках.
- •1. Встановіть відповідність між формулою метану та її зображенням:
- •7. Запишіть структурні формули алканів, що містять в своєму складі 3, 5, 7 атомів Карбону.
- •1.Встановіть відповідність між загальною формулою вуглеводнів та
- •2. Встановіть відповідність між гомологічним рядом та суфіксом в назвах речовин за міжнародною номенклатурою:
- •5. Підпишіть назви моделей молекул етилену та ацетилену:
- •6. Заповніть пропуски в наступних реченнях:
- •7. Складіть молекулярні формули наступних вуглеводнів:
- •1. Встановіть відповідність між вуглеводнями та галузями їх застосування.
- •3. За структурними формулами дайте назви наступним вуглеводням:
- •4. Серед запропонованих формул виберіть формули насичених вуглеводнів – алканів, ненасичених - алкенів та алкінів : с4н10; с3н6; с2н2; с5н12; с3н4; с5н10
- •5. Встановіть відповідність між вихідними речовинами та продуктами реакції:
- •6. Запишіть структурні формули таких вуглеводнів:
- •7. Виведіть формулу речовини, яка містить 75% Карбону, 25% Гідрогену. Відносна густина цієї речовини за киснем 0,5.
- •1. Який об’єм кисню необхідний для спалювання 40 л етану? Скільки при цьому утвориться літрів вуглекислого газу?
- •2. При спалюванні пропану утворилось 90 л
- •3. Чи достатньо 400 л кисню для спалювання 65 л бутану?
- •4. На спалювання 25 л метан – етанової суміші витрачено 65 л кисню (н.У.). Визначте об’єм метану в суміші.
- •1. Дайте назву поняттям:
- •2. Назвіть властивості , які характерні для поліетилену.
- •Поліетилену
- •3. Заповни схему:
- •4 . Який об’єм повітря необхідний для спалювання 40 л етану? Об’ємна частка кисню в повітрі становить 21%.
- •6. За структурними формулами дайте назви наступним вуглеводням:
- •7*. За назвою складіть структурні формули наступних вуглеводнів:
- •8. Закінчити рівняння хімічних реакцій:
- •9. Який об’єм повітря необхідний для спалювання 30 л пропену? Об’ємна частка кисню в повітрі 21%.
- •2. Запишіть електронні формули для метанолу та етанолу.
- •3. Функціональна група- це_______________________________________________
- •5. Аномальні фізичні властивості спиртів обумовлені _____________________________
- •7. Вкажіть суфікс в назвах спиртів:
- •8. Складіть формулу спирту, що містить 3 атому Карбону. Скільки молекул містить 2 моль цього спирту?
- •2. Запишіть рівняння горіння метанолу. Вкажіть суму коефіцієнтів в ньому.
- •3. Встановіть відповідність між вихідними речовинами та продуктами реакцій:
- •5. Який об’єм водню виділиться при взаємодії розчину етанолу масою 100 г з масовою часткою спирту 96% з натрієм?
- •6. Складіть електронний баланс, вкажіть окисника і відновника в рівнянні горіння метану.
- •1. Запишіть молекулярну, електронну та структурну формули гліцерину.
- •2. Встановіть відповідність між структурними формулами речовин та їх назвами:
- •3. Встановіть відповідність між спиртом та його фізичними властивостями:
- •4. Запишіть рівняння взаємодії гліцерину з натрієм.
- •1. Яка властивість нехарактерна для спиртів:
- •2. Формула спирту, який містить 5 атомів Карбону:
- •7. Закінчить рівняння реакції:
- •8. Напишіть структурні формули таких спиртів:
- •9. Який об’єм водню виділиться при взаємодії 6,4 г метанолу з натрієм?
- •7. Вкажіть суфікс в назвах карбонових кислот:
- •8. Складіть структурні формули таких карбонових кислот:
- •9. Складіть формулу карбонової кислоти, що містить 4 атому Карбону. Яка маса 0,5 моль цієї кислоти?
- •6. Реакція етерифікації – це______________________________________________________________
- •7. Встановіть відповідність між вихідними речовинами та продуктами реакціїй:
- •8. Яка маса солі утвориться при взаємодії оцтової кислоти масою 100 г з масовою часткою кислоти 9 % з розчином натрій гідроксиду?
- •3. Допишіть схему утворення жиру трипальмітину:
- •4. Запишіть рівняння реакції омилення жиру, внаслідок якої утворюється рідке мило.
- •5. Запишіть формулу триолеїну та розрахуйте його відносну молекулярну масу:
- •6 . Який об’єм кисню необхідний для спалювання 20 л метану та 30 л пропану?
- •1. Заповніть пропуски в схемі:
- •4. Визначте об’єм вуглекислого газу, що виділиться внаслідок спиртового бродіння 360 г глюкози.
- •5. Визначте об’єм вуглекислого газу, що утвориться внаслідок повного окиснення глюкози масою 240 г.
- •6. Яку масу етанолу можна добути при спиртовому бродінні із глюкози масою 540 г ?
- •3. Запишіть рівняння гідролізу сахарози:
- •5. Встановіть послідовність стадій добування цукру із цукрового буряку:
- •6. Змішали розчин сахарози масою 200 г з масовою часткою сахарози 30% з розчином сахарози масою 200 г з масовою часткою сахарози 50%. Визначить масову частку сахарози в новоутвореному розчині.
- •7. З розчину сахарози масою 400 г з масовою часткою сахарози 25% випарили 50 г води. Визначить масову частку сахарози в новоутвореному розчині.
- •1. Заповніть порівняльну таблицю про будову крохмалю та целюлози:
- •3. Запишіть рівняння гідролізу крохмалю та целюлози:
- •4. За фізичними властивостями:
- •6. Встановіть відповідність між вуглеводами та галузями їх застосування:
- •Рівняння для розв’язку задачі:
- •1. Запишіть молекулярну, структурну та електронну формули амінооцтової кислоти:
- •3 . Підпишіть назви функціональних груп, вкажіть , які властивості обумовлює кожна група, які властивості мають амінокислоти:
- •4. Доведіть амфотерність:
- •5. Закінчити рівняння хімічних реакцій:
- •1. Порівняйте склад дезоксирибонуклеїнової кислоти (днк) та рибонуклеїнової кислот.
- •2. Нуклеозид – це _______________________________________________________;
- •Принцип компліментарності для днк:
- •Аденін – тимін (а – т);
- •Тимін – аденін (т – а);
- •Гуанін – цитозін (г – ц);
- •Цитозін - гуанін (ц – г)
- •4. Встановіть відповідність між природними полімерами та їхнім біологічним значенням:
- •5. Встановіть відповідність між органічними речовинами та якісними реакціями на них:
- •6. Встановіть відповідність між полімерами та низькомолекулярними речовинами - мономерами, з яких побудовано їхні молекули:
- •2. Укажіть чинник, який не впливає на зміщення хімічної рівноваги:
- •3. Вкажіть визначення відновника:
- •6. Виберіть пари реагентів, які відповідають скороченому йонному рівнянню
- •7. Виберіть рівняння реакції, для якої зменшення тиску зміщує рівновагу в бік
- •8. Яка з реакцій в розчині відбувається з виділенням газу:
- •10. Визначте об’єм води, до якої потрібно добавити хлоридну кислоту з масовою часткою хлороводню,0,32, щоб приготувати 700 г розчину з масовою часткою хлороводню 20%.
4. Який об,єм водню виділиться при взаємодії цинку з хлоридною кислотою масою 20 г з масовою часткою кислоти 3,65%?
У рок № 8 Електролітична дисоціація. Електроліти і неелектроліти. Ступінь дисоціації. Сильні та слабкі електроліти.
1. Встановіть відповідність між поняттям та його визначенням:
а) електроліти; 1. Фізична величина, яка показує відношення
б) неелектроліти; продисоційованих молекул до загального числа
|
1 |
2 |
3 |
4 |
А |
|
|
|
|
Б |
|
|
|
|
В |
|
|
|
|
Г |
|
|
|
|
г) електролітична дисоціація; 2. Процес розпаду електроліту на йони;
3. Речовини,водні розчини яких розпадаються
на йони і тому речовини проводять електричний
струм;
4. Речовини,водні розчини яких розпадаються на
йони і тому речовини проводять електричний
струм.
2. Перед вами схеми приладів для дослідження речовин на електропровідність. Чому в першому і другому випадках електрична лампочка не горить?


 _____________________________
_____________________________
1
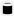
 _____________________________
_____________________________
_____________________________
дистильована вода
 ____________________________
____________________________
2
____________________________
____________________________
кристалічний натрій хлорид

 _____________________________
_____________________________
3
_____________________________
_____________________________
водний розчин натрій хлориду
3. Серед запропонованих формул виберіть формули сильних та слабких електролітів та запишіть їх у відповідні колонки таблиці - NaCl; h2s; h2so4; CuSo4; h2co3; koh; h2so3:
Cильні електроліти |
Слабкі електроліти |
|
|
|
|
|
|
|
|
У рок № 9 Електролітична дисоціація кислот, основ, солей у водних розчинах.
|
1 |
2 |
3 |
4 |
А |
|
|
|
|
Б |
|
|
|
|
В |
|
|
|
|
Г |
|
|
|
|
а) кислоти; 1. неелектроліти;
б) оксиди; 2. електроліти, водні розчини яких
в) солі; утворюють при дисоціації йони ОН-;
г) основи; 3. електроліти, водні розчини яких
Дисоціюють лише розчинні
сполуки
утворюють при дисоціації йони Н+;4. електроліти, водні розчини яких утворюють при
дисоціації катіони металу та аніони кислотних залишків.
