
- •Введение
- •1. Химия белков
- •Функции белков
- •1.2. Строение белков
- •1.2.1. Аминокислотный состав белков
- •1.2.2. Уровни структурной организации белков
- •1.3. Физико-химические свойства белков
- •1.4. Выделение, фракционирование и очистка белков
- •1.4.1. Выделение белков
- •1.4.2. Фракционирование и очистка белков
- •1.5. Классификация белков
- •1.5.1. Классификация простых белков
- •1.5.2. Классификация сложных белков
- •Вопросы для самоконтроля
- •2. Химия нуклеиновых кислот
- •Химический состав нуклеиновых кислот
- •Нуклеиновые кислоты – это высокомолекулярные биополимеры, построенные из множества мононуклеотидов.
- •2.2. Структура нуклеиновых кислот
- •2.3. Биологическая роль днк и рнк
- •Вопросы для самоконтроля
- •3.Витамины
- •3.1. Биологическая роль витаминов
- •3.2. Классификация и характеристика витаминов
- •4.2. Строение и механизм действия ферментов
- •4.3. Свойства ферментов
- •4.3.1. Специфичность
- •Термолабильность
- •4.3.3. Зависимость активности фермента от рН
- •4.3.4. Активирование и ингибирование ферментов
- •4. 4. Кинетика ферментативной реакции
- •4.4.1. Активность ферментов
- •1 Катал:
- •4.4.2. Влияние концентрации фермента и субстрата на скорость ферментативной реакции
- •Вопросы для самоконтроля
- •5. Биологическое окисление
- •Сущность биологического окисления
- •5.2. Тканевое дыхание
- •Флавин-аденин-динуклеотид (фад)
- •5.3. Энергетика дыхательной цепи
- •Образование углекислого газа при окислении
- •Вопросы для самоконтроля
- •Углеводы и их обмен
- •Биологическая роль и классификация углеводов
- •6.2. Обмен углеводов
- •6.2.1. Переваривание углеводов
- •6.2.2. Синтез и распад гликогена в печени
- •6.2.3. Анаэробный распад углеводов
- •6.2.4. Аэробный распад углеводов
- •Энергетика полного окисления 1 молекулы глюкозы анаэробным и аэробным путем до углекислого газа и воды
- •6.2.5. Сбраживание углеводов микроорганизмами
- •Вопросы для самоконтроля
- •7. Липиды и их обмен
- •7.1. Биологическая роль и классификация липидов
- •Сфингомиелин
- •Цереброзид:
- •Ганглиозид:
- •7.2. Обмен триглицеридов
- •7.2.1. Переваривание триглицеридов
- •7.2.2. Окисление триглицеридов
- •7.2.3. Синтез триглицеридов
- •7.3. Обмен фосфолипидов
- •7.3.1. Переваривание фосфолипидов
- •7.3.2. Биосинтез фосфолипидов в тканях
- •7.4. Обмен стеринов
- •7.4.1. Переваривание холестеридов
- •7.4.2. Превращения холестерина в тканях
- •Вопросы для самоконтроля
- •8. Обмен белков
- •8.1. Обмен простых белков
- •8.1.1. Переваривание белков
- •8.1.2. Распад белков в тканях
- •8.1.3. Превращения аминокислот в тканях
- •8.1.4. Обезвреживание аммиака в тканях
- •8.1.5. Синтез белков в тканях
- •8.2. Обмен нуклеопротидов
- •8.2.1. Переваривание нуклеопротеидов
- •8.2.2. Биосинтез нуклеиновых кислот
- •8.2.3. Распад нуклеиновых кислот в тканях
- •Вопросы для самоконтроля
- •9. Обмен воды и минеральных веществ
- •9.1. Обмен воды
- •9.1.1. Содержание воды и функции воды в организме
- •9.1.2. Функции воды
- •9.1.3. Обмен воды
- •Регуляция водного обмена
- •9.2. Биологическая роль минеральных веществ
- •9.2.1. Характеристика макроэлементов
- •9.2.2. Характеристика микроэлементов
- •Вопросы для самоконтроля
- •Гормоны
- •Биологическая роль гормонов
- •Классификация гормонов
- •Механизм действия гормонов
- •Характеристика гормонов
- •10.4.1. Гормоны гипоталамуса
- •10.4.2. Гормоны гипофиза
- •10.4.3. Гормоны щитовидной железы
- •Тироксин
- •10.4.4. Гормоны паращитовидной железы
- •10.4.5. Гормоны тимуса
- •10.4.6. Гормоны поджелудочной железы
- •10.4.7. Гормоны надпочечников
- •Адреналин Ноадреналин
- •10.4.8. Половые гормоны
- •Вопросы для самоконтроля
- •Итоговый контрольный тест
- •Тест 6
- •Глоссарий
- •Список литературы
1.3. Физико-химические свойства белков
Молекулярная масса
Молекулярная масса белков колеблется в больших пределах – от нескольких тысяч до миллионов дальтон (табл.3).
Таблица 3
-
Белок
Молекулярная масса,
Да
Инсулин
Миоглобин
Пепсин
Яичный альбумин
Гемоглобин эритроцитов крови
Альбумин крови
Миозин
Белок вируса табачной мозаики
5 800
17 000
36 000
46 000
68 000
176 000
850 000
40 000 000
Кристаллизация
Белки кристаллизуются из своих растворов в виде кристаллов разной формы: игл, ромбов и др.
Коллоидное состояние
Белки присутствуют в растворах в виде больших частиц диаметром 0,1-0,001 μ, что придает коллоидный характер растворам, т.е. способность рассеивать свет; неспособность проникать через полупроницаемые мембраны, иметь большую вязкость. Коллоидные свойства лежат в основе очистки и разделения белков методом диализа.
Оптические свойства
Все белки поглощают ультрафиолетовое излучение; белковые растворы способны преломлять свет. Оптические свойства лежат в основе методов количественного определения белков.
Растворимость
К
Растворимость белка в воде связана с гидратацией, т.е. образованием вокруг белковой молекулы водного слоя (гидратной оболочки), препятствующей слипанию молекул белка. Растворимость можно уменьшать, добавляя нейтральные соли, денатурируя белки и изменяя рН среды.
аждый белок обладает определенной растворимостью, зависящей от его природы, т.е. наличия гидрофильных: ОН-, SH-, NH2-, COOH- и гидрофобных групп : CH3-CH2-, C6H5- и растворителя.
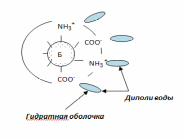
Высаливание
Осаждение белков из водных растворов под действием нейтральных солей называется высаливанием. Высокие концентрации нейтральных солей: хлорида натрия, сульфата натрия, сульфата магния, сульфата аммония и др. приводит к оттягиванию диполей воды этими солями. Белковые частицы обезвоживаются и в результе белок выпадает в осадок (рис. 6).
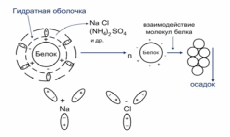
Рис. 6. Высаливание белков
Водорастворимые белки альбумины высаливаются при 100% от насыщения сульфатом аммония, а солерастворимые белки глобулины – при 50% от насыщения сульфатом аммония, т.к. глобулины окружены сольватной оболочкой, состоящей из диполей воды и ионов солей.
Высаливание является обратимым процессом, т.е. добавление воды к осадку белка вновь приведет к его растворению. Поэтому высаливание применяется для выделения белков в нативном виде из растворов.
Денатурация
Денатурация – это разрушение всех структур белка, кроме первичной. Денатурация проявляется в изменении формы белка, потере растворимости, коагуляции (свертывании), увеличении реактивности высвобождаемых функциональных групп, потере биологической активности (рис.7).

Рис. 7. Денатурация белка
Ф
Рис. 5. Денатурация белка
акторы, вызывающие денатурацию: физические: температура свыше 50 о С, ультразвук, инфракрасное излучение, ультрафиолетовые лучи, γ-лучи, рентгеновские лучи и химические – действие тяжелых металлов, органических растворителей: спирта, ацетона (при низких температурах), сильных неорганических и органических кислот, щелочей, солей тяжелых металлов.
Денатурация – необратимый процесс, т.к. при разворачивании полипептидной цепи высвобождаются гидрофобные группы, отталкивающие диполи воды, в результате чего белок становится нерастворим в воде.
Изоэлектрическое состояние
Белки в растворе являются амфолитами, т.е. они могут обладать свойствами кислот и оснований в результате диссоциации карбоксильных и аминогрупп аминокислотных остатков:
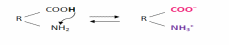
Величина заряда белка зависит от аминокислотного состава. Если в белке преобладают кислые аминокислоты, то суммарный заряд белка будет отрицательным, и в электрическом поле такой белок движется к аноду. Если в белке больше основных аминокислот, то суммарный заряд белка - положительный и такой белок в электрическом поле движется к катоду.
Но можно установить такой рН, при котором подавляются лишние заряженные группы и количество положительных и отрицательно заряженных групп становится равным. В таком случае белок будет неподвижен в электрическом поле, т.е. суммарный заряд его будет равен нулю. Такое состояние белка называется изоэлектрическим, а рН, при котором наступает изоэлектрическое состояние, называется изоэлектрической точкой и обозначается рI.
В кислой среде подавляется диссоциация лишних СОО− -групп белка-аниона, а в щелочной – диссоциация лишних NH3+-групп белка-катиона:
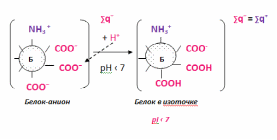
рI – характерный показатель аминокислотного состава белка: для кислых белков pH‹7, а для основных рI ›7. Например, у фермента пепсина желудочного сока (а все ферменты – белки) рI 1,5, у казеина молока - 4,7, у гемоглобина крови - 6,8.
В изоэлектрической точке белки обратимо осаждаются в результате кулоновских сил взаимодействия положительно и отрицательно заряженных групп белковых молекул. Однако дальнейшее изменение рН раствора приведет к перезарядке белка и вновь к его растворению. Изоэлектрическое осаждение используется для выделения и очистки белков.
