
- •Учебно-методический комплекс
- •240700 Биотехнология
- •Содержание
- •1. Рабочая программа
- •240700 Биотехнология
- •2. Место дисциплины в структуре ооп впо
- •3. Компетенции обучающегося, формируемые в результате освоения дисциплины
- •4. Структкра и содержание дисциплины
- •Образовательные технологии.
- •Оценочные средства.
- •Учебно-методическое и информационное обеспечение дисциплины (модуля).
- •8. Материально-техническое обеспечение дисциплины (модуля)
- •Тематический план лекций, лабораторных занятий и самостоятельной работы
- •Физическая химия
- •240700 Биотехнология
- •Форма контроля: опрос, задачи, тестирование, экзамен
- •3. Курс лекций
- •Ф изическая химия
- •Процесс самопроизвольного перехода (диффузии) растворителя через проницаемую перегородку из той части системы, где концентрация растворенного вещества ниже, в другую, где она выше, называется осмосом.
- •Законы Рауля и следствия из них
- •Повышение температуры кипения и понижение температуры кристаллизации раствора. Эбуллиоскопия и криоскопия.
- •Электролиз
- •Примеры написания уравнений реакций электролиза.
- •Энергия изолированной системы постоянна.
- •Вечный двигатель первого рода невозможен.
- •Энергия не исчезает бесследно и не возникает из ничего, а лишь эквивалентно переходит из одного вида в другой.
- •Влияние концентрации реагирующих веществ на скорость реакции.
- •Влияние температуры на скорость реакции.
- •Кинетическая классификация химических процессов.
- •Катализ. Ферментативный катализ.
- •Смещение химического равновесия.
- •4. Методические указания по выполнению лабораторных работ
- •Методическое руководство к лабораторным занятиям по физической и коллоидной химии
- •Введение
- •1. Рекомендации по выполнению и оформлению лабораторных работ
- •2. Правила построения графиков
- •Лабораторный практикум Контрольные вопросы по теме: «Термодинамика».
- •Лабораторная работа № 1 Тема: «Определение тепловых эффектов химических процессов»
- •Теоретическая часть
- •Экспериментальная часть
- •Лабораторная работа № 2 Тема: «Определение теплоты нейтрализации»
- •Теоретическая часть
- •Экспериментальная часть
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Контрольные вопросы по теме: «Коллигативные свойства растворов».
- •Лабораторная работа № 3 Тема: Определение молекулярной массы неэлектролита криоскопическим методом.
- •Теоретическая часть
- •Экспериментальная часть
- •Приготовление раствора неэлектролита (один на группу).
- •2. Определение температуры замерзания растворителя
- •3. Определение температуры замерзания раствора
- •4. Определение относительной ошибки измерения.
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Лабораторная работа № 4 Тема: «Определение степени диссоциации растворенного вещества и осмотического давления раствора криоскопическим методом»
- •Теоретическая часть
- •Экспериментальная часть
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Экспериментальная часть Опыт 1. Приготовление буферных растворов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Теоретическая часть
- •Экспериментальная часть
- •1. Приближенное определение рН с помощью универсального индикатора.
- •2. Точное определение рН
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Контрольные вопросы по теме: «Электрохимические процессы».
- •Лабораторная работа № 7
- •Теоретическая часть
- •Экспериментальная часть
- •3. Работа с универсальным иономером эв – 74
- •Примеры решения задач
- •0,01 Моль 0,1 моль
- •Задачи для самостоятельного решения
- •Контрольные вопросы по теме: «Кинетика».
- •Лабораторная работа № 8 Тема: Кинетика каталитического разложения пероксида водорода (гетерогенный катализ).
- •Теоретическая часть
- •Экспериментальная часть
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Экспериментальная часть.
- •Примеры решения задач.
- •Задачи для самостоятельного решения
- •Контрольные вопросы по теме: «Скорость химических реакций».
- •Экспериментальная часть
- •Задачи для самостоятельного решения
- •Экспериментальная часть.
- •Контрольные вопросы по теме: «Адсорбция»
- •Лабораторная работа № 12 Тема: Адсорбция уксусной кислоты почвой
- •Теоретическая часть
- •Экспериментальная часть
- •Примеры решения задач
- •Задачи для самостоятельного решения.
- •Экспериментальная часть.
- •Контрольные вопросы по теме: «Коллоидные растворы».
- •Лабораторная работа № 14 Тема: Получение коллоидных растворов
- •Теоретическая часть
- •Способы получения коллоидных растворов.
- •Структура коллоидных систем.
- •I слой iIслой
- •Экспериментальная часть Разновидности конденсационного метода получения золей.
- •1. Смена растворителя. Получение гидрозоля серы или канифоли
- •2. Реакция гидролиза. Получение золя гидроксида железа (III).
- •3. Реакция двойного обмена. Получение золя иодида серебра.
- •4. Получение золя мыла
- •5. Взаимодействие положительно и отрицательно заряженных золей
- •Примеры решения задач
- •Задачи для самостоятельного решения.
- •Контрольные вопросы по теме: «Свойства дисперсных систем».
- •Лабораторная работа №15 Тема: Коагуляция золей. Свойства растворов высокомолекулярных соединений
- •Теоретическая часть.
- •Свойства коллоидных систем
- •Экспериментальная часть
- •2. Определение защитного числа желатины
- •3. Определение изоэлектрической точки желатина
- •4. Пептизация осадков белков
- •5. Определение знака заряда коллоидных частиц методом капиллярного анализа.
- •Примеры решения задач
- •Задачи для самостоятельного решения.
- •Контрольные вопросы по теме: «Свойства растворов вмс».
- •Лабораторная работа № 16 Тема: Экспериментальное изучение коллоидных свойств высокомолекулярных соединений
- •Теоретическая часть.
- •Экспериментальная часть
- •1. Определение изоэлектрической точки белка
- •2. Изучение кинетики набухания зерна
- •Условный объем набухающего зерна
- •3. Влияние электролитов на набухание желатина
- •4. Влияние электролитов на желатинирование.
- •Задачи для самостоятельного решения.
- •Контрольные вопросы по теме: «Получение микрогетерогенных систем».
- •Лабораторная работа № 17 Тема: Грубодисперсные (микрогетерогенные) системы. Получение эмульсии, суспензий и пен.
- •Теоретическая часть.
- •Литература
- •Список терминов.
- •Приложения
- •Правила пользования таблицами десятичных логарифмов.
- •Вопросы для подготовки
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тема: Коллигативные свойства растворов. Теоретическая часть
- •Вопросы для подготовки и контроля знаний
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тема: Буферные растворы. Теоретическая часть
- •Вопросы для подготовки и контроля знаний
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тема: Электрохимия. Электропроводимость растворов электролитов. Теоретическая часть
- •Водородный электрод
- •Каломельный электрод
- •Хингидронный электрод
- •Вопросы для подготовки и контроля знаний
- •Примеры решения задач
- •0,01 Моль 0,1 моль
- •Задачи для самостоятельного решения
- •Тема: Химическая кинетика. Скорость химической реакции. Теоретическая часть
- •Вопросы и задачи для самостоятельной подготовки и контроля знаний
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тема: Адсорбция на поверхности растворов. Уравнение Фрейндлиха и Ленгмюра. Адсорбционные явления в почвах, растениях и организмах. Теоретическая часть
- •Вопросы для подготовки и контроля знаний
- •Примеры решения задач
- •Задачи для самостоятельного решения.
- •Тема: Коллоидные растворы.
- •Способы получения коллоидных растворов.
- •Структура коллоидных систем.
- •I слой iIслой
- •Свойства коллоидных систем
- •Вопросы для подготовки и контроля знаний
- •Примеры решения задач
- •Задачи для самостоятельного решения.
- •Тема: Растворы высокомолекулярных соединений. Теоретическая часть.
- •Вопросы для самостоятельной подготовки и контроля знаний
- •Задачи для самостоятельного решения.
- •Тема: Микрогетерогенные системы.
- •Вопросы и задачи для самостоятельной подготовки и контроля знаний
- •Список терминов.
- •6. Методические указания по выполнению контрольных работ студентами заочной формы обучения Варианты заданий для контрольных работ
- •Тестовые задания для итогового контроля знаний.
Задачи для самостоятельного решения
1. При увеличении температуры от 20 до 50°С скорость реакции увеличилась в 27 раз. Определите ее температурный коэффициент.
2. Вычислить температурный коэффициент скорости некоторых реакций, если при повышении температуры: а) от 10 до 50°С скорость реакции увеличилась в 16 раз; б) от 50 до 100°С скорость реакции увеличилась в 1200 раз.
Ответ: а) 2; б) 4,13.
3. Температурный коэффициент скорости некоторой реакции равен 1,5ю Во сколько раз увеличится скорость данной реакции при повышении температуры на 30°С?
Ответ: в 3,4 раза.
4. При увеличении температуры на 10°С скорость некоторой реакции увеличилась в 2 раза. Во сколько раз увеличится скорость этой же реакции при повышении температуры на 50 и на 20°С?
Ответ: в 32 и в 4 раза.
5. Составьте выражение для константы равновесия для уравнения:
2NО2(г) → О2(г)+ 2NО (г)
и вычислите ее значение. Если равновесные концентрации [NО2]= 0,06 моль/л; [О2]= 0,12 моль/л и [NО]= 0,24 моль/л.
Контрольные вопросы по теме: «Экстракция».
В чем сущность закона распределения?
Дайте термодинамический вывод закона распределения.
Применение закона распределения.
Лабораторная работа № 11
Тема: Определение коэффициента распределения
Цель работы: познакомиться с явлением экстракции на примере двух не смешивающих жидкостей.
Оборудование и реактивы: Делительные воронки или колбы с притертыми пробками, бюретки, цилиндры на 25 мл, пипетки на 2 мл, колбы и стаканы для титрования, индикатор фенолфталеин, 1н раствор уксусной кислоты, 0,1н раствор гидроксида натрия, бензол, толуол, ксилол.
Теоретическая часть
Две жидкости нерастворимые одна в другой, при смешивании образуют два слоя. Если к такой смеси прибавить небольшое количество вещества, растворимого в обеих жидкостях, то оно самопроизвольно распределится между двумя слоями в определенном отношении.
Изучение распределения вещества между двумя несмешивающимися растворителями позволяет найти необходимые данные для разделения различных веществ, выяснить наличие диссоциации или ассоциации растворенного вещества, получить ряд других сведений о поведении растворенного вещества.
Рассмотрение соотношения между равновесными концентрациями в каждой из жидкостей позволяет сформулировать закон распределения: отношение активностей распределяемого вещества в двух несмешивающихся растворителях при постоянной температуре есть величина постоянная, называемая коэффициентом распределения:
![]()
Коэффициент распределения не зависит от общей концентрации растворенного вещества в обоих растворителях, от абсолютного и относительного количества каждого из растворителей и приближенно равен отношению растворимости данного вещества в каждом из растворителей.
Коэффициент распределения зависит от температуры, природы распределяемого вещества и растворителей.
Если концентрации распределяемого вещества невелики, то вместо активностей можно использовать концентрации:
![]()
Если распределяющееся вещество ассоциировано, то применяется формула:
![]()
где
![]() (М1
и М2
– средние молекулярные массы в первом
и втором растворителях).
(М1
и М2
– средние молекулярные массы в первом
и втором растворителях).
Когда распределяющееся вещество диссоциирует, применяется формула:
![]()
где α1 и α2- степени диссоциации вещества в соответствующих растворителях.
Добавление вещества к двум частично смешивающимся растворителям может повлиять на их взаимную растворимость. Например, если к двухслойной системе фенол-вода добавить нафталин, который в воде не растворяется, то растворимость фенола в воде уменьшается. Прибавка соли, не растворимой в феноле, уменьшает растворимость воды в феноле.
В некоторых случаях добавление соли вызывает расслаивание двух полностью смешивающихся жидкостей. Например, добавка карбоната калия расслаивает смесь этилового спирта и воды, а хлорид калия расслаивает смесь пропилового спирта и воды.
Закон распределения используется в практике извлечения (экстрагирования) растворенного вещества из раствора с помощью другого растворителя и позволяет находить наиболее выгодные условия экстрагирования. Зная величину коэффициента распределения, можно производить расчеты количества извлекаемого вещества. Чем больше коэффициент распределения, тем больше процент извлечения и эффективнее процесс экстракции.
Количество вещества, оставшееся в растворе после экстрагирования, рассчитывают по формуле:
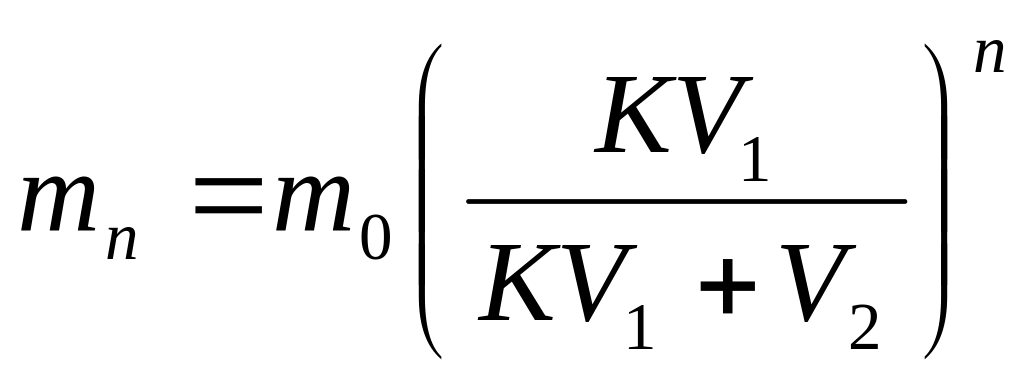
где m0 – начальное количество экстрагируемого вещества,
V1 – объем растворителя, в котором находится вещество,
V2 – объем растворителя, при помощи которого производится экстрагирование,
n – общее число экстрагирований,
m1, m2, … mn – количество вещества, остающегося в первоначальном растворе после 1, 2, 3, …, n экстрагирований,
К – коэффициент распределения.
Путем последовательного многократного извлечения некоторым количеством растворителя, поделенном на части (малыми порциями), извлечение вещества осуществляется более полно, чем всем количеством растворителя сразу.
Условно принято считать, что коэффициентом распределения обозначают отношение концентрации раствора, из которого экстрагируется распределенное вещество, к концентрации раствора, которым производится экстрагирование.
