
- •Учебно-методический комплекс
- •240700 Биотехнология
- •Содержание
- •1. Рабочая программа
- •240700 Биотехнология
- •2. Место дисциплины в структуре ооп впо
- •3. Компетенции обучающегося, формируемые в результате освоения дисциплины
- •4. Структкра и содержание дисциплины
- •Образовательные технологии.
- •Оценочные средства.
- •Учебно-методическое и информационное обеспечение дисциплины (модуля).
- •8. Материально-техническое обеспечение дисциплины (модуля)
- •Тематический план лекций, лабораторных занятий и самостоятельной работы
- •Физическая химия
- •240700 Биотехнология
- •Форма контроля: опрос, задачи, тестирование, экзамен
- •3. Курс лекций
- •Ф изическая химия
- •Процесс самопроизвольного перехода (диффузии) растворителя через проницаемую перегородку из той части системы, где концентрация растворенного вещества ниже, в другую, где она выше, называется осмосом.
- •Законы Рауля и следствия из них
- •Повышение температуры кипения и понижение температуры кристаллизации раствора. Эбуллиоскопия и криоскопия.
- •Электролиз
- •Примеры написания уравнений реакций электролиза.
- •Энергия изолированной системы постоянна.
- •Вечный двигатель первого рода невозможен.
- •Энергия не исчезает бесследно и не возникает из ничего, а лишь эквивалентно переходит из одного вида в другой.
- •Влияние концентрации реагирующих веществ на скорость реакции.
- •Влияние температуры на скорость реакции.
- •Кинетическая классификация химических процессов.
- •Катализ. Ферментативный катализ.
- •Смещение химического равновесия.
- •4. Методические указания по выполнению лабораторных работ
- •Методическое руководство к лабораторным занятиям по физической и коллоидной химии
- •Введение
- •1. Рекомендации по выполнению и оформлению лабораторных работ
- •2. Правила построения графиков
- •Лабораторный практикум Контрольные вопросы по теме: «Термодинамика».
- •Лабораторная работа № 1 Тема: «Определение тепловых эффектов химических процессов»
- •Теоретическая часть
- •Экспериментальная часть
- •Лабораторная работа № 2 Тема: «Определение теплоты нейтрализации»
- •Теоретическая часть
- •Экспериментальная часть
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Контрольные вопросы по теме: «Коллигативные свойства растворов».
- •Лабораторная работа № 3 Тема: Определение молекулярной массы неэлектролита криоскопическим методом.
- •Теоретическая часть
- •Экспериментальная часть
- •Приготовление раствора неэлектролита (один на группу).
- •2. Определение температуры замерзания растворителя
- •3. Определение температуры замерзания раствора
- •4. Определение относительной ошибки измерения.
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Лабораторная работа № 4 Тема: «Определение степени диссоциации растворенного вещества и осмотического давления раствора криоскопическим методом»
- •Теоретическая часть
- •Экспериментальная часть
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Экспериментальная часть Опыт 1. Приготовление буферных растворов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Теоретическая часть
- •Экспериментальная часть
- •1. Приближенное определение рН с помощью универсального индикатора.
- •2. Точное определение рН
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Контрольные вопросы по теме: «Электрохимические процессы».
- •Лабораторная работа № 7
- •Теоретическая часть
- •Экспериментальная часть
- •3. Работа с универсальным иономером эв – 74
- •Примеры решения задач
- •0,01 Моль 0,1 моль
- •Задачи для самостоятельного решения
- •Контрольные вопросы по теме: «Кинетика».
- •Лабораторная работа № 8 Тема: Кинетика каталитического разложения пероксида водорода (гетерогенный катализ).
- •Теоретическая часть
- •Экспериментальная часть
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Экспериментальная часть.
- •Примеры решения задач.
- •Задачи для самостоятельного решения
- •Контрольные вопросы по теме: «Скорость химических реакций».
- •Экспериментальная часть
- •Задачи для самостоятельного решения
- •Экспериментальная часть.
- •Контрольные вопросы по теме: «Адсорбция»
- •Лабораторная работа № 12 Тема: Адсорбция уксусной кислоты почвой
- •Теоретическая часть
- •Экспериментальная часть
- •Примеры решения задач
- •Задачи для самостоятельного решения.
- •Экспериментальная часть.
- •Контрольные вопросы по теме: «Коллоидные растворы».
- •Лабораторная работа № 14 Тема: Получение коллоидных растворов
- •Теоретическая часть
- •Способы получения коллоидных растворов.
- •Структура коллоидных систем.
- •I слой iIслой
- •Экспериментальная часть Разновидности конденсационного метода получения золей.
- •1. Смена растворителя. Получение гидрозоля серы или канифоли
- •2. Реакция гидролиза. Получение золя гидроксида железа (III).
- •3. Реакция двойного обмена. Получение золя иодида серебра.
- •4. Получение золя мыла
- •5. Взаимодействие положительно и отрицательно заряженных золей
- •Примеры решения задач
- •Задачи для самостоятельного решения.
- •Контрольные вопросы по теме: «Свойства дисперсных систем».
- •Лабораторная работа №15 Тема: Коагуляция золей. Свойства растворов высокомолекулярных соединений
- •Теоретическая часть.
- •Свойства коллоидных систем
- •Экспериментальная часть
- •2. Определение защитного числа желатины
- •3. Определение изоэлектрической точки желатина
- •4. Пептизация осадков белков
- •5. Определение знака заряда коллоидных частиц методом капиллярного анализа.
- •Примеры решения задач
- •Задачи для самостоятельного решения.
- •Контрольные вопросы по теме: «Свойства растворов вмс».
- •Лабораторная работа № 16 Тема: Экспериментальное изучение коллоидных свойств высокомолекулярных соединений
- •Теоретическая часть.
- •Экспериментальная часть
- •1. Определение изоэлектрической точки белка
- •2. Изучение кинетики набухания зерна
- •Условный объем набухающего зерна
- •3. Влияние электролитов на набухание желатина
- •4. Влияние электролитов на желатинирование.
- •Задачи для самостоятельного решения.
- •Контрольные вопросы по теме: «Получение микрогетерогенных систем».
- •Лабораторная работа № 17 Тема: Грубодисперсные (микрогетерогенные) системы. Получение эмульсии, суспензий и пен.
- •Теоретическая часть.
- •Литература
- •Список терминов.
- •Приложения
- •Правила пользования таблицами десятичных логарифмов.
- •Вопросы для подготовки
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тема: Коллигативные свойства растворов. Теоретическая часть
- •Вопросы для подготовки и контроля знаний
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тема: Буферные растворы. Теоретическая часть
- •Вопросы для подготовки и контроля знаний
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тема: Электрохимия. Электропроводимость растворов электролитов. Теоретическая часть
- •Водородный электрод
- •Каломельный электрод
- •Хингидронный электрод
- •Вопросы для подготовки и контроля знаний
- •Примеры решения задач
- •0,01 Моль 0,1 моль
- •Задачи для самостоятельного решения
- •Тема: Химическая кинетика. Скорость химической реакции. Теоретическая часть
- •Вопросы и задачи для самостоятельной подготовки и контроля знаний
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тема: Адсорбция на поверхности растворов. Уравнение Фрейндлиха и Ленгмюра. Адсорбционные явления в почвах, растениях и организмах. Теоретическая часть
- •Вопросы для подготовки и контроля знаний
- •Примеры решения задач
- •Задачи для самостоятельного решения.
- •Тема: Коллоидные растворы.
- •Способы получения коллоидных растворов.
- •Структура коллоидных систем.
- •I слой iIслой
- •Свойства коллоидных систем
- •Вопросы для подготовки и контроля знаний
- •Примеры решения задач
- •Задачи для самостоятельного решения.
- •Тема: Растворы высокомолекулярных соединений. Теоретическая часть.
- •Вопросы для самостоятельной подготовки и контроля знаний
- •Задачи для самостоятельного решения.
- •Тема: Микрогетерогенные системы.
- •Вопросы и задачи для самостоятельной подготовки и контроля знаний
- •Список терминов.
- •6. Методические указания по выполнению контрольных работ студентами заочной формы обучения Варианты заданий для контрольных работ
- •Тестовые задания для итогового контроля знаний.
Экспериментальная часть
Измерение тепловых эффектов процессов производят в приборах, называемых калориметрами. Конструкция калориметрической установки зависит от особенностей изучаемого процесса, простейшая представлена на рис. 1. Такого типа калориметры применяются для определения теплот растворения солей, теплот нейтрализации и др.
Исследуемые вещества вносят в калориметрический стакан и о тепловом эффекте при их превращениях судят по изменению температуры в калориметрическом стакане. Изменение температуры ΔТ зависит не только от теплоты процесса Q, протекающего в калориметре, но и от теплоемкости калориметрической системы (Ск): Q = Ск ΔТ.
Определение постоянной калориметра.
Для расчета теплового эффекта процесса, необходимо знать постоянную калориметра (Ск), то есть количество тепла (теплоемкость калориметра), которое требуется для нагревания калориметра с термометром, водой и другими веществами на 1°С. Процесс определения постоянной калориметра называется – калибровкой калориметра.
Постоянную калориметра можно определить экспериментально, измерив изменение температуры какого-либо стандартного процесса, тепловой эффект которого известен. Например, можно измерить тепловой эффект растворения нитрата калия в воде. Собирают калориметр рис. 1.

Рис. 1 Схема калориметра
Опыт 1. Определение теплоты растворения соли.
Взвешивают 5 г KNO3 и растворяют его в 75 мл воды. Записывают температуру раствора. Фиксируют изменение температуры только за счет проводимого процесса, поэтому опыт делят на три периода (для введения поправки на теплообмен):
а) начальный, продолжающийся не менее 5 мин;
б) главный – время протекания исследуемого процесса;
в) заключительный, сопровождающийся линейным изменением температуры.
Зафиксированную температуру записывают в тетрадь.
Таблица 1.
Зависимость изменения температуры раствора от времени
Время от начала опыта, мин.
|
температура t, ˚С |
0 |
|
0,5 |
|
По экспериментальным данным строят зависимость изменения температуры во времени (рис. 2). Все построения выполняют на миллиметровой бумаге.

Рис. 2. Изменение температуры во времени.
Начальный период (участок АВ на рис. 2) служит для установления постоянной скорости теплообмена калориметра с окружающей средой в исходных условиях. Температура системы со временем может снижаться либо расти в зависимости от начальной разности температур воды в калориметрическом сосуде и окружающей среды. После установления равномерного изменения температуры следует провести, как минимум, десять измерений с интервалом 30 с.
После установления постоянной скорости теплообмена в калометрическом сосуде проводят химическую реакцию, в результате которой происходит выделение или поглощение тепла. Этот процесс – главный период (участок ВС на рис. 2 для экзотермической реакции). Продолжительность этого периода зависит от скорости процесса.
По окончании процесса происходит теплообмен калориметрической системы с окружающей средой, и время после установления постоянной скорости теплообмена называется конечным периодом (отрезок CD на рис. 2).
Истинное изменение температуры в ходе калориметрического опыта определяют графически. Для этого строят зависимость температуры от времени как на рис. 2. Точки С и В проектируются на ось ординат. Участок МК делится пополам и через точку L проводится прямая, параллельная оси абсцисс до пересечения с экспериментальной кривой в точке G, через которую проводится прямая, параллельная оси ординат. Отрезки АВ и CD, соответствующие начальному и конечному периодам, экстраполируют до пересечения с этой вертикальной прямой.
Отрезок EF показывает изменение температуры опыта с учетом поправки на теплообмен. Полученное с помощью графика изменение температуры ΔТ = EF соответствует изменению температуры при растворении соли или в ходе реакции, которое имело бы место, если бы удалось исключить теплообмен системы с окружающей средой во время процесса растворения или реакции.
Поскольку процесс в калориметре протекает при постоянном давлении, тепловой эффект изучаемого процесса равен изменению энтальпии системы:
Qр. = Ск·ΔТ =nΔΗ , где (1)
n – число молей реагирующего вещества.
Постоянную калориметра вычисляют по формуле:
Ск
=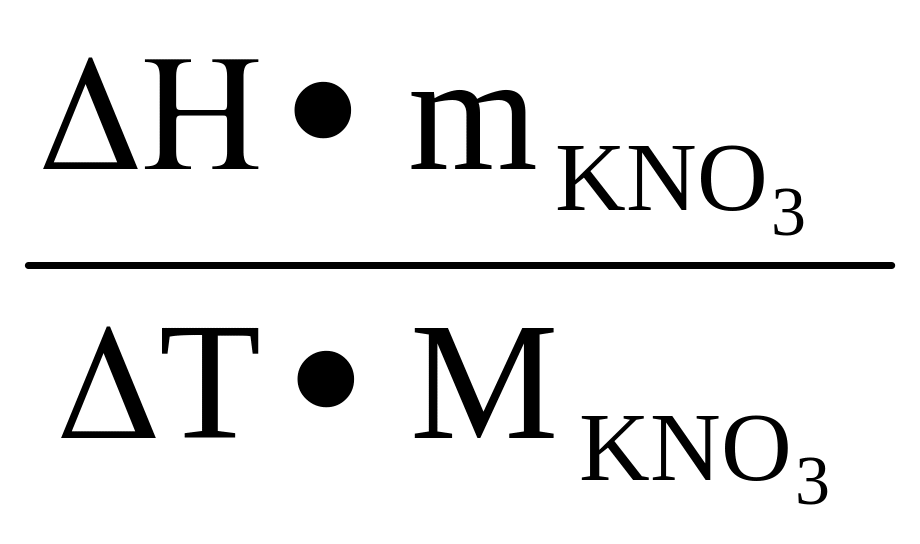 ,
(2)
,
(2)
где ΔΗ – теплота растворения KNO3 в воде, значение которой есть в справочниках, mKNO3 – навеска KNO3, МKNO3 – молярная масса KNO3.
ΔΗ (KNO3)= - 35,65 кДж/моль (-8,52 Ккал/моль)
Опыт 2. Определение теплоты растворения нитрата аммония
В стакан на 100 мл наливают 75 мл воды и измеряют ее температуру. Затем вносят 5 г нитрата аммония и измеряют температуру раствора (как описано в опыте 1). Экспериментальные данные представить в виде таблицы 1.
Построить зависимость изменения температуры во времени и определить ΔТ (как описано в опыте 1).
Теплоту растворения исследуемой соли рассчитывают по формуле:
ΔΗ=![]() (3)
(3)
где Ск – константа прибора, найденная в предыдущем опыте.
Рассчитайте относительную ошибку при определении теплоты растворения соли по формуле:
а=![]() ,
(4)
,
(4)
где ΔΗтеор – табличное значение теплоты растворения соли.
ΔΗтеор (NН4NO3) = - 26,8 кДж/моль
Форма отчета. Отчет должен содержать название и цель работы, краткие теоретические положения, описание хода работы, таблицы экспериментальных данных, графики изменения температуры во времени (на миллиметровой бумаге), результаты расчета, оценку погрешности определения теплоты растворения соли, вывод по проделанной работе.
