- •Белки и их биологическая функция
- •19 Из 20 аминокислот содержат в α -положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты
- •Пептидная связь. Строение и биологические свойства пептидов
- •Структурные белки
- •Механизм действия ферментов
- •Энергия активации
- •Способность ферментов к регуляции
Механизм действия ферментов
Любые химические реакции протекают, подчиняясь двум основным законам термодинамики: закону сохранения энергии и закону энтропии. Согласно этим законам, общая энергия химической системы и её окружения остаётся постоянной, при этом химическая система стремится к снижению упорядоченности (увеличению энтропии).
Энергией активации называют дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию.
При достижении этого энергетического барьера в молекуле происходят изменения, вызывающие перераспределение химических связей и образование новых соединений.
свободная
энергия активации
времяЭнергия активации
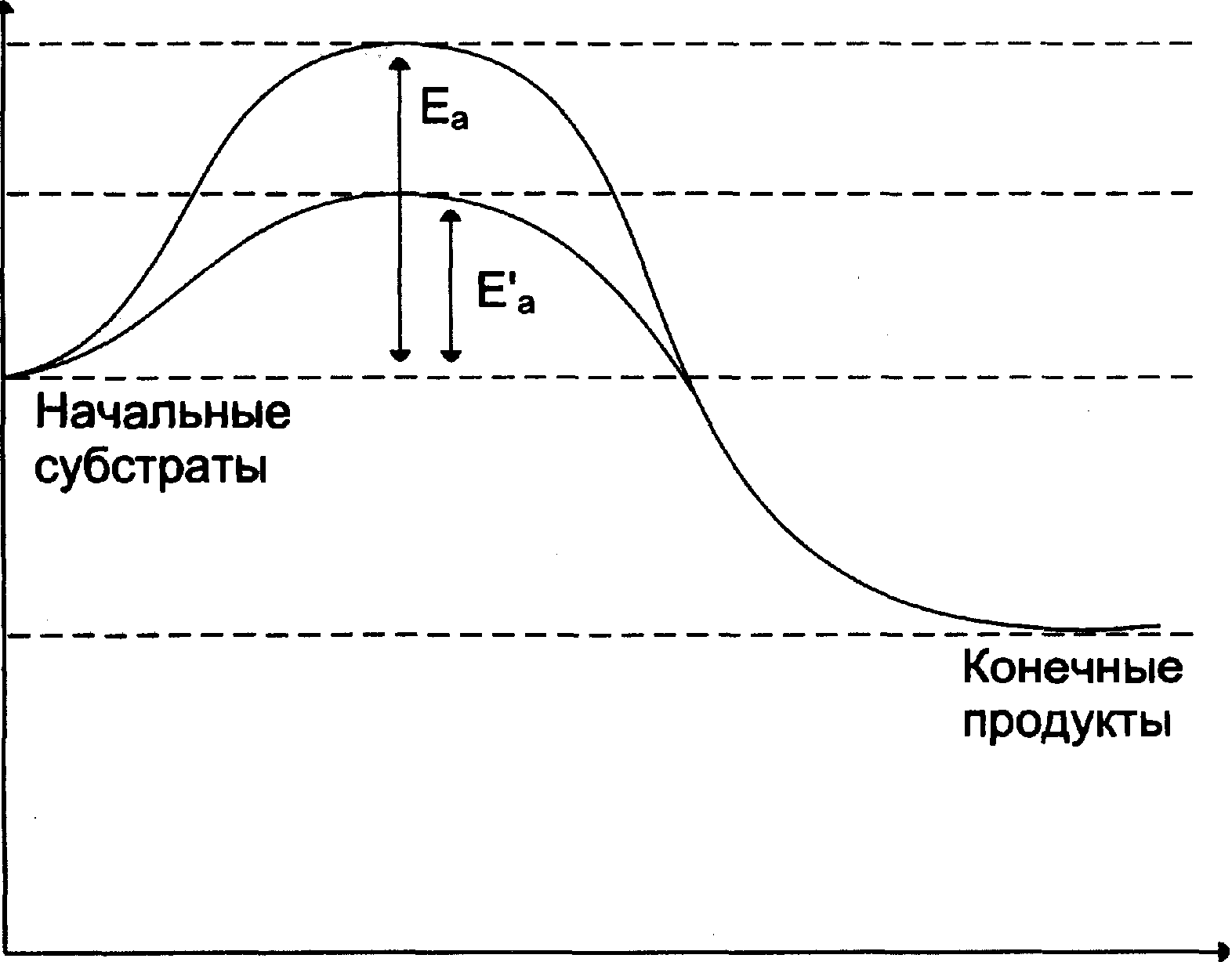
Еа - энергия активации некатализируемои реакции
Е'а - энергия активации катализируемой ферментами реакции
В механизме ферментативного катализа решающее значение имеет образование фермент-субстратного комплекса в активном центре фермента. Активный центр фермента комплементарен субстрату, т.е. соответствует ему как «ключ замку». Это объясняет то что ферменты обладают высокой субстратной специфичностью.
Молекула фермента, как правило, во много раз больше молекулы субстрата, подвергающегося химическому превращению этим ферментом. В контакт с субстратом вступает лишь небольшая часть молекулы фермента, обычно от 5 до 10 аминокислотных остатков, формирующих активный центр фермента. Роль остальных аминокислотных остатков состоит в обеспечении правильной конформации молекулы фермента для оптимального протекания химической реакции. Субстраты располагаются таким образом, чтобы участвующие в реакции функциональные группы субстратов находились в непосредственной близости друг к другу. Это свойство активного центра называют эффектом сближения и ориентации реагентов. Такое упорядоченное расположение субстратов вызывает уменьшение энтропии и, как следствие, снижение энергии активации (Еа), что определяет каталитическую эффективность ферментов. Активный центр фермента также способствует дестабилизации межатомных связей в молекуле субстрата, что облегчает протекание химической реакции и образование продуктов. Это свойство активного центра называют эффектом деформации субстрата.
Способность ферментов к регуляции
Активность ферментов в клетке зависит от количества молекул субстрата, продукта, наличия кофакторов и коферментов. Действие ферментов в клетке, как правило, строго упорядочено: продукт одной ферментативной реакции является субстратом другой, образуя таким образом «метаболические пути». Среди множества ферментов практически каждого метаболического пути различают ключевые, или регуляторные, ферменты, активность которых может изменяться в зависимости от потребности клетки в конечном продукте метаболического пути. Регуляторные ферменты расположены, как правило, в начале и/или в месте разветвления метаболического пути и обычно имеют очень сложное строение.
У некоторых ферментов есть участки связывания малых молекул, которые могут уменьшить, или увеличить активность фермента, что создает возможность для обратной связи. Вещество, замедляющее протекание ферментативной реакции, называется ингибитором. Различают обратимые и необратимые ингибиторы. Обратимые ингибиторы могут быть конкурентные и неконкурентные.
Конкурентный ингибитор конкурирует с субстратом за связывание с активным центром, но в отличие от субстрата конкурентный ингибитор не подвергается превращению.
Во время неконкурентного ингибирования ингибитор присоединяется к ферменту не в активном центре, а совсем в другом месте.
В случаях как конкурентного, так и неконкурентного ингибирования действие ингибитора является обратимым и по прошествии определенного времени и воздействия к ферменту возвращается каталитическая активность.
Необратимое ингибирование - Формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации.
Изучение ингибирования ферментов играет важную роль в создании и изучении дейстия фармакологических средств. Большинство из лекарств является обратимыми ингибиторами, (напр. сульфаниламидные препараты, применяемые для лечения инфекционных заболеваний; аналоги нуклеотидов для лечения онкологических заболеваний и т.д.) а много токсических веществ ( напр. нейропаралитические яды, ) являются необратимыми ингибиторами ферментов.
