- •Белки и их биологическая функция
- •19 Из 20 аминокислот содержат в α -положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты
- •Пептидная связь. Строение и биологические свойства пептидов
- •Структурные белки
- •Механизм действия ферментов
- •Энергия активации
- •Способность ферментов к регуляции
Пептидная связь. Строение и биологические свойства пептидов
α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Карбоксильная группа одной аминокислоты ковалентно связывается с аминогруппой другой аминокислоты. При этом возникает R-CO-NH-R связь, называемая пептидной связью. При этом происходит отщепление молекулы воды .

При помощи пептидных связей из аминокислот образуются белки и пептиды. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, октапептид и т.д. Полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки». Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную C-карбоксильную группу — С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца.
Связь между α-углеродным атомом и α-аминогруппой или α-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. α-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве. Пептидные связи очень прочны и являются ковалентными.
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью. Такими являются целый ряд гормонов – окситоцин (9 аминокислотных остатков), вазопрессин (9), брадикинин (9) регулирующий тонус сосудов, тиреолиберин (3), антибиотики – грамицидин, пептиды, обладающие обезболивающим действием (энкефалины(5) и эндорфины и другие опиоидные пептиды). Обезболивающий эффект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина;
Окситоцин выделяется в кровь во время кормления ребёнка, вызывает сокращение миоэпителиальных клеток протоков молочных желёз и стимулирует выделение молока. Кроме того, окситоцин влияет на гладкую мускулатуру матки во время родов, вызывая её сокращение.
В отличие от окситоцина, основное физиологическое действие вазопрессина — увеличение реабсорбции воды в почках при уменьшении АД или объёма крови (поэтому другое название этого гормона — антидиуретический). Кроме того, вазопрессин вызывает сужение сосудов.
Гипоталамический нейропептид Y(36) является мощным стимулятором пищевой активности, усиливает потребление пищи, т. к. вызывает чувство голода.
Различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертичной структурами. Существуют общие правила, по которым идёт формирование пространственных структур белков.
Первичная структура белка – это ковалентная структура остова полипептидной цепи – линейная последовательность аминокислотных остатков, соединенных друг с другом пептидными связями. Первичная структура каждого индивидуального белка закодирована в участке ДНК, называемом геном. В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на мРНК, а затем, используя мРНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка. Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для данного белка первичную структуру.
Инсулин является первым белком, первичная структура которого была расшифрована. Инсулин — белковый гормон; содержит 51 аминокислоту, состоит из двух полипептидных цепей (цепь А содержит 21 аминокислоту, цепь В — 30 аминокислот). Инсулин синтезируется в β-клетках поджелудочной железы и секретируется в кровь в ответ на повышение концентрации глюкозы в крови. В структуре инсулина имеются 2 дисульфидные связи, соединяющие 2 полипептидные цепи А и В, и 1 дисульфидная связь внутри цепи А
Вторичная структура белков – это конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами -NH и -СО. Существует два основных способа укладки цепи — α-спираль и β-структура.
α –Спираль

В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами водорода аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали. На один виток α-спирали приходится 3,6 аминокислотных остатка.
В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате α-спираль «стягивается» множеством водородных связей. Несмотря на то, что данные связи относят к разряду слабых, их количество обеспечивает максимально возможную стабильность α-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) α-спиралей уменьшается, а их гидрофобность увеличивается.
α-Спиральная структура — наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования α-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится.
Радикалы
аминокислот находятся на наружной
стороне
α
-спирали и направлены от пептидного
остова
в стороны. Они не
участвуют в образовании
водородных связей, характерных для
вторичной структуры, но некоторые
из них могут нарушать
формирование α-спирали.
К ним относятся: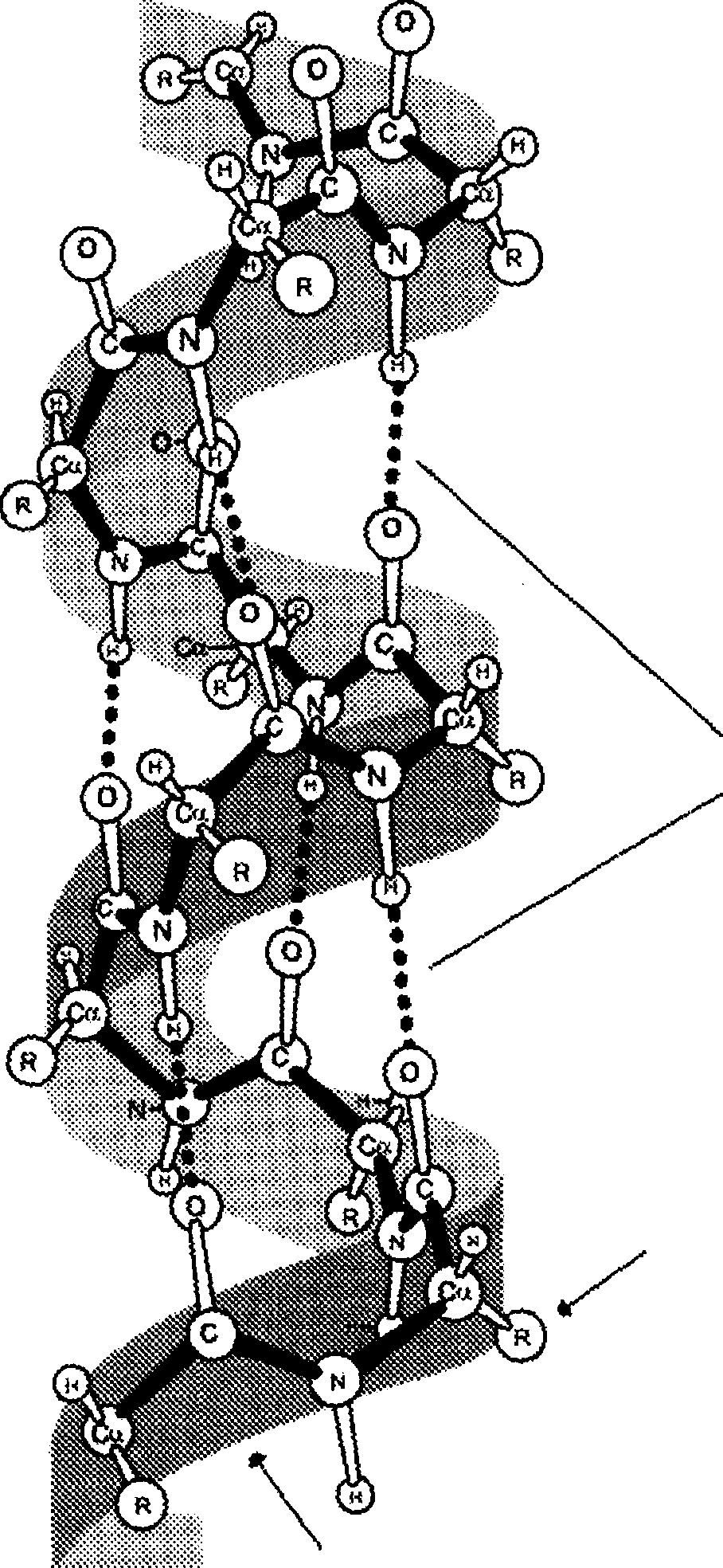
-
пролин. Его атом азота входит в состав жёсткого кольца, что исключает возможность вращения вокруг -N-CH- связи. Кроме того, у атома азота пролина, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовать водородную связь в данном месте пептидного остова, и α-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб;
-
участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания;
-
участки с близко расположенными объёмными радикалами, механически нарушающими формирование а-спирали, например метионин, триптофан.
β -Структура
β-Структура
формируется за счёт образования множества
водородных связей между атомами пептидных
групп линейных областей одной полипептидной
цепи, делающей изгибы, или между разными
полипептидными цепями,
β-Структура
образует
фигуру, подобную листу, сложенному
«гармошкой»,
— β-складчатый
слой.
Складчатый слой фиброина
шелка: зигзагообразные
антипараллельные складки.
Содержат много остатков
Глицина и Аланина
Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В β-структурах водородные связи расположены перпендикулярно полипептидной цепи.
Третичная структура белков — трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Третичная структура свернутой полипептидной цепи стабилизируется рядом взаимодействий между радикалами аминокислот: это гидрофобные
взаимодействия, электростатическое притяжение, водородные связи, а также
дисульфидные -S-S- связи.
Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы.
Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей.

Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка. 1 — ионные связи; 2 — водородные связи; 3 — гидрофобные связи; 4 — дисульфидные связи.
Ионные связи (электростатическое притяжение) могут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными (катионными) группами радикалов лизина, аргинина или гистидина. Водородные связи возникают между гидрофильными незаряженными группами (такими как -ОН, -CONH2, SH-группы) и любыми другими гидрофильными группами. Третичную структуру некоторых белков стабилизируют дисульфидные связи, образующиеся за счёт взаимодействия SH-групп двух остатков цистеина. Эти два остатка цистеина могут находиться далеко друг от друга в линейной первичной структуре белка, но при формировании третичной структуры они сближаются и образуют прочное ковалентное связывание радикалов.
Большинство внутриклеточных белков лишено дисульфидных связей. Однако такие связи распространены в белках, секретируемых клеткой во внеклеточное пространство. Полагают, что эти ковалентные связи стабилизируют кон-формацию белков вне клетки и предотвращают их денатурацию. К таким белкам относят гормон инсулин и иммуноглобулины.
Четвертичная структура белков. Многие белки содержат в своём составе только одну полипептидную цепь. Такие белки называют мономерами. К мономерным относят и белки, состоящие из нескольких цепей, но соединённых ковалентно, например дисульфидными связями (поэтому инсулин следует рассматривать как мономерный белок).

Способ упаковки двух или более отдельных глобулярных белков в молекуле является четвертичной структурой белка.
Отдельные полипептидные цепи в таком белке носят название мономеров, или субъединиц. Белок, содержащий в своём составе несколько мономеров, называют олигомерным. Олигомерные глобулярные белки обычно имеют крупные размеры и часто выполняют в ферментативных комплексах регуляторные функции.
Поддержание характерной для белка конформации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом.
Конформационные изменения играют огромную роль в функционировании белков в живой клетке. Разрыв большого количества слабых связей в молекуле белка под воздействием органических растворителей, ультразвука, температуры, pH, и т.д. приводит к разрушению её нативной конформации. Развертывание цепей без разрушения их ковалентных связей называется денатурацией. Денатурированный белок биологически неактивен. При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается, однако его функция утрачивается.
функции белков
Белки выполняют в клетках множество биологических функций. По признаку сходства выполняемых белками функций их можно разделить на следующие большие группы.
Ферменты
Ферменты — специализированные белки, ускоряющие течение химических реакций. Благодаря ферментам в клетке скорости химических реакций возрастают в миллионы раз. Так как ферменты, как и любые белки, имеют активный центр, они специфически связывают определённый лиганд (или группу похожих лигандов) и катализируют определённый тип химического превращения данной молекулы. В настоящее время известно около 2000 различных ферментов, ускоряющих различные химические реакции. Например, протеолитический фермент трипсин разрушает в белках пептидные связи, образованные карбоксильной группой основных аминокислот — аргинина или лизина. Фермент рибонуклеаза расщепляет фосфоэфирную связь между нуклеотидами в полинуклеотидной цепи.
Благодаря набору ферментов в клетках превращения поступающих в них веществ протекают не хаотично, а в строго определённых направлениях.
