
- •1. Правила поширеності хімічних елементів у земній корі. Кларк елементів. Геохімічна класифікація хімічних елементів. Міграція хімічних елементів.
- •2. Ступінчаста дисоціація електролітів. Уявний ступінь дисоціації. Активність та коефіцієнт активності.
- •3. Імовірнісне та енергетичне трактування ентропії. Зміна ентропії при різних процесах
- •4. Перитектичні та евтектичні перетворення
- •3. Діаграми стану систем з обмеженою розчинністю компонентів у твердому стані
- •5. Хімічні елементи у природі. Походження хімічних елементів. Поширеність хімічних елементів.
- •6. Дисоціація комплексних іонів. Константи нестійкості комплексних іонів
- •7. Будова багато електронних атомів. Послідовність заповнення атомних орбіталей електронами. Провал електрона
- •8. Вплив різних факторів на гідроліз. Буферні суміші
- •9. Енергія активації. Її зв’язок з константою швидкості.
- •12.Атомно-молекулярне вчення та основні хімічні закони.
- •13.Закон еквівалентів.Закони стехіометрії.Сполуки змінного складу.
- •14.Іонний зв’язок.Енергія іонного зв’язку.
- •15.Кінетична теорія газів.Росподіл Больцмана-Максвела.
- •16. Металічний зв’язок. Ширина забороненої зони
- •18. Водневий зв’язок та міжмолекулярна взаємодія
- •19. Перший закон термодинаміки. Ентальпія
- •21.Механізми утворення ковалентного зв’язку. Донорно-акцепторний зв’язок
- •24. Типи фазових діаграм двокомпонентних систем
- •25. Метод валентних зв’язків. Схеми перекривання орбіталей
- •26.Пеіодичність властивостей простих і складних речовин. Метали й неметали в періодичній системі.
- •27. Будова Періодичної системи. Зміна властивостей елементів по підгрупах і періодах.
- •30. Агрегатні стани речовини. Кристали. Рідкі кристали.
- •32. Способи урівнювання рівнянь овр.
- •38. Ізомерія координаційних сполук
- •39. Класифікація солей. Номенклатура солей
- •43. Характеристики ковалентного зв’язку. Симетрія молекул
- •44. Типи фазових діаграм двокомпонентних систем.
- •45. Метод валентних зв’язків. Схеми перекривання орбіталей
- •49. Основні кількісні характеристики хімічного зв’язку.
- •57. Хімічна рівновага. Константа рівноваги та її зв’язок з термодинамічними функціями
- •58. Способи вираження концентрації та переведення їх одна в одну. Правило «павука»
- •59. Принцип Ле-Шательє. Приклади його застосування.
- •60. Закони ідеальних розчинів та відхилення від них
- •64. Огляд теорій кислот та основ.
- •67.Рівняння Шредінгера та методи його розв’язку.
- •68.Ряд активності металів.Стандартний водневий електрод.
- •69.Структура періодичної системи.Аналогії між елементами.Вторинна і внутрішня періодичність.
- •70.Рівняння Нернста.Можливість протікання окисно-відновних процесів.
- •71.Багатоелектронні атоми. Наближені методи опису їх моделі.
- •72. Гальванічні елементи. Електрорушійна сила гальванічного елемента.
- •73.Порядок заповнення енергетичних рівнів багатоелектронних атомів. Правило Клечковського.
- •81.Другий постулат Бора. Схема виникнення водневого спектру.
- •82. Іоннні рівноваги: водневий показник, добуток розчинності, обмінні реакції в розчинах.
- •83. Квантові числа. Вироджений стан електрона в атомі
- •84. Гідроліз солей. Визначення константи і ступеня гідролізу. Розрахунок рН при гідролізі.
- •86. Реакції зі зміною ступеня окиснення. Типи овр. Можливість їх протікання
- •87. Атомне ядро. Ядерні реакції
- •88. Корозія металів. Електрохімічна корозія та способи захисту від неї.
49. Основні кількісні характеристики хімічного зв’язку.
До основних характеристик хімічного зв’язку належать:
– довжина зв’язку l, нм;
– енергія зв’язку Е, кДж/моль;
– полярність зв’язку , D (дебай);
– поляризованість зв’язку RD (молекулярна рефракція), см3.
Довжина зв’язку – це відстань між ядрами атомів, які його утвори-ли.
Енергія зв’язку – це енергія, яку потрібно затратити на те, щоб ро-зірвати даний хімічний зв’язок. Така ж енергія виділяється при утворенні цього зв’язку між атомами.
Полярність зв’язку обумовлена зміщенням загальної електронної па-ри хімічного зв’язку до більш електронегативного атома.
Поляризованість зв’язку обумовлена легкістю зміщення (деформу-вання) електронної густини зв’язку під дією зовнішніх чинників (розчинни-ків, каталізаторів, реагенів).
50. Агрегатні стани речовини. Кристали. Рідкі кристали.



Криста́л — тверде тіло з упорядкованою внутрішньою будовою, що має вигляд багатогранника з природними плоскими гранями: впорядкованість будови полягає у певній повторюваності у просторі елементів кристала , що зумовлює виникнення т.зв. кристалічної ґратки.
Рідки́й криста́л — специфічна термодинамічна фаза деяких речовин, якій властиві риси як рідини (текучість), так і кристалу (анізотропія властивостей).Рідкий кристал - проміжна фаза (мезофаза) між ізотропною рідиною і кристалічним твердим тілом.(Фрідріх Рейнітцер)
51. Пояснення хімічного зв’язку у молекулі водню за теорією Гейтлера-Лондона.
У 1927 р. Гейтлер і Лондон на основі квантово-механічних розрахунків довели,що під час зближення атомів,електрони яких мають однаково напрямлені спіни,збільшується сила їх відштовхування,а під час зближення атомів,електрони яких мають спіни,напрямленні в протилежні боки, наростає сила притягання,але до певного моменту,доки наступить відштовхування ядер.
52. Способи зрівнювання рівнянь ОВР. (Див завдання 32)
53. Енергія активації. Рівняння Арреніуса. Стеричний фактор
.Енергія
активізації - це та енергія, яку повині
мати частинки для ефективного
зіткнення.Вона становить різницю між
енергією активного комплексу та середньою
енергією частинок вихідних речовиню.Вплив
температури та енергії активації на
швидкість хімічних реакцій виражають
за допомогою рівняння Арреніуса(1889):k=A*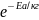 ,де
А- передекспоненціальний множник-частота
зіткнень частинок;е=2,7.Множник
називають стеричним фактором.Він можк
мати різні значення:від більших ніж
одиниця до дуже малих.До стеричного
фактора не входить температура,бо вона
не впливає на орієнтацію частинок.
,де
А- передекспоненціальний множник-частота
зіткнень частинок;е=2,7.Множник
називають стеричним фактором.Він можк
мати різні значення:від більших ніж
одиниця до дуже малих.До стеричного
фактора не входить температура,бо вона
не впливає на орієнтацію частинок.
54. Термодинаміка процесу розчинення. Сольватація.
Кількісною мірою невпорядкованості
є функція S,яку
називають ентропією.В ізольованій
системі спонтанні процеси відбуваються
у напрямку збільшенння ентропії.При
температурі,що прямує до нуля,ентропія
всіх речовин у стані ідеальних кристалів
стає нульовою.Якщо процес розчинення
відбувається з поглинанням
теплоти(ендотермічний,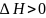 ),то
згідно загального рівняння
),то
згідно загального рівняння
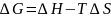 ентропія системи зростає,тобто
ентропія системи зростає,тобто
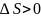 .Якщо
процес розчинення відбувається з
виділенням теплоти(екзотермічний,
.Якщо
процес розчинення відбувається з
виділенням теплоти(екзотермічний, ),то
можливі два випадки:
I
),то
можливі два випадки:
I
 .
.
У процесі розчинення частинки речовини,що розчиняється,утворюють з молекулами розчинника відносно нестійкі сполуки,які часто мають змінний склад і називаються сольватами
55. Залежність швидкості реакції від тиску та температури.
Правило Вант-Гоффа(1884)-з
підвищенням температури на кожні 10*
швидкість гомогенних реакцій зростає
в 2-4 рази,тобто з підвищенням температури
в арифметичній прогресії швидкість
реакції зростає в геометричній
прогресії: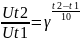 ,де
Ut2 I
Ut1-швидкості
реакції відповідно при початковій і
кінцевій температурах;
,де
Ut2 I
Ut1-швидкості
реакції відповідно при початковій і
кінцевій температурах;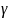 -температурний
коефіцієнт швидкості реакції-відношення
константи швидкості при температурі
t+10 до константи при
температурі t:
-температурний
коефіцієнт швидкості реакції-відношення
константи швидкості при температурі
t+10 до константи при
температурі t: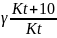
56. Розчинність. Вплив на неї різних факторів.
Розчинність — це фізична величина, що показує, яку масу певної речовини можна розчинити в 1 л розчинника за певних температури й тиску. Мірою розчинності або коефіцієнтом розчинності служить кількість грамів речовини, яка при даній температурі розчиняється в 100 г води з утворенням насиченого розчину Розчинність газів залежить від температури та тиску, розчинність рідких та твердих тіл від тиску практично не залежить. Розчинність обумовлюється фізичною і хімічною спорідненістю молекул розчинника і розчинюваної речовини.. Деякі рідини можуть необмежено розчинятися в інших, тобто змішуються у будь-яких пропорціях (наприклад, спирт і вода). Інші взаєморозчиняються тільки до певної межі (наприклад, при перемішуванні пари “вода–ефір” утворюється два шари: верхній насичений розчин води в ефірі, нижній — насичений розчин ефіру у воді).
