
- •2. Фізико-хімічні властивості білків
- •5. Перет. Білків в проц. Техн.Оброб.
- •6. Повноцінні та неповноцінні білки.
- •7. Білки. Вміст в харчових продуктах
- •8. Вміст білків в тканинах рослин і тварин
- •9. Альбуміни та глобуліни
- •10. Сучасні уявлення про структуру білків
- •11. Незамінні амінокислоти в харчові прод.
- •13. Перетворення білків в процесі травлення.
- •14.Ізоелектрична точка білка
- •15. Сульфуровмісні амінокислоти: будова, біохімічна роль. Якісна реакція на виявлення сульфуровмісних амінокислот в складі білків.
- •2.Класифікація вітамінів
- •1.Біохімічна роль води в життедіяльності людини.
- •3. Вода в харчових продуктах.
- •4. Розчини
- •5. Вимоги до питної води
- •6. Способи очистки питної води
- •7. Поняття про показник рн. Забарвлення індикаторів
- •1. Функції
- •2. Класифікація
- •2.2 Поліцукриди
- •3. Перетворення вуглеводів в процесі технологічної обробки
- •4. Перетравлювання вуглеводів
- •4 .Функції ліпідів в орган. Людини. Добова потреба
- •5. Поняття про ліпіди. Вміст жирів в харчових продуктів
- •6. Складні ліпіди
- •7. Прості ліпіди
- •8. Перетворення ліпідів в процесі травлення
- •9. Перетворення ліпідів в процесі технологічної обробки
- •10. Класифікація ліпідів
- •11. Карбонові кислоти як складники ліпідів
- •134. Гідроліз поліцукридів
- •144. Забруднювачі та токсиканти харчових продуктів
- •1.Ферменти будова механізм дії
- •2.Специфічність ферментів.
- •3.Фактори що впливають на активність ферментів
- •4.Класифікація ферментів
- •5.Застосування ферментів у харчовій промисловості
9. Альбуміни та глобуліни
Ці білки дуже поширені в тваринному i рослинному світ i здебільшого зустрічаються разом. Вони становлять основу протоплазми. Їх є багато в плазмі крові, сироватці молока та різних тканинах організму. Вони відносяться до протеїнів- прості білки,до складу яких входять залишки альфа-амінокислот.
Альбумін- добре розчинний у воді, розчинах солей; знаходится у плазмі крові, куриних яйцях, молоці.
Глобуліни- розчинні в 10% розчині солей,при концентрації випадають в осад; містяться в зернах злаків, бобових, плазмі крові, куриних яйцях
Характерною ознакою альбумінів є менша молекулярна маса порівняно з глобулінами. Глобуліни - більш грубо дисперсні i менш гідрофільні, ніж альбуміни. Тому колоїдні розчини глобулінів не там стійкі, як альбумінів.
10. Сучасні уявлення про структуру білків
До складу білків входить в основному 20 різних альфа-амінокислот, які сполучені між собою у певній послідовності. У молекулі білка розрізняють такі типи зв’язків: Пептидний, дисульфід ний, водневий, йонний та гідрофобну взаємодію.
У білках розрізняють 4 рівні структурної організації:
-первинна структура-певна послідовність залишків амінокислот у поліпептидних ланцюгах молекул білка.
- вторинна- альфа -спіраль або вета - складчаста структура.
- третинна- глобула(клубок)
- четвертинна- декілька поліпептидних ланцюгів, складна глобула.
11. Незамінні амінокислоти в харчові прод.
Незамі́нні амінокисло́ти — амінокислот, які не можуть синтезуватися у організмі і повинні обов'язково надходити з їжею.
Аргінін міститься у насінні гарбуза, свинині, яловичині, арахісі, кунжуті, йогурті, швейцарському сирі;
Валін міститься у зернових, м'ясі, грибах, молочних продуктах, арахісі, сої;
Гістидин міститься у тунці, лососі, свинячій вирізці, яловичому філе, курячих грудках, соєвих бобах, арахісі, сочевиці;
Ізолейцин міститься у мигдалі, кеш'ю, курячому м'ясі, турецькому горосі ( нут), яйцях, рибі, сочевиці, печінці, м'ясі, житі, у більшості насіння, сої;
Лейцин міститься у м'ясі, рибі, бурому рисі, сочевиці, горіхах, більшості насіння;
Лізин міститься у рибі, м'ясі, молочних продуктах, пшениці, горіхах, у амаранті;
Метіонін міститься у молоці, м'ясі, рибі, яйцях, бобах, квасолі, сочевиці і сої;
Треонін міститься у молочних продуктах та яйцях, у помірних кількостях - у горіхах і бобах;
Триптофан міститься у вівсі, бананах, сушених фініках, арахісі, кунжуті, кедрових горіхах, молоці, йогурті, сирі, рибі, курці, індичці, м'ясі;
Фенілаланін міститься у яловичині, курячому м'ясі, рибі, соєвих бобах, яйцях, сирі, молоці. Також є складовою частиною синтетичного цукрозамінника - аспартаму, котрий активно використовується в харчовій промисловості.
12 Якісні реакції на виявлення білка* біуретова реакція При взаємодії білків з солями міді у лужному середовищі спостерігається поява фіолетового забарвлення. Дана реакція характеризує наявність пептидних зв'язків : -CO - N H-
ксантопротеїнова реакція
При
дії нітратної кислоти на білки
спостерігається поява жовтого забарвлення.
Дана реакція характеризує наявність
бензольних ядер, що входять до складу
деяких амінокислот,наприклад фенілаланіну:
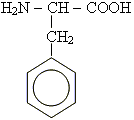
Присутність білків у харчових об’єктах визначається за допомогою якісних реакцій, які умовно поділяють на дві групи:- кольорові реакції реакції осадження.Перша група універсальні реакції - біуретова на пептидні зв’язки і нінгідринова на альфа-амінокислоти; - специфічні, які обумовлені присутністю в білку залишків певних амінокислот). За результатами специфічних реакцій роблять висновки щодо харчової цінності білків.Друга група – білки осаджують дією солей, органічних розчинників, конц розчинів кислот, солей, йонів важких металів, температури і в ізоелектричній точці. Білки в розчині достатньо нестійкі, тому при додаванні зазначених реагентів гідратна оболонка білку руйнується і вони випадають в осад
