
Лекция 4 Термохимия
Термохимия изучает тепловые эффекты, которыми сопровождаются химические реакции. Вследствие того что внутренняя энергия и энтальпия вещества зависят от температуры, давления и агрегатного состояния, но не зависят от предыстории системы, изменение внутренней энергии или энтальпии для физических процессов или химических реакций не зависит от пути, по которому протекает этот процесс (или реакция).
Термохимические данные обычно выражают с помощью уравнения химической реакции, для которого приводятся значения ΔН или ΔU. При экзотермических реакциях теплота выделяется, и значения ΔН и ΔU для них отрицательны. При эндотермических реакциях теплота поглощается, а ΔН и ΔU имеют положительные значения.
Например, сжигание графита в чистом кислороде при 1 атм, приводящее к образованию чистой двуокиси углерода, сопровождается выделением 9 4051,8 кал/моль (тепловой эффект приводится для 25°С). Это можно записать так:
Сграфит + О2(г) → СО2(г)
ΔН298 = - 94 051,8 кал/моль
Стандартные состояния.
Очень важно точно определить состояние реагирующих веществ и продуктов реакции. Чтобы облегчить табулирование термодинамических данных, приняты определенные стандартные состояния. Стандартное состояние газа – это состояние чистого газа при 1 атм (101,3 кПа); для жидкости – это состояние чистой жидкости при 1 атм; для твердого вещества – характерное кристаллическое состояние при 1 атм, например графит для углерода, ромбическая сера для серы. При написании уравнений реакций твердое вещество, жидкость и газ обозначаются символами (тв), (ж) и (г) соответственно, поскольку изменения энтальпии зависят от физического состояния реагирующих веществ и продуктов реакции. Стандартное состояние относится к 25 °С (298,15К), если специально не оговорены другие условия.
Если реагирующие вещества и продукты реакции взяты в стандартных состояниях, то нужно, строго говоря, помечать ΔН надстрочным индексом «°». Однако в мы будем опускать эти индексы (за исключением табличных данных) для упрощения обозначения. В тех случаях, когда производится только работа расширения, теплота, поглощенная при постоянном давлении, равна ΔН, т.е. разности энтальпий продуктов реакции и реагирующих веществ. В химических реакциях ΔН = ΣНпр - ΣНисх.
Абсолютные значения энтальпии неизвестны, но можно определить ее изменения. При окислении углерода выделяется теплота, при этом энтальпия системы уменьшается и ΔН имеет отрицательное значение.
Калориметрические измерения.
Для измерения тепловых эффектов, сопровождающих химические реакции, пользуются калориметрами. В наиболее распространенном типе калориметра реакция протекает в камере, которая помещена в изолированный сосуд, заполненный известным количеством воды. Повышение температуры воды измеряется чувствительным термометром (термометр Бекмана и пр.). Произведение приращения температуры на общую теплоемкость воды и калориметра равно количеству выделенного тепла. Теплоемкость воды, окружающей реакционную камеру, получают умножением массы воды на ее удельную теплоемкость. Теплоемкость калориметра определяют или путем проведения в нем реакции с известным тепловым эффектом, или путем введения известного количества тепла при помощи электрического нагревателя. Чтобы определить изменение температуры в калориметре, строят график зависимости температуры от времени до и после реакции, а затем экстраполируют обе линии ко времени реакции. Разность между экстраполированными значениями конечной и начальной температур и есть то повышение температуры, которое произошло бы, если бы не было потерь тепла калориметром за время наблюдения. В адиабатической калориметрии поправка на охлаждение становится излишней. В этом случае внешняя оболочка нагревается электрическим током с определенной скоростью, так что температура оболочки все время поддерживается равной температуре калориметра.
В связи с тем, что для термохимических измерений пригодны только те реакции, которые проходят быстро и до конца, наибольшее значение в термохимии имеют теплоты сгорания. Для полной уверенности в том, что сгорание прошло до конца, вещество поджигают электрической искрой в тяжелой стальной бомбе, наполненной кислородом под давлением 25 атм. В таких условиях все углеводороды сгорают, образуя воду и двуокись углерода. Некоторые реакции представляют известные трудности из-за того, что они идут недостаточно быстро и полно, образуя продукты не вполне определенного состава. Например, теплота сгорания соединений, подобных хлористому этилу, не может быть измерена точно таким методом, потому что в результате реакции получается смесь продуктов неопределенного состава.
Стандартная энтальпия реакций.
Чтобы облегчить сравнение различных реакций, экспериментальные термохимические данные приводят обычно в виде стандартной энтальпии реакции по 25 °С. Стандартная энтальпия сгорания органического соединения представляет собой стандартную энтальпию реакции полного окисления одного моля вещества до СО2 (г) и Н2О (ж).
Точные значения термохимических величин приведены в специальных справочниках. Пользуясь теплотой сгорания, можно рассчитать другие термохимические величины.
Расчет теплоты реакции при постоянном давлении
из теплоты реакции при постоянном объеме.
Для процесса, протекающего при постоянном давлении, справедливо равенство
(ΔН)Р = (ΔU)P + PΔV [4.1]
Для реакций, происходящих только между жидкими и твердыми веществами, величиной PΔV можно пренебречь по сравнению с (ΔU)P. В этом случае для всех практических целей количество теплоты, поглощенной при постоянном объеме, можно считать равным количеству теплоты, поглощенной при постоянном давлении. Однако если в реакции участвуют газы, величина PΔV может быть значительной. При расчете PΔV обычно можно с достаточной точностью предположить, что газ идеальный. Если Δn – разность числа молей газообразных продуктов реакции и газообразных реагирующих веществ, то PΔV = RTΔn. Следовательно,
(ΔН)Р = (ΔU)P + RTΔn [4.2]
В курсе термодинамики доказывается, что количество теплоты QP, поглощенное при постоянном давлении, равно -ΔНР, а количество теплоты QV, поглощенное при постоянном объеме, равно -ΔUV. В большинстве практических расчетов разница между (ΔU)V и (ΔU)P достаточно мала, и уравнение [4.2] можно записать:
QP = QV - RTΔn [4.3]
Этим уравнением пользуются для расчета QP из значений QV, полученных в калориметрической бомбе. При расчетах Δn важно указать температуру и определить, находится ли данное реагирующее вещество или продукт реакции в газообразном или жидком состоянии.
Пример 1.
Известно, что теплота сгорания н-гептана при постоянном объеме и 25°С по реакции
С7Н16(ж) + 11О2(г) = 7СО2(г) + 8Н2О(ж) Δn = 7 - 11 = - 4
равна ΔU = - 4 810,34 кДж/моль
Проведем расчет количества тепла выделяющегося при постоянном давлении по формуле [4.3]
QP = QV - RTΔn = 4 810 340 - 8,317·298,15·(-4) = 4 810 340 + 9 919 = 4 820 259 Дж/моль
ΔНР = - QP = - 4 820,3 кДж/моль
Применение первого закона термодинамики к термохимии.
В 1780 г. Лавуазье и Лаплас установили, что количество тепла, поглощаемое при разложении соединения, должно равняться количеству тепла, которое выделяется при образовании этого соединения в тех же условиях. Таким образом, если пишется обратная реакция, то должен быть изменен знак ΔН.
В 1810 г. Гесс показал, что суммарный тепловой эффект химической реакции при постоянном давлении не зависит от промежуточных стадий реакции, а зависит только от начального и конечного состояний.
Зная это, можно рассчитать изменение энтальпии для реакций, не поддающихся непосредственному изучению. Например, практически невозможно измерить теплоту сгорания углерода до окиси углерода в ограниченном количестве кислорода, потому что продукт реакции всегда будет состоять из смеси окиси и двуокиси углерода. Однако теплоту полного сгорания углерода до двуокиси в избытке кислорода измерить можно. Тогда для графита
С(тв) + О2(г) = СО2(г) ΔН = - 94,0518 ккал
Можно легко измерить и теплоту сгорания окиси углерода до двуокиси:
СО(г) + 0,5О2(г) = СО2(г) ΔН = - 67,6361 ккал
Напишем эти уравнения таким образом, чтобы, складывая их и сокращая подобные члены, получить нужную реакцию:
С(тв) + О2(г) = СО2(г) |
|
ΔН = - 94,0518 ккал |
СО2(г) = СО(г) + 0,5О2(г) |
|
ΔН = 67,6361 ккал |
С(тв) + 0,5О2(г) = СО(г) |
|
ΔН = - 26,4157 ккал |
Вторая реакция написана в обратном порядке и поэтому знак ΔН изменился с минуса на плюс. Это означает, что при реакции разложения двуокиси углерода
СО2(г) = СО(г) + 0,5О2(г)
поглотилось бы 67,6361 ккал.
Энтальпия образования.
Выше было показано, что изменения энтальпии для многих новых реакций можно рассчитать, пользуясь данными для реакций, изменения энтальпии для которых уже были измерены. Расчеты существенно упрощаются, если ввести понятие энтальпии образования ΔН°обр. Энтальпия образования представляет собой изменение энтальпии для реакции, в которой моль вещества образуется в стандартном состоянии из элементов, каждый из которых также находится в стандартном состоянии.
Пример 2.
Рассчитать энтальпию образования H2SO4(ж), используя изменения энтальпии при сгорании серы в SO2, при окислении SO2 в SO3 на платиновом катализаторе и теплоту растворения SO3 в Н2О с образованием H2SO4(ж). Искомая реакция является суммой следующих реакций, а сумма ΔН этих реакций и есть энтальпия образования H2SO4(ж):
S(тв) + О2(г) = SO2(г) ΔН = - 70,96 ккал
SO2(г) + 0,5O2(г) = SO3(г) ΔН = - 23,49 ккал
SO3(г) + H2O(ж) = H2SO4(ж) ΔН = - 31,14 ккал
Н2(г) + 0,5O2(г) = H2O(ж) ΔН = - 68,32 ккал
____________________________________________________________________________________________________________________ _________________________________________________________________________________________
S(тв) + Н2(г) + 2О2(г) = H2SO4(ж) ΔН°обр = - 193,91 ккал
Значение энтальпии образования можно использовать для расчета энтальпии реакции. Энтальпия реакции равна разности
ΔНР = ΣviΔHобр.прод – ΣvjΔHобр.исх [4.4]
где ΣviΔHобр.прод - сумма энтальпий образования продуктов реакции;
ΣvjΔHобр.исх - сумма энтальпий образования исходных реагентов;
vi, vj - стехиометрические коэффициенты в уравнении реакции.
По известным значениям энтальпии образования СО2 и Н2О легко можно рассчитать энтальпии образования органических соединений исходя из их теплот сгорания.
Пример 3.
Рассчитать энтальпию образования ацетилена, если известно ΔН реакции его сгорания:
С2Н2(г) + 2,5О2(г) = 2СО2(г) + Н2О(ж) ΔН = -1300,483 кДж
ΔН = 2· ΔНСО2 + ΔНН2О – ΔНС2Н2 откуда
откуда ΔНС2Н2 = 2· ΔНСО2 + ΔНН2О – ΔН
ΔНСО2 = -393,776 кДж/моль; ΔНН2О = -286,031 кДж/моль
ΔНС2Н2 = 2·(-393,776) + (-286,031) – (-1300,483) = 226,9 кДж/моль
Энтальпия образования многих соединений, ионов и атомов известна с большой точностью. Пользуясь этими данными, можно рассчитать изменение энтальпии для большого числа реакций по уравнению [4.4].
Пример 4.
Рассчитать изменение энтальпии при 25 °C для реакции:
Fe2О3(тв) + 2Аl(тв) = Al2O3(тв) + 2Fe(тв)
Энтальпии образованпя элементов равны нулю. Используя табличные данные, рассчитаем изменение энтальпии для реакции следующим образом:
ΔН = ΔНобр.Аl2O3 - ΔHобр.Fe2O3 = -399,1-(-196,5) = -202,6 ккал
Теплота растворения.
За стандартное состояние растворенного вещества в водном растворе принимают гипотетическое идеальное состояние с моляльной концентрацией единица, в котором энтальпия растворенного вещества равна его энтальпии в бесконечно разбавленном растворе.
При растворении теплота может поглощаться или выделяться. В общем случае теплота растворения зависит от концентрации полученного раствора. Интегральная теплота растворения определяется как изменение энтальпии в процессе растворения одного моля вещества в n моль растворителя.
Процесс растворения можно представить с помощью химического уравнения
НС1(г) + 5Н2O(ж) = НС1∙5Н2O ΔH = -15,31 ккал (-64,1 кДж)
где « НС1∙5Н2O» означает водный раствор (в данном случае 1 моль НС1 в 5 моль H2O). Зависимость интегральных теплот растворения НС1, NaOH и NaCl от количества воды (в моль на моль растворенного вещества) представлена на рисунке 4.1.
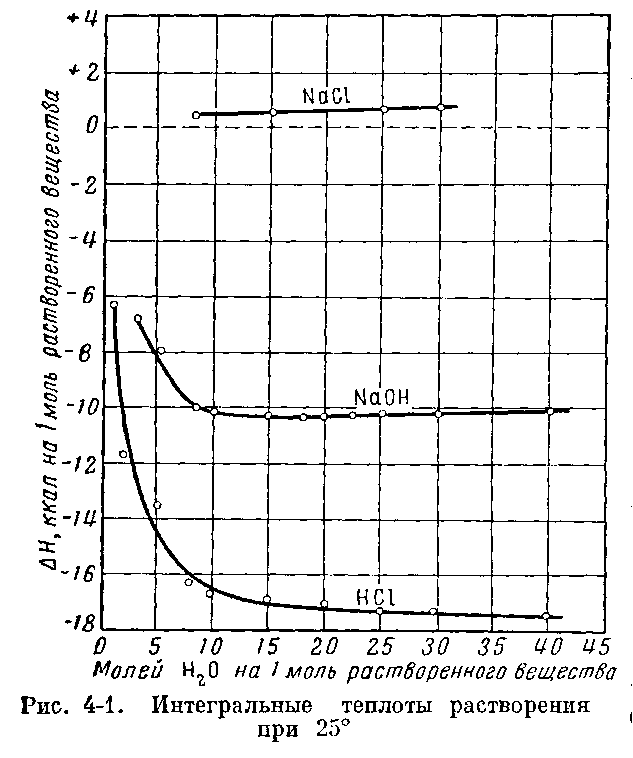
Рисунок 4.1. Интегральные теплоты растворения при 25 °С
Интегральная теплота растворения зависит от числа молей растворителя. Символ «aq» употребляют для обозначения водного раствора, который разбавлен настолько, что дальнейшее разбавление не сопровождается тепловым эффектом. В литературе, в этом случае, часто используют термин «бесконечное разбавление».
Например,
НС1 (г) + aq = HС1(aq) ΔН = - 17,96 ккал (-75,2 кДж)
Интегральные теплоты растворения веществ можно найти в справочниках физико-химических величин и в других специальных справочниках.
Когда растворяемое вещество и растворитель обладают химическим подобием и при растворении не возникает осложнений, связанных с ионизацией или сольватацией, теплоту растворения можно считать приблизительно равной теплоте плавления растворяемого вещества.
Казалось бы, всегда следует ожидать поглощения теплоты для преодоления сил притяжения между молекулами или ионами в твердом растворяемом веществе. Однако другой процесс, известный как процесс сольватации, состоящий во взаимодействии растворенного вещества с растворителем, сопровождается выделением тепла.
Значение такого сродства растворителя к растворяемому веществу для процесса растворения можно показать на примере растворения хлористого натрия в воде. В кристаллической решетке хлористого натрия положительные ионы натрия и отрицательные ионы хлора испытывают сильное взаимное притяжение. Энергия, необходимая для их разделения, настолько велика, что такие неполярные растворители, как бензол и четыреххлористый углерод, не растворяют хлористый натрий. Однако растворитель, подобный воде, обладающий высокой диэлектрической постоянной и большим дипольным моментом, испытывает сильное притяжение, как к ионам натрия, так и к ионам хлора. В результате происходит сольватация ионов с выделением большого количества тепла. Если, как в случае хлористого натрия, теплота, поглощенная при разрушении кристаллической решетки, приблизительно равна теплоте, выделенной при сольватации, то суммарный тепловой эффект растворения приблизительно равен нулю (небольшое нагревание или охлаждение). Для большинства кристаллических веществ при сольватации выделяется меньше тепла, чем поглощается в процессе растворения, и поэтому растворение происходит с поглощением тепла. У немногих солей типа безводного сульфата натрия энергия сольватации больше энергии разрушения кристаллической решетки, и поэтому тепло выделяется.
Поскольку образование разбавленных растворов, в основном, сопровождается бóльшим тепловым эффектом, чем концентрированных, при разбавлении концентрированных растворов тепло выделяется. Интегральная теплота разбавления от моляльности m2 до моляльности m1 равна количеству тепла, сопровождающему разбавление некоторого количества раствора с концентрацией m2, содержащего 1 моль растворенного вещества, чистым растворителем до концентрации m1.
Интегральная теплота разбавления от одной концентрации до другой равна разности интегральной теплоты растворения для этих двух концентраций.
