
- •Синтез 2-нафтолоранжевого красителя
- •1 Введение
- •3 Расчет количеств исходных веществ, необходимых для синтеза
- •3.1 Расчет основных исходных веществ
- •3.2 Расчет вспомогательных веществ
- •3.3 Таблица - Количества исходных веществ, применяемых в синтезе:
- •4 Теоретический выход 2-нафтолоранжевого красителя.
- •5 Ожидаемый выход 2-нафтолоранжевого красителя.
- •6 Описание хода синтеза
4 Теоретический выход 2-нафтолоранжевого красителя.
Для расчёта теоретического выхода 2-нафтолоранжевого красителя необходимо определить вещество, которое находится в недостатке. Из нового мольного соотношения видно, что сульфаниловая кислота находится в недостатке. Из сравнения реакций следует, что из 0.0289 моль кислоты должно получиться 0,0289 моль красителя. Поэтому теоретический выход 2-нафтолоранжевого красителя рассчитывается следующим образом:
1 моль NH2C6H4SO2OH ― 1 моль C16H11N2SO3H
0,0289 моль NH2C6H4SO2OH ― x мольC16H11N2SO3H
x = 0,0346 моль
Молекулярная масса 2-нафтолоранжевого красителя: 350 г/моль
m(теор)=n×M=0,0346моль×350г/моль=12,11 г
5 Ожидаемый выход 2-нафтолоранжевого красителя.
Ожидаемый выход красителя можно рассчитать по пропорции, учитывая, что по методике из 4.3 г сульфаниловой кислоты образуется 8 г красителя.
4,3 г ― 8 г
5 г ― x г
x
=
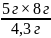 =9,3 г
=9,3 г
Значит, ожидаемый выход продукта9,3г.
12,11 г ― 100%
9,3г ― x%
x
=
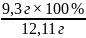 = 86,4%
= 86,4%
6 Описание хода синтеза
а) Диазотирование
В стакане емкостью 100 см3 растворяли при легком нагревании 5 г кристаллической сульфаниловой кислоты в 14,5 см3 2н раствора едкого натра. Поскольку сульфаниловая кислота плохо растворима в воде, ее перевели в растворимую натриевую соль.
После растворения всей кислоты жидкость имела щелочную реакцию (по лакмусу). Полученный раствор охладили водой, добавили 2,45 г азотистокислого натрия в 25 см3 воды и перемешали до полного его растворения. Далее раствор охладили льдом и прилили его при помешивании в стакан емкостью 500 см3 , содержащий 14,5 см3 2н раствора соляной кислоты. Через несколько минут выделился белый порошкообразный осадок соли диазония в виде биполярного иона: (диазотированная сульфаниловая кислота).
Полученный продукт не отделяли, а использовали в виде взвеси. Он более устойчив, чем другие соли диазония, и может храниться несколько часов.
б) Азосочетание
В стакане растворили 2,33 г едкого натра в 40 см3 воды, в полученный раствор внесли 4,21 г 2-нафтола и прилили при перемешивании взвесь диазотированной сульфаниловой кислоты. Перемешивание продолжали в течение 30 минут. Затем для уменьшения растворимости красителя прибавили 29,07 г хлористого натрия и оставили стоять стакан на льду 1 час, время от времени перемешивая смесь.
7 Схемы приборов и установок.
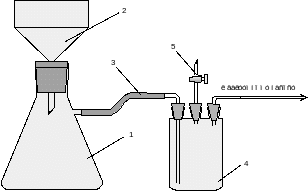
Рис. 1 – Прибор для вакуумного фильтрования.
1 – колба Бунзена, 2 – воронка Бюхнера, 3 – вакуумный шланг; 4 – предохранительная склянка (склянка Вульфа), 5 – воздушный кран.
8 Выделение и очистка сырого 2-нафтолоранжевого красителя
Выпавший оранжевого цвета краситель отфильтровали на приборе для вакуум-фильтрования (рис.1), промыли небольшим количеством холодной воды, плотно отжали на воронке, сняли с фильтра и сушили на воздухе. Определили массу полученного продукта: m(2-нафтолоранжевый)=11,56г
9 Подтверждение строения 2-нафтолоранжевого красителя

2-нафтолоранжевый краситель
10 Практический выход 2-нафтолоранжевого красителя
В результате синтеза 2-нафтолоранжевого красителя получили 8,5г вещества, что составляет от теоретического 70,18%.
mвых 2-метилоранжевого= 8,5г
mтеор ― 100%
mвых ― x %
x
=
 = 70,18%
= 70,18%
Выводы:
В результате синтеза 2-нафтолоранжевого красителя получили 8,5г вещества, что составляет от теоретического 70,18%.
Список использованных источников
1.Нечаев А.П. Органическая химия./ А.П. Нечаев, Т.В. Еременко- М. Высшая школа, 1985 – 463 с.
2.Гауптман, Грефе Ю., Ремане Х.. Органическая химия. – М. Химия. 1979. с.740-746.
3.Робертс Дж. Основы органической химии. Часть 2./Дж. Робертс, Ю.Г.Бундель, А.Н.Несмеянов – М., «Мир»-1978, с 660-696.
4.Рабинович В. А. Кратки химический справочник. Издание 2/В.А.Рабинович, З.Я.Хавин – С.-П.,1978,392с.
5. Синтезы. Методические указания к лабораторным занятиям по курсу «Органическая химия» для студентов всех технологических специальностей дневной и заочной форм обучения. (УИРС) /Могилевский государственный университет продовольствия; сост. Г.Н. Роганов, О.М. Баранов.- Могилев, 2006. -57с.
