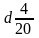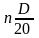- •Синтез 2-нафтолоранжевого красителя
- •1 Введение
- •3 Расчет количеств исходных веществ, необходимых для синтеза
- •3.1 Расчет основных исходных веществ
- •3.2 Расчет вспомогательных веществ
- •3.3 Таблица - Количества исходных веществ, применяемых в синтезе:
- •4 Теоретический выход 2-нафтолоранжевого красителя.
- •5 Ожидаемый выход 2-нафтолоранжевого красителя.
- •6 Описание хода синтеза
Министерство образования Республики Беларусь
Учреждение образования
Могилевский государственный университет продовольствия
Кафедра химической технологии высокомолекулярных соединений
Синтез 2-нафтолоранжевого красителя
Отчет по лабораторной работе № 1
по дисциплине «Органическая химия»
Специальность 1 - 49 01 02 «Технология и хранения и переработки животного сырья»
Специализация 1 – 49 01 02 01 «Технология мяса и мясных продуктов»
Проверил преподаватель _____________Н.И.Ильичева «___»_________2014г.
|
Выполнила: студентка группы ТЖМП-121 ___________М.И. Фонарикова «___»_________2014г.
|
Могилев 2014г
Цель работы
Получить 2-нафтолоранжевый краситель, исходя из 5 г сульфаниловой кислоты.
1 Введение
В основе технологии получения азокрасителей лежат две химические реакции:
1) диазотирование ароматического амина, 2) сочетание полученного диазосоединения с амином или фенолом
2-нафтолоранжевый краситель относится к группе красителей, молекула которых содержит -N=N-.Однако не всякое окрашенное вещество представляет собой краситель; последний помимо окраски должен обладать еще способностью поглощаться окрашиваемым волокном и прочно на нем закрепляться. Эту способность придают красителю так называемые ауксохромные группы, например гидроксильная группа, аминогруппа,сульфогруппа и некоторые другие.
Сейчас естественные красители полностью вытеснены синтетическими. Если раньше единственным потребителем органических красителей была текстильная промышленность, где красили почти исключительно хлопчатобумажные, шерстяные и хлопковые волокна, то сегодня органические красители применяют для крашения многих видов синтетических волокон, пластических масс, резины, бумаги, картона, дерева, кожи, меха и других материалов. Синтетические органические красители широко применяют в полиграфической, лакокрасочной, пищевой, фотокинопромышленности, а также медицине и других отраслях промышленности.
Области применения природных красителей всё больше и больше суживались, и в наши дни они ограничены лишь специальными областями, например, окрашивание некоторых продуктов питания.[1,4,5]
Диазосоединeния, содержат группировку N2, связанную с одним органическим остатком. Свойства алифатических и ароматических диазосоединений различаются очень резко.
Наиболее важны в практическом отношении соли диазония. Из-за низкой термической стабильности их обычно используют сразу после получения, не выделяя из растворов. Твердые соли диазония, у которых Х - остаток минеральной кислоты (например, HSO4-, NO3-, Сl-, СlO4-), неустойчивы и часто взрываются. Соли с анионами комплексных кислот (ZnCl3- и BF4-), а также с ArSO3-сравнительно устойчивы.
Щелочная соль цис-диазотата в твердом виде крайне неустойчива. В щелочном растворе при нагревании циc-диазотат превращается в транс-форму, щелочные соли которой стабильны; они бесцветны или окрашены в желтый цвет.
При недостаточной кислотности среды образуются т. н. диазосмолы, что часто является причиной низкого выхода и плохого качества фенолов и азокрасителей, получаемых в соответствующих производствах. Соли диазония в присутствии солей Cu (I) и некоторых других металлов легко замещают диазо-группу атомом галогена, а также группами CN, NCS, NO2, HS, RS, SO2H и др.
В
кислых средах при действии SnCl2
соли
диазония восстанавливаются в
арилгидразины:
![]() .
Под действием света соли
диазония разлагаются, причем особенно
легко, если в орто- и пара-положениях
находятся сильные электронодонорные
заместители; в результате фотолиза
выделяется N2,
происходит сужение кольца и образуются
высокомолекулярные соединения.
Алифатические диазосоединения
(диазоалканы) RR'CN2
(R,R' = Н, Alk). Эти соединения окрашены в
цвета от желтого до пурпурно-красного,
ядовиты. Низшие - взрывоопасные газы,
высшие - жидкие или твердые вещества,
более устойчивы. Алифатические
диазосоединения стабилизируются в
форме илида:
.
Под действием света соли
диазония разлагаются, причем особенно
легко, если в орто- и пара-положениях
находятся сильные электронодонорные
заместители; в результате фотолиза
выделяется N2,
происходит сужение кольца и образуются
высокомолекулярные соединения.
Алифатические диазосоединения
(диазоалканы) RR'CN2
(R,R' = Н, Alk). Эти соединения окрашены в
цвета от желтого до пурпурно-красного,
ядовиты. Низшие - взрывоопасные газы,
высшие - жидкие или твердые вещества,
более устойчивы. Алифатические
диазосоединения стабилизируются в
форме илида:
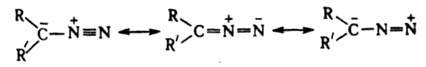 Диазоалканы
способны присоединять протон
и к-ты Льюиса, давая соли
диазония, которые легко разлагаются
с выделением N2
и образованием продуктов превращения
алкильного катиона.
Вступая в реакцию 1,3-биполярного
присоединения с алкенами,
диазоалканы дают производные пиразолина,
при фотолизе
из алифатических диазосоединений
образуются карбены.
Диазоалканы
способны присоединять протон
и к-ты Льюиса, давая соли
диазония, которые легко разлагаются
с выделением N2
и образованием продуктов превращения
алкильного катиона.
Вступая в реакцию 1,3-биполярного
присоединения с алкенами,
диазоалканы дают производные пиразолина,
при фотолизе
из алифатических диазосоединений
образуются карбены.
Диазотирование — взаимодействие ароматических аминов с HNO2 с образованием ароматического диазосоединения. Обычно при диазотировании пользуются NaNO2 в присутствии избытка неорганической кислоты:
R—NH2 + 2HCl + NaNO2 —> R—N2Cl + NaCl + 2H2O
где R — органический радикал.
Условия проведения диазотирования
Реакция диазотирования идет на холоду — как правило при температурах от 0 до 5 оС. При несоблюдении температурного режима может пойти образование побочных продуктов — диазосмол, а само диазосоединение будет разлагаться. Поскольку реакция с нитритом натрия протекает экзотермично, необходимо эффективное охлаждение смеси. В промышленности это осуществляется путем пропускания хладагента через змеевик внутри аппарата или загрузкой льда кусками, а в лаборатории — использованием бани со льдом и солью.[1,3]
Азосоединения содержат группировку –N=N- (азогруппа), связанную с двумя радикалами, в которых один или несколько атомов водорода замещены функциональными группами, например OH, NH2, CN В зависимости от характера радикала диазо- и азосоединения могут быть алифатического, ароматического или гетероциклического ряда. Наибольший интерес представляют ароматические диазо- и азосоединения благодаря разнообразному применению в промышленных синтезах. Простейшие незамещенные азосоединения:
Алифатические: азометанCH3N=NCH3,
Ароматические: азобензол C6H5N=NC6H5.
Большинство ароматических азосоединений термостабильно. Некоторые замещенные алифатические азосоединения разлагаются при 100-150°C с образованием N2 и свободных радикалов.
Диазосоединения существуют в нескольких формах:
[Ar–N≡N]Clˉ -соли диазония
[Ar–≡N]OHˉ -гидроксиды диазония
Ar–N=N–OH –диазогидраты
Ar–N=N–OMe –диазотаты
В кислых средах диазосоединения существуют в виде солей диазония, в щелочных – в виде диазотатов, а в средах, близких к нейтральной, – в виде изомерных гидроксидов диазония и диазогидратов.
Соли диазония весьма неустойчивы и уже при комнатной температуре разлагается с выделением азота. Эта неустойчивость и связанная с ней большая химическая активность позволяют использовать диазониевые соли для разнообразных синтезов.
Восстановление солей диазония приводит к соответствующим гидразинам, например:
[C6H5–N≡N] +Clˉ→ C6H5–NH–NH2+HCl
фенилдиазонийхлорид фенилгидразин
Восстановление ведут с помощью дихлорида олова или сульфида натрия.
Реакция азосочетания. Это основной способ получения азосоединений. Азосочетанием называется взаимодействие диазосоединений с ароматическими аминами и фенолами (нафтолами); оно приводит к образованию азокрасителей.
Реакция азосочетания является классическим примером электрофильного замещения в ароматических соединениях. Эффектным электрофилом в данном случае является катион диазония.
В реакции азосочетания участвуют два реагента: диазосоединение (обычно в форме соли диазония) и ароматический амин или фенол (нафтол).
Азосочетание фенолов проводят в слабощелочной среде (отрицательно заряженный кислород фенолят-аниона активирует ароматическое ядро сильнее, чем гидроксил самого фенола:

N≡N Cl- + H OH + NaOH →
фенилдиазонийхлоридфенол
→ N≡N– OH +NaCl + H2O
n-оксиазобензол
Первичные и вторичные ароматические амины сочетаются с солями диазония в нейтральных или слабокислых средах по атому азота, образуя диазоаминосоединения (1,3-диарилтриазены), которые при подкислении перегруппировываются в аминоазосоединения.[1]
Третичные ароматические амины сочетаются с солями диазония в кислых средах.
Чем выше кислотность, тем больше доля амина, существующего в виде иона, и тем ниже скорость сочетания.
Фенол обладает заметно кислыми свойствами, и в водном растворе он существует в равновесии с фенолят-ионом.
Чем выше кислотность среды, тем больше содержание фенола, находящегося в неионизированном состоянии, и тем ниже скорость сочетания. Таким образом, для реакции сочетания аминов или фенолов благоприятна низкая кислотность среды.
Условия, при которых наиболее быстро происходит реакция сочетания, являются компромиссными: раствор должен быть не слишком щелочным, чтобы концентрация диазоний-иона не стала слишком низкой, но и не должен быть слишком кислым, чтобы концентрация свободного амина или фенолят-иона не стала слишком низкой. Оказывается, что амины быстрее всего сочетаются в слабокислых средах, а фенолы – в слабощелочных.
Активность азосоставляющих в реакциях азосочетания увеличивается с увеличением электронной плотности бензольного ядра.
Азокрасители — органические соединения, содержащие одну или несколько азогрупп, например, конго красный, метиловый оранжевый, β-нафтолоранж и другие.
По современным представлениям окраска органических соединений связана с наличием в их молекуле особых группировок, получивших название хромофорных групп или хромофоров. Характерная структурная особенность хромофоров – наличие у них группировок, содержащих двойные связи. К этим группам относятся:
-N=N- >C=O>N=O>C=C<
азогруппоксогруппанитрозогруппаэтинил
Некоторые из них являются сильными хромофорами (азогруппа), другие – очень слабыми (оксогруппа).
Для превращения окрашенного вещества в краситель в его молекулу вводят специальные группировки – ауксохромы. Эти группы не только увеличивают интенсивность окраски, но и обуславливают сродство окрашенного вещества к материалу.
Окраска некоторых азокрасителей способна сильно изменяться в зависимости от pH среды. Такие азокрасители применяются в качестве индикаторов. Одним из наиболее популярных индикаторов является метиловый оранжевый (гелиантин), получающийся при сочетании диазобензолсульфокислоты (диазосоставляющей) с диметиланилином (азосоставляющей). В щелочной и нейтральной средах гелиантин имеет желтый цвет, в кислой среде он приобретает розово-красную окраску. Изменение окраски вызывается изменением хромофора. В нейтральной и щелочной среде хромофором является азогруппа -N=N-, в кислой возникает новый хромофор – хиноидное ядро.[3,4]
Ледяное крашение. Красящие вещества, применяемые в этом способе, образуются из своих составных частей непосредственно на волокне. Крашение ведется в два приема. Сперва ткань пропитывается раствором одной из составных частей, сушится и затем пропускается через раствор другого химического соединения, которое дает с веществом на ткани нерастворимую, прочно закрепляющуюся краску. Этот способ крашения получил название ледяного, или холодного, так как второй раствор содержит химическое соединение, разлагающееся даже при обыкновенной температуре, и для его сохранения требуется постоянное охлаждение льдом. Ледяное крашение применяется почти на всех красильных фабриках для получения ярких красных, бордовых, коричневых и др. оттенков.[1,4]
2 Синтез 2-нафтолоранжевого красителя
2.1 Основные реакции синтеза:
а) Диазотирование
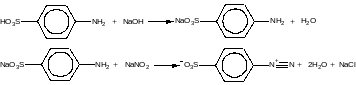
б) Азосочетание
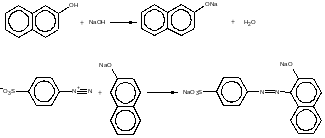
2.2 Свойства 2-нафтолоранжевого красителя:
Молекулярная масса – 350 г/моль
2.3 Таблица - Свойства основных исходных соединений
Формула |
Молекулярная масса, г/моль |
tпл. С |
tкип С |
|
|
Растворимость |
|
в воде |
в органических растворителях |
||||||
NH2C6H4SO2OH |
173,2 |
288 |
разл. |
1,4850 |
1,4850 |
6,7 |
М.р.,Эт,Раф |
NaNО2 |
68,99 |
271 |
разл. |
2,17 |
100 |
82,9 |
жид.NH2,Эт,Хлф |
C10H7OH |
144,17 |
23 |
286 |
1,2800 |
- |
0,074 |
Эт,Эф,Хлф,Р |