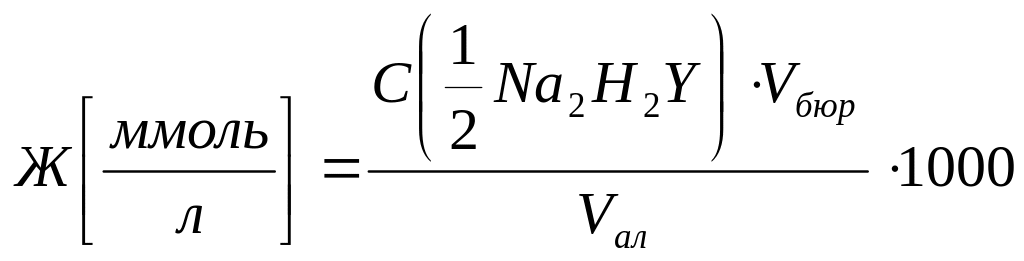- •Методические указания к лабораторным работам по общей химии Требования к оформлению отчетов по лабораторным работам.
- •Тема: «Правила работы в химической лаборатории. Техника безопасности»
- •Тема «Химический эквивалент. Закон эквивалентов»
- •Реакции ионного обмена
- •Окислительно-восстановительные реакции
- •Обучающие задачи
- •Задачи (сарс)
- •Занятие № 2. Растворы. Способы выражения состава растворов.
- •Приготовление растворов (обучающие задачи).
- •Лабораторная работа № 1. «Приготовление раствора с заданной массовой долей NaCl путем разбавления концентрированного раствора. Измерение плотности раствора при помощи ареометра».
- •Последовательность выполнения работы
- •1.2 Дополнительное задание
- •Расчетные формулы
- •Вопросы
- •Задачи (сарс)
- •Тема «Объемный (титриметрический) анализ. Титрование кислотами и основаниями (Метод нейтрализации)»
- •1. Особенности метода объемного анализа
- •2. Классификация методов объемного анализа.
- •3. Приготовление стандартных растворов.
- •4. Метод нейтрализации.
- •Индикаторы для кислотно-основного титрования
- •Химическая посуда и правила ее пользования
- •Лабораторная работа №2. «Метод нейтрализации в объемном анализе. Кислотно-основное титрование».
- •2.1 Титриметрическое определение серной кислоты в растворе (алкалиметрия)
- •Последовательность выполнения работы.
- •Внимание! Если бюретка течет – обратитесь к лаборанту.
- •Результаты алкалиметрического анализа раствора серной кислоты
- •2.2 Титриметрическое определение раствора соды (ацидиметрия).
- •Титриметрические реакции:
- •Последовательность выполнения работы.
- •Результаты ацидиметрического анализа разбавленного раствора соды
- •Задачи (сарс)
- •Занятие 4. Коллигативные свойства растворов электролитов и неэлектролитов. Тема «Коллигативные свойства растворов»
- •Основные коллигативные законы.
- •Расчёт понижения температуры замерзания раствора вещества а проводят по формуле:
- •III. Закон Рауля.
- •Лабораторная работа №3 «Гемолиз эритроцитов»
- •Гемолиз эритроцитов
- •Задачи (сарс)
- •Занятие 5. Свойства растворов электролитов (кислотно-основные свойства). Равновесие в растворах электролитов, гидролиз солей. Тема «Растворы электролитов»
- •3) Гетерогенное равновесие осадок малорастворимых основания или соли – насыщенный раствор этого соединения.
- •1.1. Равновесия процессов диссоциации сильных и слабых электролитов
- •1.2. Активность, коэффициент активности, ионная сила раствора.
- •1.3. Расчёт концентраций ионов и недиссоциированных молекул в растворах
- •1.4. Обучающие задачи
- •Тема «Гидролиз солей»
- •Обучающие задачи
- •Задачи (сарс)
- •Занятие 6. Сопряженные кислотно-основные пары. Буферные системы. Теоретические аспекты.
- •II. Особенности равновесий в буферных растворах и механизм буферного действия.
- •III. Расчёт рН буферного раствора и область его буферного действия.
- •IV. Способы приготовления буферных растворов с заданным значением рН.
- •V. Расчёт изменения рН при добавлении к фосфатному буферному раствору небольших добавок сильной кислоты или щёлочи, а также при его разбавлении.
- •VI. Буферная ёмкость – мера устойчивости буферного раствора.
- •Обучающие задачи
- •Лабораторная работа №4 «Приготовление буферного раствора заданного состава и исследование его свойств»
- •Задачи (сарс)
- •Занятие 7. Комплексные соединения в растворах.
- •Обучающие задачи.
- •Лабораторная работа №5 «Определение общей жесткости воды (комплексонометрия)»
- •Методика проведения эксперимента
- •Комплексонометрическое определение жесткости воды
- •Задачи (сарс)
- •Лабораторная работа №6 Гетерогенное равновесие в растворах электролитов. Произведение растворимости.
- •Задачи (сарс)
- •Занятие 9. Окислительно-восстановительные реакции. Потенциалы.
- •Лабораторная работа №7. «Перманганатометрия. Определение пероксида водорода в растворе».
- •Особенности реактива
- •Определение пероксида водорода
- •Сущность метода
- •Порядок выполнения работы
- •Примечание
- •Перманганатометрическое определение пероксида водорода (в растворе).
- •Задачи (сарс) Уравнять методом полуреакций в электронно-ионном виде:
- •Занятие 10. Основы химической термодинамики.Энергетика химических реакций.
- •Порядок выполнения работы
- •Задачи (сарс)
- •Занятие 12. Итоговое занятие. Защита отчетов по лабораторным работам.
Обучающие задачи.
1. Выбрать наиболее прочное комплексное соединение из соединений Fe2+ с биолигандами: глицерином (1), гистидином (2), лизином (3).
Решение: прочность комплекса характеризуется Кнест: чем меньше Кнест, тем более прочный комплекс.
Из справочника: Кнест(1)=1,58·10-8
Кнест(2)=5,01·10-10
Кнест(3)=3,16·10-5
Ответ: наиболее прочное комплексное соединение Fe2+ c гистидином, т.к. Кнест(2)‹ Кнест(1)‹ Кнест(3).
2. Вычислить концентрацию ионов Zn2+ в растворе Na2[Zn(CN)4] с концентрацией 0,3 моль/л при избытке цианид-ионов, равном 0,01 моль/л.
Решение: вторичная диссоциация комплексного иона протекает по уравнению:
[Zn(CN)4]2- ↔ Zn2+ + 4CN-
Кнест=![]() (справочная величина)
(справочная величина)
![]()
Ответ: [Zn2+] в растворе тетрацианоцинката (II) натрия составляет 7,2·10-3.
Лабораторная работа №5 «Определение общей жесткости воды (комплексонометрия)»
Комплексонометрия – метод объемного анализа, в основе которого лежат реакции комплексообразования. В качестве рабочего раствора (титранта) используется раствор хелатообразующего лиганда – комплексона, который в присутствии аммиачной буферной смеси образует с катионами металлов комплексные соединения.. Самый распространенный комплексон, который используется в аналитической практике – комплексон III, динатриевая соль этилендиаминтетрауксусной кислоты, условное обозначение Na2H2Y (см. лекционный материал), раствор которого называют трилон Б; реакционноспособная часть реагента - H2Y2-, в составе которой два донорных атома аминного азота и четыре карбоксильных группы. Дентатность такого лиганда равна шести, следовательно, взаимодействует он с ионами металлов в соотношении 1:1 независимо от валентности металла.
Определение общей жесткости воды, обусловленное присутствием в ней ионов Са2+ и Mg2+, основано на реакции: H2Y2- + Me2+(Ca2+,Mg2+) MeY2- + 2H+
Структура
комплексного иона - MeY2:: 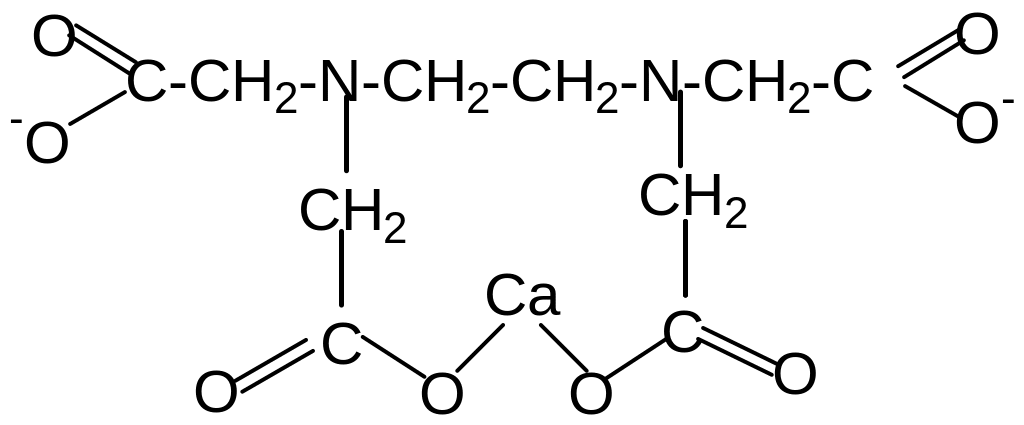
Очевидно, что образование хелата сопровождается обменной реакцией между двумя протонами двух карбоксильных групп на ион Ме2+, а также координацией по двум атомам азота (донорно-акцепторный механизм). Следовательно, число эквивалентности (Z) равно 2 как для трилона Б, так и для иона металла. Если проводить титрование в присутствии аммиачной буферной смеси, то подкисление раствора выделяемыми в результате реакции комплексообразования протонами Н+ наблюдаться не будет.
Титрование
исследуемого раствора выполняют в
присутствии аммонийного (аммиачного)
буферного раствора с рН 9,6. Точку конца
титрования (точку эквивалентности)
определяют с помощью металлоорганических
индикаторов (металлохромных индикаторов),
реакцию комплексообразования которых
с определяемыми катионами при тех же
условиях в общем виде можно представить
следующим образом:
![]() ;
;
в результате раствор приобретает вино-красное окрашивание, характерное для комплексного соединения ионов металла с индикатором. Однако комплексные соединения ионов металлов с индикатором, образующиеся в условиях эксперимента, менее устойчивые, чем комплексы с трилоном Б.
В точке эквивалентности комплексы металлов с индикатором разрушаются, т.к. образуются более устойчивые комплексы катионов металлов с трилоном Б, и индикатор выделяется в раствор, что приводит к резкому изменению окраски раствора: раствор приобретает окраску, характерную для свободного индикатора в интервале рН 9,0-10(сине-серую).
При определении жесткости воды используют индикатор эриохром черный – Т (ЭХЧ-Т) – это сложная трехосновная органическая кислота, которая в зависимости от рН раствора образует в растворе по-разному окрашенные ионы:
H3Ind H2Ind- HInd2- Ind3-
pH 6,3 6,3-11,2 >11,2
красный синий желтый
Жесткость воды (Ж) выражается количеством миллимоль – эквивалентов ионов кальция и магния в литре исследуемого раствора:
Жесткость (Ж)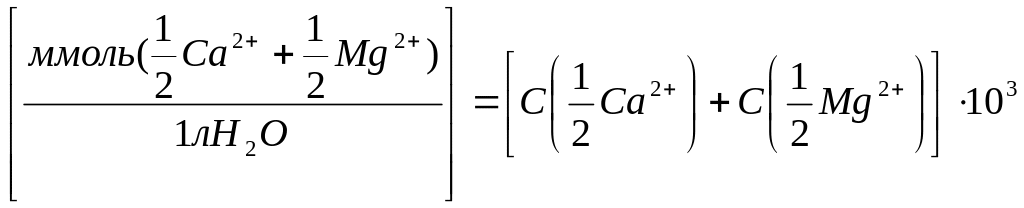
Санитарная норма - Ж<7 ммоль/л; мягкая вода - Ж<2 ммоль/л.
В точке эквивалентности
выполняется закон эквивалентов:
![]() ;
;
с учетом концентрации стандартного раствора и его объема израсходованного на титрование:
![]() ,
откуда
,
откуда