
- •Методические указания к лабораторным работам по общей химии Требования к оформлению отчетов по лабораторным работам.
- •Тема: «Правила работы в химической лаборатории. Техника безопасности»
- •Тема «Химический эквивалент. Закон эквивалентов»
- •Реакции ионного обмена
- •Окислительно-восстановительные реакции
- •Обучающие задачи
- •Задачи (сарс)
- •Занятие № 2. Растворы. Способы выражения состава растворов.
- •Приготовление растворов (обучающие задачи).
- •Лабораторная работа № 1. «Приготовление раствора с заданной массовой долей NaCl путем разбавления концентрированного раствора. Измерение плотности раствора при помощи ареометра».
- •Последовательность выполнения работы
- •1.2 Дополнительное задание
- •Расчетные формулы
- •Вопросы
- •Задачи (сарс)
- •Тема «Объемный (титриметрический) анализ. Титрование кислотами и основаниями (Метод нейтрализации)»
- •1. Особенности метода объемного анализа
- •2. Классификация методов объемного анализа.
- •3. Приготовление стандартных растворов.
- •4. Метод нейтрализации.
- •Индикаторы для кислотно-основного титрования
- •Химическая посуда и правила ее пользования
- •Лабораторная работа №2. «Метод нейтрализации в объемном анализе. Кислотно-основное титрование».
- •2.1 Титриметрическое определение серной кислоты в растворе (алкалиметрия)
- •Последовательность выполнения работы.
- •Внимание! Если бюретка течет – обратитесь к лаборанту.
- •Результаты алкалиметрического анализа раствора серной кислоты
- •2.2 Титриметрическое определение раствора соды (ацидиметрия).
- •Титриметрические реакции:
- •Последовательность выполнения работы.
- •Результаты ацидиметрического анализа разбавленного раствора соды
- •Задачи (сарс)
- •Занятие 4. Коллигативные свойства растворов электролитов и неэлектролитов. Тема «Коллигативные свойства растворов»
- •Основные коллигативные законы.
- •Расчёт понижения температуры замерзания раствора вещества а проводят по формуле:
- •III. Закон Рауля.
- •Лабораторная работа №3 «Гемолиз эритроцитов»
- •Гемолиз эритроцитов
- •Задачи (сарс)
- •Занятие 5. Свойства растворов электролитов (кислотно-основные свойства). Равновесие в растворах электролитов, гидролиз солей. Тема «Растворы электролитов»
- •3) Гетерогенное равновесие осадок малорастворимых основания или соли – насыщенный раствор этого соединения.
- •1.1. Равновесия процессов диссоциации сильных и слабых электролитов
- •1.2. Активность, коэффициент активности, ионная сила раствора.
- •1.3. Расчёт концентраций ионов и недиссоциированных молекул в растворах
- •1.4. Обучающие задачи
- •Тема «Гидролиз солей»
- •Обучающие задачи
- •Задачи (сарс)
- •Занятие 6. Сопряженные кислотно-основные пары. Буферные системы. Теоретические аспекты.
- •II. Особенности равновесий в буферных растворах и механизм буферного действия.
- •III. Расчёт рН буферного раствора и область его буферного действия.
- •IV. Способы приготовления буферных растворов с заданным значением рН.
- •V. Расчёт изменения рН при добавлении к фосфатному буферному раствору небольших добавок сильной кислоты или щёлочи, а также при его разбавлении.
- •VI. Буферная ёмкость – мера устойчивости буферного раствора.
- •Обучающие задачи
- •Лабораторная работа №4 «Приготовление буферного раствора заданного состава и исследование его свойств»
- •Задачи (сарс)
- •Занятие 7. Комплексные соединения в растворах.
- •Обучающие задачи.
- •Лабораторная работа №5 «Определение общей жесткости воды (комплексонометрия)»
- •Методика проведения эксперимента
- •Комплексонометрическое определение жесткости воды
- •Задачи (сарс)
- •Лабораторная работа №6 Гетерогенное равновесие в растворах электролитов. Произведение растворимости.
- •Задачи (сарс)
- •Занятие 9. Окислительно-восстановительные реакции. Потенциалы.
- •Лабораторная работа №7. «Перманганатометрия. Определение пероксида водорода в растворе».
- •Особенности реактива
- •Определение пероксида водорода
- •Сущность метода
- •Порядок выполнения работы
- •Примечание
- •Перманганатометрическое определение пероксида водорода (в растворе).
- •Задачи (сарс) Уравнять методом полуреакций в электронно-ионном виде:
- •Занятие 10. Основы химической термодинамики.Энергетика химических реакций.
- •Порядок выполнения работы
- •Задачи (сарс)
- •Занятие 12. Итоговое занятие. Защита отчетов по лабораторным работам.
Обучающие задачи
Задача 1. Оценить щелочной резерв крови, который определяют гидрокарбонатная и фосфатная буферные системы, если рНкровь = 7,40 ± 0,04 и Т = 370С = 310 К.
Решение:
а) Гидрокарбонатная буферная система:
рассчитаем отношение [HCO3-] / [H2CO3] на основе уравнения (3)
pНкровь = рК1*(Н2СО3 / человек) + lg ([HCO3-] / [H2CO3]) или
7,4 = 6,1 + lg ([HCO3-] / [H2CO3]), откуда
[HCO3-] / [H2CO3] = 107,4-6,1 = 101,3 = 19,95 » 20/1.
б) фосфатная буферная система: аналогично получаем
pНкровь = рК2*(Н3РО4 / человек) + lg ([HPO42-] / [H2PO4-]) или
7,4 = 6,8 + lg ([HPO42-] / [H2PO4-]), откуда
[HPO42-] / [H2PO4-] = 107,4-6,8 = 100,6 = 3,98 » 4/1.
В обоих случаях содержание компонента, выполняющего роль основания, значительно превышает содержание сопряжённой кислоты и, следовательно, эти буферные системы имеют буферную ёмкость по кислоте больше, чем по щёлочи. Это отвечает особенностям обмена веществ в организме человека.
Задача 2. Определить рН ацетатного буферного раствора, приготовленного из 100 мл 0,1М раствора НAс и 200 мл 0,2М раствора NaAc. Как изменится рН при добавлении к нему 30 мл 0,2М раствора NaOH ?
Решение:
а) Рассчитаем количество компонентов в буферном растворе:
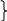 nк(буф.)
(НАс) = 0,1 ×
0,1 = 0,01 моль
nк(буф.)
(НАс) = 0,1 ×
0,1 = 0,01 моль
n0(буф.) (NaAc) = 0,2 × 0,2 = 0,04 моль , подставляем в уравнение Г-Х:
рН= рК (НАс) + lg (n0/nк) = 4,75 + lg (0,04/0,01) = 5,35
б) Рассчитаем число моль ионов ОН, - внесённых с добавкой щелочи:
n (ОН-) = С(NaOH) × Vдоб.[л] = 0,2 × 0,03 = 0,006 моль.
В результате связывания ионов ОН- кислотой НАс происходит, согласно (2), изменение количеств сопряжённых кислоты и основания в буферном растворе:
n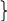 к¢(НАс)
= 0,01 – 0,006 = 0,004моль
к¢(НАс)
= 0,01 – 0,006 = 0,004моль
n0¢(NaAc) = 0,04 + 0,006 = 0,046 моль , подставляем в уравнение Г-Х:
рН = 4,75 + lg (0,046/0,004) = 5,8
Задача 3. Необходимо приготовить буферный раствор с рН = 4,3. В нашем распоряжении имеются муравьиная и угольная кислоты, гидроксид натрия. Какие вещества и в каких молярных соотношениях следует смешать для приготовления нужного раствора?
Анализ: формиатный буфер.
Решение:
а) Проведём анализ возможных буферных систем, которые можно приготовить на основе указанных в задаче веществ:
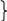 Формиатный
НСООН рК = 3,75 Þ
обл. буф. действия рН = от 2,75 до 4,75
Формиатный
НСООН рК = 3,75 Þ
обл. буф. действия рН = от 2,75 до 4,75
буфер НСООNa
Г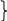 идрокарбонатный
Н2СО3 рК1
= 6,37 Þ
рН = от 5,37 до 7,37
идрокарбонатный
Н2СО3 рК1
= 6,37 Þ
рН = от 5,37 до 7,37
буфер NaHCO3
Карбонатный NaHCO3 рК2 = 10,32 Þ рН = от 9,32 до 11,32
буфер Na2CO3
Величина рН требуемого буферного раствора лежит в области буферного действия формиатного буфера, поэтому для его приготовления необходимо взять муравьиную кислоту и гидроксид натрия.
б) Требуемый буферный раствор готовят методом частичной нейтрализации муравьиной кислоты гидроксидом натрия.

где nк – количество кислоты в исходном растворе, х – количество добавленного NaOH, приводящее к формиатному буферному раствору с рН = 4,3. Дальнейший расчёт ведём по уравнению Г-Х:
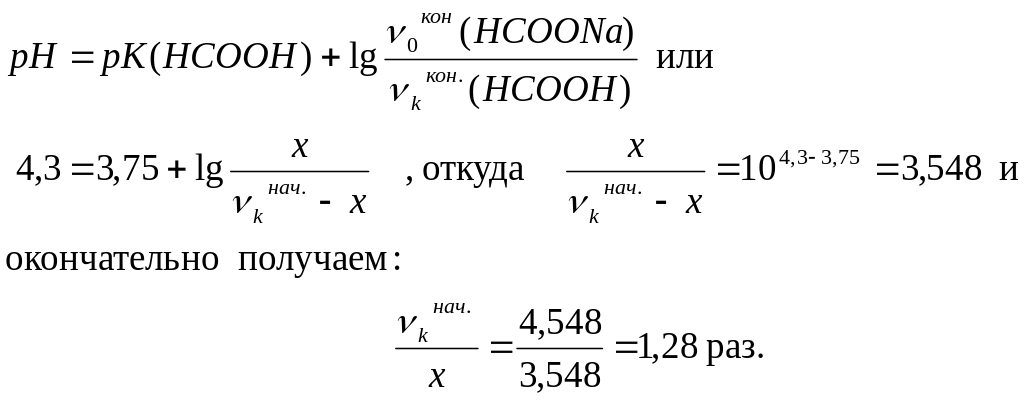
Таким образом, для приготовления буферного раствора с рН = 4,3 необходимое количество муравьиной кислоты должно превышать необходимое количество гидроксида натрия в 1,28 раза.
