
- •Методические указания к лабораторным работам по общей химии Требования к оформлению отчетов по лабораторным работам.
- •Тема: «Правила работы в химической лаборатории. Техника безопасности»
- •Тема «Химический эквивалент. Закон эквивалентов»
- •Реакции ионного обмена
- •Окислительно-восстановительные реакции
- •Обучающие задачи
- •Задачи (сарс)
- •Занятие № 2. Растворы. Способы выражения состава растворов.
- •Приготовление растворов (обучающие задачи).
- •Лабораторная работа № 1. «Приготовление раствора с заданной массовой долей NaCl путем разбавления концентрированного раствора. Измерение плотности раствора при помощи ареометра».
- •Последовательность выполнения работы
- •1.2 Дополнительное задание
- •Расчетные формулы
- •Вопросы
- •Задачи (сарс)
- •Тема «Объемный (титриметрический) анализ. Титрование кислотами и основаниями (Метод нейтрализации)»
- •1. Особенности метода объемного анализа
- •2. Классификация методов объемного анализа.
- •3. Приготовление стандартных растворов.
- •4. Метод нейтрализации.
- •Индикаторы для кислотно-основного титрования
- •Химическая посуда и правила ее пользования
- •Лабораторная работа №2. «Метод нейтрализации в объемном анализе. Кислотно-основное титрование».
- •2.1 Титриметрическое определение серной кислоты в растворе (алкалиметрия)
- •Последовательность выполнения работы.
- •Внимание! Если бюретка течет – обратитесь к лаборанту.
- •Результаты алкалиметрического анализа раствора серной кислоты
- •2.2 Титриметрическое определение раствора соды (ацидиметрия).
- •Титриметрические реакции:
- •Последовательность выполнения работы.
- •Результаты ацидиметрического анализа разбавленного раствора соды
- •Задачи (сарс)
- •Занятие 4. Коллигативные свойства растворов электролитов и неэлектролитов. Тема «Коллигативные свойства растворов»
- •Основные коллигативные законы.
- •Расчёт понижения температуры замерзания раствора вещества а проводят по формуле:
- •III. Закон Рауля.
- •Лабораторная работа №3 «Гемолиз эритроцитов»
- •Гемолиз эритроцитов
- •Задачи (сарс)
- •Занятие 5. Свойства растворов электролитов (кислотно-основные свойства). Равновесие в растворах электролитов, гидролиз солей. Тема «Растворы электролитов»
- •3) Гетерогенное равновесие осадок малорастворимых основания или соли – насыщенный раствор этого соединения.
- •1.1. Равновесия процессов диссоциации сильных и слабых электролитов
- •1.2. Активность, коэффициент активности, ионная сила раствора.
- •1.3. Расчёт концентраций ионов и недиссоциированных молекул в растворах
- •1.4. Обучающие задачи
- •Тема «Гидролиз солей»
- •Обучающие задачи
- •Задачи (сарс)
- •Занятие 6. Сопряженные кислотно-основные пары. Буферные системы. Теоретические аспекты.
- •II. Особенности равновесий в буферных растворах и механизм буферного действия.
- •III. Расчёт рН буферного раствора и область его буферного действия.
- •IV. Способы приготовления буферных растворов с заданным значением рН.
- •V. Расчёт изменения рН при добавлении к фосфатному буферному раствору небольших добавок сильной кислоты или щёлочи, а также при его разбавлении.
- •VI. Буферная ёмкость – мера устойчивости буферного раствора.
- •Обучающие задачи
- •Лабораторная работа №4 «Приготовление буферного раствора заданного состава и исследование его свойств»
- •Задачи (сарс)
- •Занятие 7. Комплексные соединения в растворах.
- •Обучающие задачи.
- •Лабораторная работа №5 «Определение общей жесткости воды (комплексонометрия)»
- •Методика проведения эксперимента
- •Комплексонометрическое определение жесткости воды
- •Задачи (сарс)
- •Лабораторная работа №6 Гетерогенное равновесие в растворах электролитов. Произведение растворимости.
- •Задачи (сарс)
- •Занятие 9. Окислительно-восстановительные реакции. Потенциалы.
- •Лабораторная работа №7. «Перманганатометрия. Определение пероксида водорода в растворе».
- •Особенности реактива
- •Определение пероксида водорода
- •Сущность метода
- •Порядок выполнения работы
- •Примечание
- •Перманганатометрическое определение пероксида водорода (в растворе).
- •Задачи (сарс) Уравнять методом полуреакций в электронно-ионном виде:
- •Занятие 10. Основы химической термодинамики.Энергетика химических реакций.
- •Порядок выполнения работы
- •Задачи (сарс)
- •Занятие 12. Итоговое занятие. Защита отчетов по лабораторным работам.
1.4. Обучающие задачи
1. Вычислить ионную силу в растворе 0,1М сульфата натрия.
Решение:
Na2SO4→2Na+ + SO42-
c[![]() ]:
0,1 0,2 0,1
]:
0,1 0,2 0,1
![]()
Ответ: ионная сила 0,1М Na2SO4 равна 0,3М.
2. Вычислить концентрацию ионов ОН-, рОН и рН для 0,1М раствора аммиака (Кb=1,76·10-5).
Решение:
NH3 + H2O![]() NH4OH
NH4+
+ OH-
NH4OH
NH4+
+ OH-
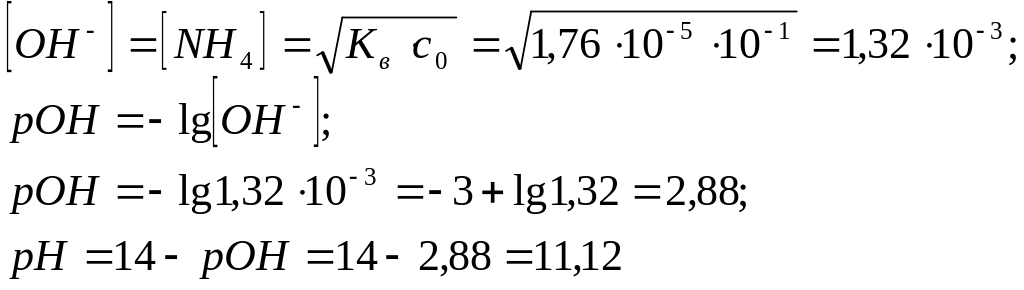
Ответ: [ОН-]=1,32·10-3; рОН=2,88; рН=11,12.
3. Константа диссоциации уксусной кислоты равна 1,75 10-5. Определите массу ацетата натрия, которую необходимо добавить к 300 мл 0,1 М раствора уксусной кислоты, чтобы понизить концентрацию ионов водорода в растворе в 100 раз.
Найдём равновесную концентрацию ионов водорода в 0,1М растворе CH3COOH:
[H+]
=[CH3COO-]
=
![]() = 1,32 ∙ 10-3 моль/л.
= 1,32 ∙ 10-3 моль/л.
При добавлении CH3COONa концентрация ионов H+ должна быть в 100 раз меньше (диссоциация частично подавлена), т.е. 1,32 ∙ 10-5 моль/л. Пусть необходимо внести в 1 л исходного раствора кислоты х моль соли, что соответствует добавке x моль ацетат ионов, тогда равновесные концентрации равны: [H+] = 1,3210-5 моль/л
[CH3COO-] = (x + 1,32 ∙ 10-5) моль/л x моль/л
[CH3COOH] = с0 – [H+] = 0.1 – 1.32 10-5 0,1 моль/л
и, подставив значения равновесных концентраций в выражение для константы диссоциации уксусной кислоты:
1,75 ∙ 10-5 = [H+] [CH3COO-] / [CH3COOH] = 1,32 ∙ 10-5 x / 0,1 , находим
x=0,133 моль, что соответствует концентрации соли с(CH3COONa)=0,133 моль/л.
Масса добавки ацетата натрия к 300 мл раствора равна:
m(CH3COONa) = с(CH3COONa) Vр-р M(CH3COONa) = 0,133 0,3 82 = 3,27 г.
Вычисление рН в водных растворах кислот и оснований.
В водных растворах кислот и оснований рН среды зависит от природы и концентрации растворенного вещества.
При вычислении рН раствора сильной кислоты или сильного основания необходимо знать молярную концентрацию сильной кислоты с0. Так как диссоциация сильной кислоты или сильного основания – процесс необратимый, то для расчетов рН используют следующие уравнения: рН=-lgc(H+)=-lgc0(HAn),
где с0(НAn) – молярная концентрация сильной одноосновной кислоты, моль/л.
Для серной кислоты: , рН=-lgc(H+)=-lg2c0(H2SO4).
Для сильного основания (щелочи): [OH-]=c0(KtOH),
где с0(KtOH) – молярная концентрация однокислотного основания, тогда [H+]= рН=14+lgco(KtOH).
В растворах с высокой ионной силой вместо концентрации ионов Н+ или ОН- используют их активности:
а(Н+)=с(Н+)·f(H+); a(OH-)=c(OH-)·f(OH-).
При вычислении рН раствора слабой кислоты или слабого основания необходимо знать молярную концентрацию этого вещества и константу его диссоциации (Ка или Кв).
Пусть НАс – слабая одноосновная кислота с молярной концентрацией с0 и степенью диссоциации :
НАс Н+ + Ас-
до диссоциации: с0 - -
при равновесии:
с0-
·с
![]()
Принимая во внимание
что
![]() ,
а равновесная концентрация Н+
,
а равновесная концентрация Н+
![]() ,
получаем:
,
получаем:
![]() рН=-lg[H+].
рН=-lg[H+].
В растворах слабых
оснований (NH4OH)
находят равновесную концентрацию ОН-:
![]() ,
после чего рассчитывают рН:
рН
,
после чего рассчитывают рН:
рН![]()
Слабые многоосновные кислоты диссоциируют обратимо и ступенчато. Каждая ступень диссоциации характеризуется своей константой диссоциации (Ка(I), Ka(II)…) и чем выше ступень, тем меньше константа диссоциации.
При расчете рН растворов слабых многоосновных кислот учитывают диссоциацию только по первой ступени.
