
- •Введение
- •Раздел 1. Хромопротеины
- •1.1. Гемопротеины
- •1.1.1. Гемоглобин (Нb)
- •Оксигенирование гемоглобина
- •Транспорт двуокиси углерода
- •Патологические производные гемоглобина
- •1.1.2. Миоглобин (Mb)
- •1.1.3. Ферментные гемопротеины
- •1.2. Обмен Fe-содержащих хромопротеинов
- •1.2.1. Экзогенный обмен (распад гемоглобина в желудочно-кишечном тракте)
- •1.2.2. Эндогенный обмен хромопротеинов (тканевый обмен)
- •1. Конъюгация билирубина с глюкуроновой кислотой
- •2. Транспорт коньюгированного билирубина из печени в желчь
- •Нарушение обмена Fe-содержащих хромопротеинов
- •Вопросы для самоподготовки
- •Тестовые задания для самоподготовки
- •Раздел II. Углеводы. Углевод-белковые комплексы
- •2.1. Структура биологически важных углеводов. Распространение в природе (в том числе в пищевом сырье)
- •2.1.1. Моносахариды (простые углеводы)
- •Классификация
- •2.1.2. Дисахариды
- •2.1.3. Полисахариды
- •Гомополисахариды. Представители, биологическое значение, распространение в природе
- •2.2. Гликопротеины и протеогликаны
- •2.2.1. Общие черты синтеза углеводной части гликопротеинов и протеогликанов
- •Особенности биосинтеза протеогликанов
- •2.2.2. Гликопротеины
- •Физико-химические свойства гликопротеинов
- •Биологическая роль гликопротеинов
- •2.2.3. Протеогликаны
- •Структура и биологическая роль отдельных представителей
- •Р ис.8. Схема строения протеогликана из хряща – «ершик».
- •Вопросы для самоподготовки
- •Тестовые задания для самоподготовки
- •Раздел III. Липиды. Липопротеины.
- •3.1. Липиды
- •Наиболее распространенные ненасыщенные (непредельные) жирные кислоты природных липидов
- •3.1.1. Классификация липидов
- •3.1.2. Простые липиды Триацилглицеролы (триглицериды, тг)
- •Жирные кислоты, входящие в состав восков
- •Стериды (или стероиды)
- •Простагландины
- •3.1.3. Сложные липиды
- •Глицерофосфолипиды (или фосфоглицериды)
- •Р ис.10 Схема амфифильной структуры фосфолипидов
- •Сфингофосфолипиды (сфингомиелины)
- •Гликолипиды (гликосфинголипиды)
- •Содержание ганглиозидов в тканях человека (концентрации выражены в нмолях липидосвязанной сиаловой кислоты – характерного компонента ганглиозидов на 1 г свежей ткани)
- •3.2. Липопротеины
- •3.2.1. Структурные липопротеины
- •3.2.2. Транспортные липопротеины
- •Плазмы крови в полиакриламидном геле
- •Липопротеидных частиц и их плотностью
- •3.2.3. Строение и состав липопротеинов
- •Представители аполипопротеинов
- •3.2.4. Образование и функции липопротеинов
- •3.2.5. Нарушения липидного обмена Гиперлипопротеинемии
- •Вопросы для самоподготовки
- •Тесты для самоподготовки
- •6. Установить соответствие:
- •15. Стерины находятся в крови обычно в форме:
- •Раздел IV. Нуклеиновые кислоты. Нуклеопротеины
- •4.1. Общая Характеристика нуклеиновых кислот
- •П роизводные нуклеотидов
- •4.2.3. Биологические функции нуклеотидов
- •4.3. Структура нуклеиновых кислот
- •4.3.1. Первичная структура.
- •4.3.2. Вторичная и третичная структуры днк
- •Третичная структура днк
- •4.3.3. Вторичная и третичная структура рнк
- •Р ис. 15. Вторичная структура тРнк
- •4.3.4. Физико-химические свойства нуклеиновых кислот
- •4.4.2. Распад нуклеопротеинов
- •Р ис.18. Схема переваривания нп в тонком кишечнике
- •Распад пуриновых оснований в тканях
- •Распад пиримидиновых азотистых оснований
- •4.5. Получение трансгенных растений
- •Вопросы для самоподготовки
- •Тесты для самоподготовки
- •7. Какие соединения являются дезоксирибонуклеозидтрифосфатами? а) дГдф в) удф д)дУдф
- •Терминологический словарь
- •Библиографический список
- •Оглавление
- •Раздел 1. Хромопротеины 4
- •Раздел II. Углеводы. 21
- •Раздел III. Липиды. Липопротеины. 53
- •Раздел IV. Нуклеиновые кислоты. Нуклеопротеины 83
1.2. Обмен Fe-содержащих хромопротеинов
Обмен Fe-содержащих хромопротеинов делят на:
экзогенный обмен – происходит в желудочно-кишечном тракте, включает распад Hb и других гемопротеинов, источником которых являются мясные продукты;
эндогенный обмен – происходит в тканях, включает синтез Hb и его распад
1.2.1. Экзогенный обмен (распад гемоглобина в желудочно-кишечном тракте)
 гем (Fe2+)
→ гемин (Fe3+)
гем (Fe2+)
→ гемин (Fe3+)
В желудке Hb
глобин → аминокислоты
Всасывание железа в кишечнике (около 1 мг в сутки)
Происходит при участии мало изученного белка (х), сходного с трансферрином. Затем железо поступает на трансферрин крови, который передает его ферритину, находящемуся в клетках разных органов (рис. 3).
 Рис.
3. Схема всасывания железа в кишечнике
Рис.
3. Схема всасывания железа в кишечнике
В соединении с белками железо находится в трехвалентном состоянии, но при переходе с одного белка на другой валентность каждый раз дважды меняется: Fe3+, Fe2+ и снова Fe3+. Этот процесс катализируется, по-видимому, специальными окислительно-восстановительными ферментами или самими белками-переносчиками. Например, церулоплазмин – медьсодержащий белок, присутствующий в плазме крови, необходим для освобождения железа из соединения с белком.
Ферритин – это крупный белок (молекулярная масса 450000). Он состоит из 24 идентичных протомеров, образующих полую сферу диаметром около 12 нм. В белковой оболочке имеется 6 каналов, ведущих в полость. Через эти каналы в полость проникают ионы железа, образуя железное ядро молекулы. Железо в ферритине находится в форме гидроксидфосфата примерного состава [(FeO ∙ OH)8 (FeO ∙ OPO3H2)].
Функция ферритина – депонирование железа (до 2,5 тыс. атомов железа).
Ферритин содержится во всех тканях, но больше всего в печени, селезенке и костном мозге. В ферритин поступает железо, как из кишечника, так и освобождающееся при распаде гемоглобина (эритроцитов) – это эндогенное железо. Железо из организма «выводится» при кровопотерях и ежедневно около 1 мг с желчью. Чтобы поступил 1 мг железа из кишечника, суточное потребление железа с пищей должно составлять 10–20 мг.
Избыток железа в клетках печени и селезенки может депонироваться в гемосидерине (водонерастворимом железосодержащем комплексе).
1.2.2. Эндогенный обмен хромопротеинов (тканевый обмен)
Биосинтез гемоглобина (гемопоэз)
В ретикулоцитах костного мозга, печени, почек, слизистой кишечника происходит координированный синтез - и -пептидных цепей гемоглобина, а также синтез его простетической группы – гема.
Предшественниками при синтезе гема являются глицин и сукцинил~коэнзимА. При действии δ-аминолевулинатсинтетазы из них образуется δ-аминолевулиновая кислота:

Затем происходит конденсация 2–х молекул δ-аминолевулиновой кислоты (фермент δ-аминолевулинатгидратаза):

Порфобилиноген
Далее путем конденсации 4-х молекул порфобилиногена образуется тетрапиррольное кольцо уропорфириногена, который затем модифицируется в ряде реакций в протопорфирин-IX. Последний при действии феррохелатазы присоединяет железо и превращается в гем.
Оба фермента, участвующие в синтезе порфобилиногена, являются регулируемыми ферментами: они ингибируются гемом и глобином. С другой стороны, синтез пептидных цепей глобина происходит только в присутствии гема, и образующиеся пептидные цепи тут же соединяются с гемом. При низкой концентрации гема активируется ингибитор инициации белкового синтеза в ретикулоцитах и синтез глобина замедляется.
Известны наследственные анемии, связанные с дефектами ферментов, участвующих в синтезе гема. Образующиеся избыточные количества окрашенных порфиринов – предшественников гема, которые выводятся с мочой (моча имеет красный цвет). Такие формы нарушения обмена гема называются порфирии. У больных отмечается чувствительность кожи к солнечному облучению вследствии фотосенсибилизации порфиринами.
В норме в сутки синтезируется 300 мг протопорфиринов (гемов) или 8–9 г гемоглобина.
Для гемопоэза необходимы: витамины В12, фолиевая кислота, аскорбиновая кислота, В6, В2, пангамовая кислота, В3, Fe, Со, Сu, Mn,.
Эндогенный распад гемоглобина.
Около 80% всего гема находится в гемоглобине, поэтому обмен гема прежде всего отражает состояние обмена гемоглобина. В крови взрослого человека – 2,5∙1013 эритроцитов. Примерно 95 % массы сухого вещества эритроцитов приходится на гемоглобин. Общее содержание Hb в крови – 13–16 г/100 мл. В процессе развития эритроциты утрачивают ядро, митохондрии, мРНК, рибосомы.
Продолжительность жизни эритроцита составляет 110–120 дней. Ежедневно (суточно) распадается 8–9 г гемоглобина (2∙1011 эритроцитов).
Состарившиеся эритроциты фагоцитируются макрофагами, главным образом в селезенке, а также в печени и костном мозге. Часть эритроцитов подвергаются гемолизу в крови, где освободившийся Hb связывается гаптоглобином крови и транспортируется к селезенке.
Гем повторно не используется в гемопоэзе. Он распадается с образованием железа и желчных пигментов. Железо реутилизируется (депонируется в ферритине), а желчные пигменты выводятся из организма.
Катаболизм гема, освобожденного из любых гемовых белков, осуществляется в микросомальной фракции ретикулоэндотелиальных клеток сложной ферментативной системой – гемоксигеназой (рис. 4). К моменту поступления гема из гемовых белков в гемоксигеназную систему железо обычно окисляется в ферри-форму (1) (гем Fe2+ гемин (Fe3+)). Гемин легко связывается с альбумином с образованием метгемальбумина. Гемин (Fe3+) восстанавливается в ферро-форму при участии НАДФН (2). Далее, при участии НАДФН кислород присоединяется к метенильному мостику (–СН=), расположенному между I и II пиррольными кольцами (3). Ферро-форма (Fe2+) снова окисляется в ферри-форму (Fe3+). При последующем присоединении кислорода происходит освобождение ферри-иона, выделение молекулы оксида углерода и образование в результате раскрытия тетрапиррольного кольца биливердина (пигмент зеленого цвета) (4). В этой реакции сам гем участвует в роли катализатора. На последней стадии биливердинредуктаза (НАДФН-зависимая) восстанавливает метенильный мостик между пирролами III и IV в метиленовую группу, в результате образуется желтый пигмент билирубин (брб).
Химическое превращение гема в билирубин можно наблюдать в местах ушиба. В гематоме обусловленный гемом пурпурный цвет медленно переходит в зеленый, а затем в желтый цвет билирубина.
Транспорт билирубина кровью. Из ретикулоэндотелиальных клеток билирубин поступает в кровь, адсорбируется на альбумине плазмы крови и переносится в клетки печени. Комплекс брб–альбумин получил название непрямого билирубина (нбрб), так как он не дает прямой реакции с диазореактивом при его количественном определении.
В крови здорового человека на долю нбрб приходиться 75% от общего брб.
На поверхности клеток печени происходит отделение брб от альбумина и при участии мембранного переносчика брб поглощается клетками печени для дальнейших процессов детоксикации.
Билирубин
(от желтого до красно-коричневого цвета
при нагревании чернеет)
Биливердин
(зеленого цвета)
Гемин
Метгемальбумин
(ферроформа)
Вердоглобин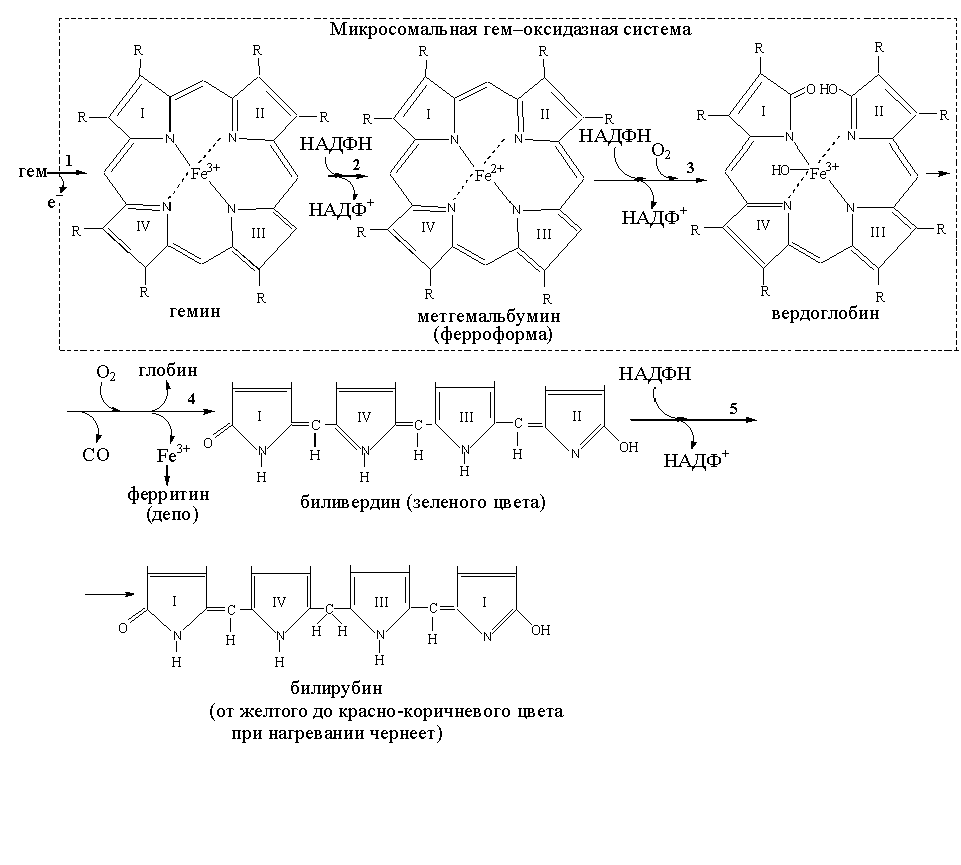

Рис.4. Распада гемоглобина в тканях
Последующие стадии метаболизма билирубина происходят в печени:
конъюгация билирубина в гладком эндоплазматическом ретикулуме (ЭПР);
секреция конъюгированного билирубина из ЭПР в желчь и кишечник.
Рассмотрим каждую стадию:
