
- •Введение
- •Раздел 1. Хромопротеины
- •1.1. Гемопротеины
- •1.1.1. Гемоглобин (Нb)
- •Оксигенирование гемоглобина
- •Транспорт двуокиси углерода
- •Патологические производные гемоглобина
- •1.1.2. Миоглобин (Mb)
- •1.1.3. Ферментные гемопротеины
- •1.2. Обмен Fe-содержащих хромопротеинов
- •1.2.1. Экзогенный обмен (распад гемоглобина в желудочно-кишечном тракте)
- •1.2.2. Эндогенный обмен хромопротеинов (тканевый обмен)
- •1. Конъюгация билирубина с глюкуроновой кислотой
- •2. Транспорт коньюгированного билирубина из печени в желчь
- •Нарушение обмена Fe-содержащих хромопротеинов
- •Вопросы для самоподготовки
- •Тестовые задания для самоподготовки
- •Раздел II. Углеводы. Углевод-белковые комплексы
- •2.1. Структура биологически важных углеводов. Распространение в природе (в том числе в пищевом сырье)
- •2.1.1. Моносахариды (простые углеводы)
- •Классификация
- •2.1.2. Дисахариды
- •2.1.3. Полисахариды
- •Гомополисахариды. Представители, биологическое значение, распространение в природе
- •2.2. Гликопротеины и протеогликаны
- •2.2.1. Общие черты синтеза углеводной части гликопротеинов и протеогликанов
- •Особенности биосинтеза протеогликанов
- •2.2.2. Гликопротеины
- •Физико-химические свойства гликопротеинов
- •Биологическая роль гликопротеинов
- •2.2.3. Протеогликаны
- •Структура и биологическая роль отдельных представителей
- •Р ис.8. Схема строения протеогликана из хряща – «ершик».
- •Вопросы для самоподготовки
- •Тестовые задания для самоподготовки
- •Раздел III. Липиды. Липопротеины.
- •3.1. Липиды
- •Наиболее распространенные ненасыщенные (непредельные) жирные кислоты природных липидов
- •3.1.1. Классификация липидов
- •3.1.2. Простые липиды Триацилглицеролы (триглицериды, тг)
- •Жирные кислоты, входящие в состав восков
- •Стериды (или стероиды)
- •Простагландины
- •3.1.3. Сложные липиды
- •Глицерофосфолипиды (или фосфоглицериды)
- •Р ис.10 Схема амфифильной структуры фосфолипидов
- •Сфингофосфолипиды (сфингомиелины)
- •Гликолипиды (гликосфинголипиды)
- •Содержание ганглиозидов в тканях человека (концентрации выражены в нмолях липидосвязанной сиаловой кислоты – характерного компонента ганглиозидов на 1 г свежей ткани)
- •3.2. Липопротеины
- •3.2.1. Структурные липопротеины
- •3.2.2. Транспортные липопротеины
- •Плазмы крови в полиакриламидном геле
- •Липопротеидных частиц и их плотностью
- •3.2.3. Строение и состав липопротеинов
- •Представители аполипопротеинов
- •3.2.4. Образование и функции липопротеинов
- •3.2.5. Нарушения липидного обмена Гиперлипопротеинемии
- •Вопросы для самоподготовки
- •Тесты для самоподготовки
- •6. Установить соответствие:
- •15. Стерины находятся в крови обычно в форме:
- •Раздел IV. Нуклеиновые кислоты. Нуклеопротеины
- •4.1. Общая Характеристика нуклеиновых кислот
- •П роизводные нуклеотидов
- •4.2.3. Биологические функции нуклеотидов
- •4.3. Структура нуклеиновых кислот
- •4.3.1. Первичная структура.
- •4.3.2. Вторичная и третичная структуры днк
- •Третичная структура днк
- •4.3.3. Вторичная и третичная структура рнк
- •Р ис. 15. Вторичная структура тРнк
- •4.3.4. Физико-химические свойства нуклеиновых кислот
- •4.4.2. Распад нуклеопротеинов
- •Р ис.18. Схема переваривания нп в тонком кишечнике
- •Распад пуриновых оснований в тканях
- •Распад пиримидиновых азотистых оснований
- •4.5. Получение трансгенных растений
- •Вопросы для самоподготовки
- •Тесты для самоподготовки
- •7. Какие соединения являются дезоксирибонуклеозидтрифосфатами? а) дГдф в) удф д)дУдф
- •Терминологический словарь
- •Библиографический список
- •Оглавление
- •Раздел 1. Хромопротеины 4
- •Раздел II. Углеводы. 21
- •Раздел III. Липиды. Липопротеины. 53
- •Раздел IV. Нуклеиновые кислоты. Нуклеопротеины 83
2.2. Гликопротеины и протеогликаны
Углевод-белковые комплексы данных сложных белков отличаются друг от друга по ряду признаков представленных в таблице 5:
Таблица 5
Отличия гликопротеинов и протеогликанов
Гликопротеины |
Протеогликаны |
Характер простетической группы |
|
Представлены: моносахаридами и олигосахаридами. Олигосахариды – это небольшие гетерополисахариды нерегулярного строения. Могут иметь разветвленную структуру, включать от 2-х до 10 (иногда более) мономеров Мономеры олигосахаридов представ- лены: глюкозой, галактозой, маннозой, фукозой, N-ацетилгалактозами- ном, N-ацетилглюкозамином, сиаловой кислотой (N-ацетилнейраминовая кислота) |
Представлены: гликозаминогликанами (старое название мукополисахариды). Это высокомолекулярные линейные гетерополисахариды,. Молекулярная масса колеблется от 105 до 4·106 Построены из повторяющихся дисахаридных единиц, которые чаще состоят из гексуроновой кислоты и галактозамина или N-ацетилпроизводного глюкозамина Реже встречаются фукоза, манноза и сиаловые кислоты |
Характер связи в углевод-белковом комплексе |
|
Связь прочная, ковалентная. Олигосахаридные цепи прочно (ковалентно) присоединены к полипептидной основе |
Гликозаминогликаны обычно ковалентно связаны с белками, но возможна и слабая (адсорбционная) связь |
Характер образования ковалентной связи в обеих группах имеет общие черты. Углеводная часть может быть связана с белком за счет гидроксильных групп серина или треонина – это «О»-гликозидная связь или за счет амидной группы аспарагина – это «N»-гликозидная связь |
|
Характер среды |
|
Нейтральный или слабокислый за счет присутствия сиаловых кислот |
Выраженный кислый характер за счет большого количества уроновых кислот и серной кислоты, имеют значительный отрицательный заряд |
Место нахождения |
|
Во всех органах, тканях и биологических жидкостях |
В основном находятся в межклеточном веществе соединительной ткани |
Белок составляет от массы молекулы |
|
80–90 % |
5–10 % |
Все моносахариды, входящие в состав протеогликанов и гликопротеинов синтезируются в организме из глюкозы.
2.2.1. Общие черты синтеза углеводной части гликопротеинов и протеогликанов
Синтез гетерополисахаридов происходит при участии гликозилтрансфераз. Донорами моносахаридных остатков служат нуклеотид сахара (например, уридиндифосфат~глюкоза – УДФ~глюкоза). «Активирование» моносахаридов осуществляется в цитозоле при участии соответствующих нуклеозидтрифосфатов. Образование УДФ ~ галактозы требует двух реакций:

 ..
..
Реакции гликозилирования протекают в просвете элементов комплекса Гольджи. Нуклеотидсахара (УДФ~галактоза, ГДФ~манноза, ЦМФ~нейраминовая кислота) поступают в цистерны аппарата Гольджи при участии систем-переносчиков по механизму антитранспорта в обмен на соответствующий нуклеотид: УМФ, ГМФ, ЦМФ. Например, УМФ образуется из УДФ~галактозы следующим образом:
Галактозил
трансфераза
Нуклеозидфосфатфосфатаза

Гликозилтрансферазы – это очень большая группа ферментов, с помощью которых образуются разнообразные гетерополисахариды. Каждый фермент строго специфичен и к донору моносахарида (например, УДФ~глюкоза, ГДФ~манноза, ЦМФ~нейраминовая кислота и др.), и к его акцептору (белку или растущей олигосахаридной цепи гликопротеина).
Не смотря на то, что синтез гетерополисахаридов не относится к матричным, результат получается сходным в том отношении, что образуются полимеры олигосахаридов не с произвольной, а со строго определенной последовательностью мономеров (моносахаридов и их производных – аминосахаров и ацетилированных гексозаминов).
Синтез углеводной части гликопротеинов, соединенной с белком «О»-гликозидной связью отличается от механизма синтеза олигосахаридов и гетерополисахаридов, присоединенных «N»-гликозидной связью.
При синтезе гликопротеинов и протеогликанов с «О»-гликозидной связью, ОН–группа серина или треонина белковой молекулы является основой, на которой постепенно наращиваются цепи гетерополисахаридов.
В случае синтеза гликопротеинов с «N»-гликозидной связью (основой является амидная группа аспарагина), участвует промежуточный носитель олигосахарида – долихолфосфат – вещество изопреноидной природы (Dol–p):
Остаток
фосфорной кислоты
Долихолфосфат
(n
= 17–20 единиц изопрена)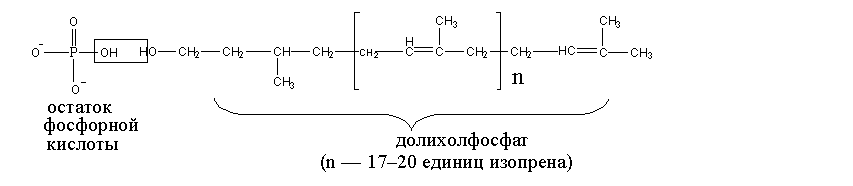
Гидрофобный конец долихолфосфата погружен в липидный слой мембраны аппарата Гольджи или эндоплазматического ретикулума (ЭПР), а на выступающем гидрофильном конце (остатке H3PO4) наращивается олигосахарид при действии специфических гликозилтрансфераз.
Образовавшийся олигосахарид из десятка и более моносахаридов целиком переносится с долихолфосфата на амидную группу аспарагина в составе полипептидной цепи белка. Затем происходит доработка (модификация) олигосахаридов. Реакция переноса катализируется мембраносвязанным ферментом олигосахарид-трансферазой. Данный фермент узнает и переносит любой углеводный фрагмент с общей структурой (R-(глюкоза-N-ацетил)-2-Р-Р-Dol. Затем гликозилирование белка происходит по остатку аспарагина трипептидной последовательности Асн–Х–Сер/Тир, где «Х» – любая аминокислота за исключением, вероятно, аспарагиновой кислоты и пролина (в структуре гликопротеинов). При этом предпочтительно используется трипептид, содержащийся в β-цепи (кросс β-форма). Лишь треть остатков аспарагина в белке реально подвергаются гликозилированию.
Долихолдифосфат (Dol–p-p) подвергается дефосфорилированию под действием фосфатазы. Долихол-Р может вновь служить акцептором для синтеза следующей молекулы олигосахарид–р-р–долихол.
Процессинг (или модификация) олигосахаридной цепи, связанной с белком включает ранние стадии, которые сводятся к удалению концевых одного или двух остатков глюкозы и, возможно, одного или четырех остатков маннозы при участии ферментов глюкозидазы-I, глюкозидазы-II, и различных маннозидаз. Очень важным завершением ранней стадии является реакция присоединения глюкозо-N-ацетил-1-фосфата к 6-му углеродному атому одного или нескольких специфических остатков маннозы. Реакция катализируется ферментом глюкозо-N-ацетил-фосфотрансферазой, использующей в качестве донора УДФ~глюкозо-N-ацетил. Образуются продукты: УМФ и глюкозо-N-ацетил-РО4–-6-манноза-белок. Этот новый концевой фрагмент олигосахарида в следующей реакции (фермент фосфодиэстераза) освобождается от глюкозо-N-ацетил, а остатки маннозы в 6-ом положении остаются фосфорилированными.
Рецепторы для маннозо-6-фосфата, локализованные в аппарате Гольджи, связывают маннозо-6-фосфат этих белков. Одна из функций маннозо-6-фосфата в аппарате Гольджи – распознавать и направлять ферменты лизосом к этим органеллам. При снижении активности глюкозо-N-ацетилфосфотрансферазы или отсутствии (молекулярная болезнь) в клетках накапливается множество различных видов недеградированных молекул гликопротеинов. В то же время в пробах сыворотки больных этой болезнью можно обнаружить высокую активность лизосомных ферментов. Это свидетельствует о том, что синтез ферментов происходит, но они не достигают предназначенных для них внутриклеточных органелл.
Поздняя стадия процессинга олигосахаридной цепи заключается в присоединении ко второй олигосахаридной цепи разветвленной структуры (биоантенной) второго глюкозо-N-ацетильного остатка (фермент глюкозо-N-ацетилтрансфераза II) и остатков фукозы, галактозы и сиаловой кислоты (N-ацетилнейраминовой) в различных положениях при участии ферментов фукозил-, галактозил- и сиалилтрансферазами.
Субклеточная локализация. Главными структурными компонентами клетки, участвующими в процессах синтеза белковой части и гликолизировании являются эндоплазматический ретикулум и аппарат Гольджи. Присоединение олигосахарида протекает в шероховатом эндоплазматическом ретикулуме во время и после синтеза белка. Удаление глюкозы и некоторых из периферийных остатков маннозы также происходит в ЭПР и затем переносятся в цистерну Гольджи для последующих реакций гликозилирования.
