
- •0Bхімія довкілля: колоїдна хімія
- •4BКонспект лекцій
- •45BЛекція 1 Колоїдний стан речовини
- •42B1.1 Дисперсні системи
- •43B1.1.1 Основні ознаки дисперсних систем
- •44B1.1 Дисперсні системи
- •1BКрайовий кут є мірою змочування. Він визначається як кут між твердою поверхнею і дотичною в точці дотику трьох фаз. Кут відраховується в бік рідкої фази.
- •5B5.2.3 Полімолекулярна сорбція
- •34B7.4 Теорія агрегативної стійкості та коагуляції ліофобних золів длфо
- •33B7.2 Коагуляція ліофобних золів електролітами
- •35B7.2.2 Спільна дія електролітів при коагуляції
- •36B7.3 Кінетика швидкої коагуляції
- •40BРисунок 7.7 - Залежність швидкості коагуляції від концентрації електроліту
- •37B7.4 Теорія агрегативної стійкості та коагуляції ліофобних золів длфо
- •38B7.5 Старіння золів
- •39B7.6 Захисна дія молекулярних адсорбуючих шарів
37B7.4 Теорія агрегативної стійкості та коагуляції ліофобних золів длфо
Сучасна фізична теорія коагуляції електролітами основана на загальних принципах статистичної фізики, теорії молекулярних сил і теорії розчинів. Її авторами є: Б.В. Дерягин, Л.Д. Ландау (1937-1941), Е. Фервей, Я. Овербек (за першими літерами скорочено - ДЛФО).
Сутність цієї теорії: між будь-якими частками при їх зближенні виникає розклинювальний тиск розподільного рідкого прошарку в результаті дії сил тяжіння і відштовхування.
Розклинювальний тиск є сумарним параметром, що враховує як дію сил тяжіння, так і сил відштовхування.
Стан системи залежить від балансу енергії тяжіння (Uтяж) й енергії відштовхування (Uвідшт).
Якщо переважає Uвідшт - система стійка.
Якщо переважає Uтяж - відбувається порушення агрегатної стійкості (коагуляція).
Потенційні криві графічно ілюструють зміну енергії взаємодії між двома частками при їх зближенні (рисунок 7.8).
Uвідшт

1
Uб
3



h


II

Uя
I
2
Uтяж
Рисунок 7.8 - Потенційні криві взаємодії колоїдних часток: 1 - зміна енергії відштовхування від зміни відстані; 2 - зміна енергії тяжіння; 3 - результуюча крива
Сумарну енергію системи з
двох часток (крива 3 на рисунку 7.8)
одержують сумуючи
![]() і
і
![]() :
:
![]() , (7.7)
, (7.7)
де:
![]() -
множник, що залежить від значень
електричних потенціалів ПЕШ, властивості
середовища, температури;
-
множник, що залежить від значень
електричних потенціалів ПЕШ, властивості
середовища, температури;
– основа натурального логарифма;
![]() – величина, зворотна товщині
дифузного шару;
– величина, зворотна товщині
дифузного шару;
– відстань між частками;
– константа молекулярних сил тяжіння.
Розглянемо результуючу криву 3 на рисунку 7.8. На ній є характерні ділянки:
- в області малих відстаней є глибокий первинний мінімум (потенційна яма) - значно переважає . Первинний мінімум відповідає безпосередньому злипанню часток ( на схемі ділянка I);
- в області великих відстаней - вторинний неглибокий мінімум (друга потенційна яма, відповідає тяжінню через прошарок середовища). На схемі - ділянка II;
- в області середніх відстаней
на кривій є максимум і, якщо він
розташований над віссю абсцис, то
з'являється енергетичний бар'єр сил
відштовхування (![]() ).
).
Результуюча крива 3, наведена на рисунку 7.8, може мати різний вигляд залежно від стійкості дисперсної системи.
Виділимо такі випадки:
- в системі при будь-якій відстані між частками переважає енергія тяжіння над енергією відштовхування.
В такій системі спостерігається швидка коагуляція з утворенням агрегатів;
- достатньо високий потенційний бар'єр і наявність вторинного мінімуму.
Частки взаємодіють, але не мають безпосереднього контакту і розділені прошарками середовища;
- система з високою агрегатною стійкістю (високий потенційний бар'єр і відсутність вторинного мінімуму або при його глибині, меншій за теплову енергію kТ).
Потенційні криві для різних станів стійкості дисперсної системи - швидка коагуляція; частки взаємодіють, але розділені прошарком середовища; висока агрегатна стійкість – наведено на рисунку 7.9).
Uвідшт

2
3


h
1
Uтяж
Рисунок 7.9 - Потенційні криві для різних станів стійкості дисперсної системи: 1 – швидка коагуляція; 2 – частки взаємодіють, але розділені прошарком середовища; 3 – висока агрегатна стійкість
Залежно від висоти енергетичного бар'єру і глибини потенційних ям можливі різні варіанти поводження часток при зближенні (рисунок 7.10), частки володіють кінетичною енергією - kТ.

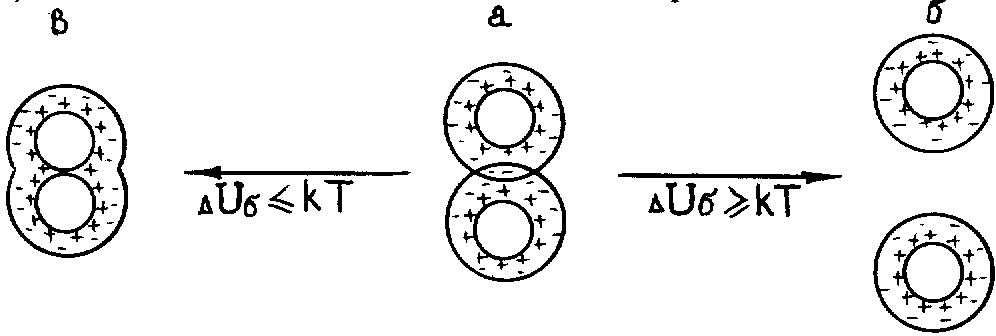
41Bв а б
Рисунок 7.10 - Схеми взаємодії колоїдних часток: а - Uб=(5-10)kT, UяkT; б - UбkT, UяkT; в - UбUяkT
Розглянемо елементи схеми, наведеної на рисунку 7.10:
- стан, якому відповідає рисунок 7.10в, характеризується малою висотою бар'єру і неглибоким вторинним мінімумом: UбUяkT. Частки вступають в ближню взаємодію, тобто безпосередньо контактують – наступає коагуляція;
- стан, якому відповідає рисунок 7.10а, характеризується тим, що перекриваються дифузні шари і зберігаються прошарки середовища між частками (гелі). Енергетичний бар'єр доволі високий [Uб=(5-10)kT], вторинний мінімум неглибокий: UяkT. Взаємодіючі частки не можуть розійтись (утримують сили тяжіння) і не можуть наблизитись впритул (перешкоджають сили відштовхування). Додавання електроліту частіше за все приводить до коагуляції (зменшується h);
- стан, якому відповідає рисунок 7.10б, характеризується високим енергетичним бар'єром UбkT і відсутністю або неглибоким вторинним мінімумом UяkT. Частки не можуть подолати бар'єр і розходяться без взаємодії. Така система агрегатно стійка.
Дисперсна система є агрегатно стійкою при високому енергетичному бар'єрі сил відштовхування.
