
- •0Bхімія довкілля: колоїдна хімія
- •4BКонспект лекцій
- •45BЛекція 1 Колоїдний стан речовини
- •42B1.1 Дисперсні системи
- •43B1.1.1 Основні ознаки дисперсних систем
- •44B1.1 Дисперсні системи
- •1BКрайовий кут є мірою змочування. Він визначається як кут між твердою поверхнею і дотичною в точці дотику трьох фаз. Кут відраховується в бік рідкої фази.
- •5B5.2.3 Полімолекулярна сорбція
- •34B7.4 Теорія агрегативної стійкості та коагуляції ліофобних золів длфо
- •33B7.2 Коагуляція ліофобних золів електролітами
- •35B7.2.2 Спільна дія електролітів при коагуляції
- •36B7.3 Кінетика швидкої коагуляції
- •40BРисунок 7.7 - Залежність швидкості коагуляції від концентрації електроліту
- •37B7.4 Теорія агрегативної стійкості та коагуляції ліофобних золів длфо
- •38B7.5 Старіння золів
- •39B7.6 Захисна дія молекулярних адсорбуючих шарів
5B5.2.3 Полімолекулярна сорбція
На практиці часто зустрічаються ізотерми, вигляд яких показано на рисунку 5.12.

Рисунок 5.12 - Ізотерма полімолекулярної сорбції
Такий вид ізотерм свідчить про те, що зв'язування адсорбтиву адсорбентом не припиняється після утворення мономолекулярного шару, тобто свідчить про полімолекулярну сорбцію.
Теорію полімолекулярної адсорбції запропонував Поляні (1915р.).
Вихідні положення цієї теорії:
- адсорбція зумовлена чисто фізичними силами;
- на поверхні адсорбенту нема активних центрів. Адсорбційні сили діють поблизу поверхні й утворюють біля цієї поверхні неперервне силове поле;
- адсорбційні сили діють на відносно великі відстані, завдяки чому біля поверхні адсорбенту утворюється адсорбційний об'єм (рисунок 5.13);
- дія адсорбційних сил по мірі віддалення від поверхні зменшується й на деякій відстані стає рівною нулю;
- тяжіння молекули адсорбтиву поверхнею не за лежить від наявності в адсорбційному просторі інших молекул;
- адсорбційні сили не залежать від температури, тобто зі зміною температури адсорбційний об'єм не змінюється;
- силове поле біля поверхні згідно цієї теорії порівнюють з гравітаційним полем.

Рисунок 5.13 - Схема адсорбційного об'єму
Залежно від умов адсорбції та природи адсорбенту й адсорбтиву застосовувана теорія Ленгмюра або Поляні. Узагальнена теорія була розвинена С.Брунауером, П.Емметом й Е.Теллером (1935-1940р.). Їхня теорія одержала назву БЕТ.
Основні положення теорії БЕТ:
- на поверхні адсорбенту є певна кількість рівноцінних в енергетичному відношенні центрів, здатних утримувати молекули адсорбтиву;
- допускається, що взаємодія між сполуками, адсорбованими молекулами, відсутня;
- кожна молекула першого шару є активним центром для адсорбції та утворення другого адсорбційного шару, і т.д.
- припускається, що усі молекули в другому та більш далеких шарах мають таку ж суму статичних станів як в рідкому стані, яка відрізняється від суми станів першого шару.
Схема полімолекулярної адсорбції, прийнята по теорії БЕТ, наведена на рисунку 5.14.

Рисунок 5.14 - Схема полімолекулярної адсорбції, прийнята по теорії БЕТ
На основі цих уявлень Брунауер, Еммет і Теллер запропонували рівняння ізотерми адсорбції парів:
 ,
(5.32)
,
(5.32)
де - тиск пари;
![]() - тиск насиченої пари при
даній температурі;
- тиск насиченої пари при
даній температурі;
![]() -
відносний тиск пари;
-
відносний тиск пари;
- константа рівноваги полімолекулярної сорбції.
При
далеких від
і С1,
адсорбція мономолекулярна й рівняння
БЕТ переходить у рівняння Ленгмюра.
По мірі наближення
до
число вільних активних центрів
скорочується. При
![]() відбувається об'ємна
конденсація пари. Рівняння БЕТ легко
приводиться до лінійної форми:
відбувається об'ємна
конденсація пари. Рівняння БЕТ легко
приводиться до лінійної форми:
 .
(5.33)
.
(5.33)
За нахилом прямої і відрізку,
який відсікається на осі ординат
знаходять
![]() і
.
і
.
Знайшовши
можна обчислити питому
поверхню адсорбенту
![]() ,
де
,
де![]() - площа, яку займає одна молекула;
- площа, яку займає одна молекула;
![]() - число Авогадро.
,
знайдене за допомогою теорії БЕТ,
співпадають зі значеннями, одержаними
не адсорбційними методами, що свідчить
про правильність теорії БЕТ.
- число Авогадро.
,
знайдене за допомогою теорії БЕТ,
співпадають зі значеннями, одержаними
не адсорбційними методами, що свідчить
про правильність теорії БЕТ.
5.3 Окремі випадки адсорбції
5.3.1 Адсорбція на межі рідина-газ
Через однорідність і гладкість поверхні будь-якої рідини, при вивченні адсорбції на її поверхні неприйнятні уявлення про активні центри (сорбція Ленгмюра). Очевидно, через рівноцінність усіх ділянок поверхні рідини і теплового руху її молекул неможна також говорити про яке-небудь закріплення молекул адсорбтиву у визначених місцях.
Доцільніше розглядати явища з термодинамічних позицій і пов'язувати адсорбцію розчинної речовини зі зміною вільної енергії поверхні або її поверхневого потенціалу.
Фактором інтенсивності поверхневої енергії є поверхневий натяг, обумовлений нескомпенсованим полем міжмолекулярних сил на міжфазній поверхні.
Поверхневий натяг є слідством існування внутрішнього тиску – сили, що втягує молекули всередину рідини і спрямованої перпендикулярно поверхні. Внутрішній тиск тим вище, чим більш полярна речовина, тому причиною його є дія молекулярних сил.
Для визначення поверхневого натягу на межі рідина-газ або рідина-пара застосовують метод капілярного підняття, зважування або підрахунку крапель, найбільшого тиску бульбашок, відриву кільця й ін.
При розгляді поверхневого натягу на межі рідина-газ або рідина-пара, внаслідок значної розрядженості газу або пари, взаємодією між молекулами рідини і газу або пари можна знехтувати. Цього неможна зробити у випадку поверхневого натягу на межі рідина-рідина. Наявність над першою рідиною шару іншої, такої, що не змішується з нею, рідини призводить до зниження міжфазного поверхневого натягу, оскільки молекули другої рідини притягують до себе молекули першої і, таким чином, зменшують дію нескомпенсованих сил на поверхні першої рідини.
5.3.2 Адсорбція на межі розчин-газ
На поверхневий натяг розчинів сильний вплив оказує адсорбція. Кількісно співвідношення між адсорбцією розчиненої речовини (в кмоль на 1м2 поверхні) і зміною поверхневого натягу ( ) з концентрацією розчину (кмоль/м3) визначається рівнянням Гіббса:
![]() .
(5.34)
.
(5.34)
З рівняння виходить, що при
![]() <
0
> 0, тобто відбувається накопичення
речовини в поверхневому шарі; при
<
0
> 0, тобто відбувається накопичення
речовини в поверхневому шарі; при
![]() >
0
<
0 - зменшення концентрації речовини в
поверхневому шарі (
- поверхнева активність).
>
0
<
0 - зменшення концентрації речовини в
поверхневому шарі (
- поверхнева активність).
Всі
розчинні речовини за їхньою здатністю
адсорбуватися на межі рідина-повітря
можна розділити на дві групи:
поверхнево-активні речовини (
> 0
![]() <
0); поверхнево-неактивні речовини (
< 0
<
0); поверхнево-неактивні речовини (
< 0
![]() >0).
>0).
Поверхнево-активні речовини здатні накопичуватись в поверхневому шарі. Вони мають володіти поверхневим натягом меншим за поверхневий натяг розчинника (інакше накопичення речовини на поверхні термодинамічно невигідно) і порівняно малою розчинністю (інакше вони б прагнули піти з поверхні в глиб розчину).
Залежність поверхневого натягу від концентрації розчину для поверхнево-активної, поверхнево-неактивної речовини і для речовини, що не впливає на поверхневий натяг розчинника, представлено на рисунку 5.15.

Рисунок 5.15 - Залежність поверхневого натягу від концентрації розчину: 1 - для поверхнево-активної речовини; 2 - для поверхнево-неактивної речовини; 3 – для речовини, що не впливає на поверхневий натяг розчинника
Характерною особливістю будови ПАР є їхня дифільність, тобто молекула складається з двох частин - полярної групи і неполярного вуглеводневого радикала.
Володіючи значним дипольним моментом і схильністю до гідратації полярна група (ОН, СООН, RН2) обумовлює спорідненість ПАР до води. Гідрофобний вуглеводневий радикал є причиною неповної розчинності цих сполук.

ПАР відносно води: жирні кислоти, солі жирних кислот, сульфокислоти та їхні солі, спирти, аміни.
Поверхнева активність і адсорбуємість залежать від природи полярної групи, будови молекули та довжини радикала ( СН3СООН - оцтова кислота розчинна; С5Н11СООН - капронова кислота - не розчинна).
Правило Дюкло-Траубе: в будь-якому гомологічному ряду, при малих концентраціях, подовження вуглеводневого ланцюга на СН2 групу, збільшує поверхневу активність в 3-3,5 раз.
Правило Дюкло-Траубе справедливо при вільному розташуванні адсорбованих молекул в поверхневому шарі паралельно поверхні (рисунок 5.16 б).

Рисунок 5.16 - Розташування молекул в поверхневому шарі: а - висока концентрація ПАР; б - мала концентрація ПАР
Для водних розчинів жирних кислот залежність поверхневого натягу від концентрації виражається емпіричним рівнянням Шишковського:
![]() ,
(5.35)
,
(5.35)
де
![]() і
- емпіричні
сталі.
і
- емпіричні
сталі.
При цьому постійна для всього гомологічного ряду, а - збільшується в 3-3,5 рази для кожного наступного члена згідно правила Дюкло-Траубе.
Застосування ПАР. навіть дуже незначні добавки цих речовин змінюють умови взаємодії тіл, що стикаються, і природу їхньої поверхні.
ПАР використовують: для полегшення руйнування, наприклад, при тонкому помелі речовин; при розпиленні рідин; для зменшення тертя між поверхнями; при пранні; в якості емульгаторів при виробництві косметичних і фармацевтичних препаратів.
5.3.3 Адсорбція на межі тверде тіло-розчин
Адсорбція з розчина на твердій поверхні важлива для колоїдної хімії, оскільки саме вона лежить в основі таких явищ як утворення і руйнування колоїдних розчинів, а також їх стійкості.
Адсорбція на межі тверде тіло-розчин ускладнюється наявністю третього компонента - середовища (розчинника), молекули якого можуть також адсорбуватися на поверхні адсорбенту і є конкурентами молекул адсорбтиву. Таким чином, відбувається адсорбція із суміші. Крім того, адсорбція ускладнюється взаємодією молекул адсорбтиву з молекулами середовища.
При адсорбції з розчину на твердому тілі прийнято розрізняти два випадки: адсорбція неелектролітів, коли адсорбуються молекули адсорбтива, і адсорбцію електролітів, коли вибірково адсорбується один з іонів електроліту.
5.3.3.1 Молекулярна адсорбція з розчинів
Адсорбуються молекули адсорбтива. Кількість речовини А (моль/г), молекулярно адсорбованої 1 г адсорбенту з розчина, обчислюють за рівнянням:
![]() ,
(5.36)
,
(5.36)
де
![]() - початкова і рівноважна концентрація
адсорбтиву, моль/л;
- початкова і рівноважна концентрація
адсорбтиву, моль/л;
- об'єм розчину, з якого відбувається адсорбція, л;
- маса адсорбенту, г.
Залежність молекулярної рівноважної адсорбції з розчину на твердому тілі від концентрації адсорбтива характеризується ізотермою адсорбції (рисунок 5.17).
На адсорбцію впливає природа середовища. Оскільки молекули адсорбтиву і середовища є конкурентами, то, очевидно, чим гірше буде сорбуватися середовище на адсорбенті, тим краще буде протікати адсорбція розчиненої речовини.
Чим більше поверхневий натяг самого середовища, тим менше її молекули здатні до адсорбції на твердому тілі і тим краще на ньому адсорбується розчинена речовина (з водних розчинів сорбція краще, ніж з органічних розчинників).

Рисунок 5.17 - Залежність адсорбції від концентрації адсорбтива: 1 - сильна адсорбція адсорбтива і слабка адсорбція розчинника; 2 - сильна адсорбція адсорбтива і сильна адсорбція розчинника; 3 - слабка адсорбція компонентів
5.3.3.2 Іонна адсорбція
Адсорбція електролітів потребує окремого розгляду, оскільки адсорбент може по-різному адсорбувати іони, на які розпадається молекула електроліту в розчині.
На адсорбції іонів суттєво позначається природа адсорбенту. Іони, здатні поляризуватися, сорбуються зазвичай тільки на поверхнях, що складаються з полярних молекул або іонів. Тому іонну адсорбцію часто називають полярною адсорбцією.
Поверхні, які мають певний заряд, адсорбують протилежно заряджені іони.
Протилежно заряджені іони безпосередньо не адсорбуються, але під дією сил електростатичного тяжіння залишаються поблизу адсорбованих іонів, утворюючи з ними на поверхні ПЕШ (подвійний електричний шар). Іонна адсорбція - адсорбція субстантивних барвників.
5.3.3.3 Обмінна адсорбція
Якщо на поверхні адсорбенту вже адсорбовано електроліт, то, при контакті цього комплексу з іншим електролітом, спостерігається обмін між ПЕШ адсорбенту і середовищем. При обмінній адсорбції адсорбент поглинає певну кількість яких-небудь іонів, одночасно виділяє в розчин еквівалентну кількість інших іонів, витіснених з поверхні. Іонообмінні смоли - іоніти, широко застосовуються у виробництві для одержання демінералізованої води, тобто води, яка не містить розчинних солей. Іоніти: катіоніти (обмінюють катіони, в т.ч. Н+); аніоніти (обмінюють аніони в т. ч. ОН-). Для повного знесолювання води її послідовно пропускають через катіонітовий і аніонітовий фільтри:

2B5.3.4 Адсорбція на межі тверде тіло-газ
Адсорбція газів на твердому тілі є простішим випадком адсорбції, оскільки система газ-тверде тіло складається тільки з двох компонентів. Адсорбція газів і парів широко застосовується для виділення окремих компонентів з газових сумішей і для повного розділення сумішей. М.Д.Зелинський (академік Микола Дмитрович Зелинський, 1861 р.н., видатний руський і радянський хімік-органік) вперше запропонував використовувати активне вугілля для поглинання отруйних газів. На практиці в якості адсорбентів, призначених для виділення, розрідження й очистки речовин застосовують спеціально синтезовані високопористі тіла, серед яких найбільш поширені - активне вугілля, силікагелі, цеоліти. Утримання газів і парів пористими тілами, тобто їхня адсорбційна здатність залежить як від природи взаємодіючих тіл, так і від структури пористого тіла. Капілярна конденсація обумовлена наявністю в адсорбенту дрібних пор. Вона може проявлятись при певному ступені заповнення адсорбенту або при певному значенні тиску пари. До цього моменту поверхнева енергія адсорбенту практично повністю скомпенсована в результаті полімолекулярної адсорбції, а мікропори заповнені адсорбентом.
Контрольні питання:
1 Що називається адсорбцією? Дати визначення понять «сорбція», «адсорбція», «абсорбція»,»адсорбент», «адсорбтив» («адсорбат»).
2 Як виражається адсорбція Г?
3 Як на практиці визначають адсорбцію?
4 Якими силами забезпечується фізична адсорбція? Чим обумовлена хімічна адсорбція ()хемосорбція)?
5 Дати порівняльну характеристику фізичної та хімічної адсорбції (рушійні сили, зворотность, залежність від температури).
6 Які залежності називають ізотермами адсорбції? Який вигляд має ізотерма адсорбції? Які ключові ділянки виділяють на ізотермі адсорбції?
7 Яке емпіричне рівняння: запропонував Г.Фрейндлих для аналітичного виразу ізотерми?
8 Якими причинами обумовлена адсорбція?
9 На поверхні розділу яких фаз зазвичай розрізняють адсорбцію?
10 Чим пояснюється шароподібна форма краплі рідини?
11 Що називається поверхневим натягом (ПН)? Яку розмірність має ПН в одиницях СІ? Яким уявленням про ПН відповідає одиниця вимірювання [Н/м]?
12 Як ПН залежить від міцності міжмолекулярних зв'язків і від температури?
13 Що називається міжфазним натягом?
14 Які існують незалежні методи оцінки ПН?
15 Яку залежність встановлює й які параметри дозволяє визначити співвідношення Юнга-Дюпре?
16 Як визначається робота
когезії
![]() ?
?
17 Як визначається робота
адгезії
![]() ?
?
18 Як обчислюють роботу адгезії за рівнянням Дюпре? Як, згідно з цим рівнянням зв’язані адгезія і змочування?
19 Як діють на краплю рідини сили адгезійої взаємодії (адгезійні сили) і сили когезії?
20 До якого значення прагне поверхнева вільна енергія? Що відбувається з речовиною при збільшенні вільної поверхневої енергії?
21 Що відбувається, якщо розчинена речовина знижує вільну поверхневу енергію розчинника ?
22 Що називається адсорбцією Г і яка її розмірність?
23 Коли адсорбцію Г називають позитивною, а коли – негативною?
24 Чому дорівнює адсорбція Г, якщо розчинена речовина не змінює вільну поверхневу енергію розчинника ? Як у такому випадку розподілена між поверхневим шаром і об'ємом речовина?
25 Які речовини згідно цього рівняння Гіббса показують позитивну адсорбцію?
26 Які речовини називають поверхнево-активними (ПАР)? Для чого ПАР використовуються на практиці?
27 Яка величина є мірою здатності речовини знижувати поверхневу енергію (за Ребиндером)? Яка Її розмірність?
28 Сформулювати правила Дюкло-Траубе.
29 Охарактеризувати величини, що входять до рівняння Ленгмюра, яким описується ізотерма адсорбції. Як за ізотермою адсорбції визначають адсорбцію Г? В яких координатах ізотерма адсорбції набуває лінійний вигляд?
30 Перелічити основні теорії адсорбції.
31 На яких положеннях ґрунтується теорія адсорбції Ленгмюра? Як представляється процес адсорбції згідно цієї теорії?
32 Від чого залежить адсорбція згідно припущень Фрейндліха? Який вигляд має емпіричне рівняння Фрейндліха? Яким шляхом проводять лінеалізацію рівняння Фрейндліха?
33 Як за ізотермою адсорбції визначають коефіцієнти у рівнянні Фрейндлиха?
34 На яких вихідних положеннях ґрунтується теорія полімолекулярної адсорбції, запропонована Поляні?
35 Залежно від чого застосовувана теорія Ленгмюра або Поляні?
36 Назвати основні положення узагальненої теорії адсорбції БЕТ.
37 Які особливості має адсорбція на межі: рідина-газ, розчин-газ, тверде тіло-розчин, тверде тіло-газ?
38 Які особливості має молекулярна адсорбція з розчинів, іонна адсорбція та обмінна адсорбція?
Рекомендована література:
1 Воюцкий С. С. Курс коллоидной химии / С. С. Воюцкий. – М. : Химия, 1975. – 512 с.
2 Фролов Ю. Г. Курс коллоидной химии / Ю. Г. Фролов. – 2-е изд., перераб. и доп. – М. : Химия, 1988. – 464 с.
Лекція 6 Електроповерхневі явища
План лекції
6.1 Причини утворення подвійного електричного шару (ПЕШ) на поверхні колоїдних частинок
6.2 Будова ПЕШ
6.3 Термодинамічний та електрокінетичний потенціал
6.4 Будова міцели
6.5 Електрокінетичні явища
Ключові слова: подвійний електричний шар (ПЕШ), термодинамічний потенціал, електрокінетичний потенціал, міцела, електрокінетичні явища, електрофорез, електроосмос, потенціал течії, потенціал седиментації.
6.1 Причини утворення подвійного електричного шару (ПЕШ) на поверхні колоїдних частинок
Існування подвійного електричного шару (ПЕШ) іонів і стрибка потенціалу на межі розділу двох фаз відіграє важливу, а іноді - основну роль у багатьох явищах, важливих для теорії і практики. До них відносяться: електродні процеси, електрокапілярні та електрокінетичні явища, явища пов'язані з електростатичною взаємодією колоїдних часток, які в значній мірі визначають стійкість дисперсної системи. Всі ці явища, зв'язані з ПЕШ, називаються електроповерхневими.
Розрізняють три можливі механізми утворення ПЕШ:
- в результаті переходу іонів або електронів з однієї фази в іншу (поверхнева іонізація);
- в результаті селективної адсорбції в міжфазному шарі іонів електролітів;
- в результаті орієнтації полярних молекул сполучених фаз при їх взаємодії.
За першим механізмом заряд на поверхні може утворюватись в результаті електролітичної дисоціації молекул поверхні твердої фази, в результаті чого іони одного знака залишаються в фіксованому положенні на цій поверхні, а протиіони (іони протилежного знака) поступають в прилеглий розчин. За таким механізмом ПЕШ виникає в розчині цілого ряду високомолекулярних сполук.
За другим механізмом, іони одного знака необмінно адсорбуються поверхнею, а іони протилежного знака, в силу електростатичного тяжіння, розташовуються біля неї. Величина і знак заряду поверхні залежить від природи твердих часток адсорбенту і від природи рідини, до якої він прилягає.
6.2 Будова ПЕШ
Вперше уявлення про ПЕШ було висловлено Г.Квинке (1859) і розвинуто в роботах Г.Гельмгольца (1879). Теорія ПЕШ набула розвитку в трудах радянських учених А.Н.Фрумкина і Б.В.Дерягина. Першою теорією будови ПЕШ була теорія Гельмгольца: ПЕШ складається з двох плоских зарядів, розташованих на молекулярній відстані один від одного і взаємодіючих між собою тільки за рахунок електростатичних сил тяжіння. Структура подібна плоскому конденсатору, падіння потенціалу між шарами відбувається лінійно. Модель Гуі-Чепмена передбачала дифузійне розташування протиіонів, які знаходяться під дією сил, що діють у протилежних напрямах: електростатичних сил тяжіння до поверхні та сил теплового руху іонів, що призводять до дифузії і розмиванню зовнішнього шару. Теорія вводить поняття дифузійного шару, іони розглядаються як точкові заряди, які не мають власних розмірів.
Згідно сучасним уявленням (теорія Штерна) будова ПЕШ представляється наступним чином: іони, що входять до складу твердої фази, утворюють внутрішню обкладку подвійного шару; іони протилежного знака, тобто протиіони утворюють зовнішню обкладку, при цьому частка протиіонів находиться у безпосередньому контакті з іонами твердої фази, утворюючи щільний шар (шар Гельмгольца, адсорбційний шар), інша частка протиіонів складає дифузний шар (шар Гуі). Система в цілому завжди є електронейтральною, тобто число зарядів внутрішньої обкладки має бути рівним числу зарядів протиіонів (щільний шар + надлишок у дифузному шарі). В межах ПЕШ діє електричне поле, інтенсивність якого характеризується значенням потенціалу. Зміна потенціалу в ПЕШ залежно від відстані показана на рисунку 6.1.
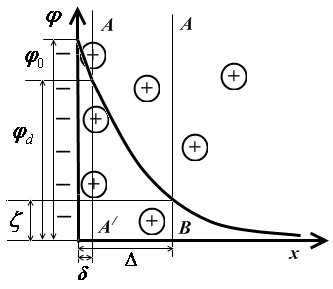
Рисунок 6.1 - Схема будови подвійного електричного шару і зміни потенціалу
При цьому падіння потенціалу в межах щільного шару відбувається лінійно, а в дифузному шарі – за експонентою.
Сьогодні учіння про ПЕШ продовжує розвиватись, оскільки воно має велике значення для розуміння й удосконалення таких практично важливих процесів як коагуляція колоїдів, флотація, іонний обмін і ін.
6.3 Електрокінетичний потенціал Термодинамічний та електрокінетичний потенціал
Утворення подвійного шару іонів призводить до появи певних електричних потенціалів на межі твердої і рідкої фаз.
На твердій поверхні виникає заряд, незалежний φ-потенціал.
Знак φ-потенціалу співпадає зі знаком заряду потенціалутворюючих іонів.
φ-потенціал можна розрахувати за рівнянням Нернста:
![]() ,
(6.1)
,
(6.1)
де
![]() -
електричний потенціал на поверхні;
-
електричний потенціал на поверхні;
- універсальна газова стала;
- абсолютна температура;
![]() - заряд потенціалутворюючих іонів;
- заряд потенціалутворюючих іонів;
-
стала Фарадея (![]() )
)
![]() і
і
![]() -
активність іонів на поверхні та в
розчині.
-
активність іонів на поверхні та в
розчині.
-потенціал дорівнює роботі переносу одиничного (елементарного) заряду з нескінченно віддаленої точки об'єму розчина на поверхню твердої фази.
Потенціал на поверхні φ називається термодинамічним потенціалом і характеризує стрибок потенціалу на поверхні розділу між фазами.
Потенціал на поверхні розділу φ і потенціал так званої площини максимального наближення (розташованої на відстані Δ порядку молекулярних розмірів) φ0 належать до розряду практично невимірюваних величин.
Для характеристики електричних властивостей поверхні використовують ζ-потенціал - потенціал межі ковзання фаз, визначуваний експериментально різними методами (метод потенціалу протікання, електрофоретичний метод й ін.). ζ-потенціал можна представити як роботу, потрібну для переносу одиничного заряду з нескінченно віддаленого елемента об'єму розчина на поверхню ковзання. ζ-потенціал за знаком співпадає з φ-потенціалом.
З рисунка 6.1 видно, що потенціал межі ковзання нижче ніж потенціал на поверхні, тем не менш величина ζ-потенціалу широко використовується для характеристики властивостей поверхні при розгляді адсорбції, адгезії, агрегатної сталості дисперсних систем й інших важливих процесів.
Як видно з рисунка 6.1, значення електрокінетичного потенціалу залежить від числа нескомпенсованих на поверхні ковзання зарядів адсорбційного шару, тобто від числа іонів в дифузному шарі.
Товщина подвійного електричного шару і значення електрокінетичного потенціалу залежать від концентрації електроліту в розчині. Зміну електрокінетичного потенціалу зі зміною концентрації іонів різних валентностей показано на рисунку 6.2.
Р исунок
6.2 - Залежність електрокінетичного
потенціалу від концентрації електроліту
для одно- (1), двох- (2) і трьох- (3) зарядних
протиіонів
исунок
6.2 - Залежність електрокінетичного
потенціалу від концентрації електроліту
для одно- (1), двох- (2) і трьох- (3) зарядних
протиіонів
Зміна товщини ПЕШ при додаванні електроліту до розчину пояснюється тим, що при цьому в розчині змінюються співвідношення між впливом електростатичного тяжіння та дифузії, що визначає розподіл іонів у зовнішній обкладці подвійного шару.
Катіони оказують тим більш знижуючу дію (при негативному знаку заряду поверхні), чим вище їх валентність.
Таку дію можна пояснити тим, що зі збільшенням заряду іона зростає сила електростатичного тяжіння його до поверхні й іони більшої валентності можуть ближче підійти до поверхні, викликаючи тим самим більш сильне стиснення дифузного шару й, відповідно, зниження ζ-потенціалу.
Багатовалентні іони можуть не тільки зменшити величину електрокінетичного потенціалу, але і змінити його знак, тобто здійснити перезарядку поверхні.
Це пояснюється їхньою високою специфічною адсорбційною здатністю: сильно електростатично притягуючись до поверхні, багатовалентні катіони нейтралізують її заряд, подальша надеквівалентна адсорбція катіонів поверхнею приводить до появи надлишкового позитивного заряду на поверхні розділу, який знов буде компенсуватись негативними протиіонами, внаслідок чого на поверхні виникає новий подвійний електричний шар з позитивною внутрішньою обкладкою і негативним шаром протиіонів.
Чотирьохвалентні метали, наприклад цирконій, забезпечують вже в незначній кількості різке зниження електрокінетичного потенціалу, мінімальне збільшення концентрації металу приводить до перезарядки поверхні та збільшенню значень ζ-потенціалу.
6.4 Будова міцели
Згідно загальноприйнятої міцелярної теорії будови колоїдних розчинів, золь складається з 2-х частин:
- міцела – структурна колоїдна одиниця (частка дисперсної фази), оточена подвійним електричним шаром;
- інтерміцелярна рідина – дисперсійне середовище, що розділяє міцели, в якій розчинені електроліти, неелектроліти і ПАР.
Будова міцели може бути розглянута лише в першому наближенні, оскільки вона не має визначеного складу.
Сьогодні нема можливості врахувати впливи на будову міцели усіх процесів, обумовлених складною іонно-молекулярною взаємодією на поверхні розділу двох фаз в розчині.
Розглянемо, без урахування впливу інтерміцелярної рідини, спрощену схему міцели йодиду срібла, одержаного по реакції:
AgNO3+KJAgJ+KNO3
з надлишком KJ і з надлишком AgNO3, відповідно (рисунок 6.3).
Елементарна колоїдна частка – міцела – має наступну будову: в центрі знаходиться ядро, яке представляє собою мікрокристал або агрегат з мікрокристалів. Поверхня ядра володіє запасом вільної енергії і вибірково адсорбує іони з навколишнього середовища.
Правило Панета-Фаянса: на поверхні твердого тіла переважно адсорбуються іони, здатні добудовувати його кристалічну решітку або утворювати з іонами, що входять до складу кристалічної решітки, більш малорозчинні сполуки. Визначається це надлишком тих чи тих іонів.

![]()
![]()

надлишок KJ |
надлишок AgNO3 |
Рисунок 6.3 - Будова міцел йодиду срібла, одержаного по реакції AgNO3+KJAgJ+KNO3: а – з надлишком KJ, б – з надлишком AgNO3
Ядро разом з потенціалвизначаючими іонами утворює агрегат.
Після виникнення заряду агрегат починає притягувати з розчину іони з протилежним знаком (протиіони) - утворюється подвійний електричний шар.
При цьому деякі іони дуже міцно притягуються до агрегату, утворюючи адсорбційний (щільний) шар протиіонів.
Агрегат разом з протиіонами щільного шару складає гранулу або частку.
Частка характеризується подвійним електричним шаром, що складається з потенціалвизначаючих іонів і протиіонів щільного шару, алгебраїчна сума яких визначає заряд системи.
Протиіони, що не входять в щільний шар і знаходяться на більш далекій відстані від ядра, утворюють дифузний шар протиіонів.
Усе разом складає міцелу, електричний заряд якої дорівнює нулю.
6.5 Електрокінетичні явища
Електрокінетичні явища - це явища, пов'язані з рухом дисперсної фази та дисперсійного середовища.
До електрокінетичних явищ відносяться явища електрофорезу й електроосмосу, а також потенціал седиментації та потенціал течії.
Наявність у часток дисперсних систем електричного заряду було відкрито ще в 1808 році професором Московського університету Федором Федоровичем Рейссом при дослідженні електролізу води.
Ф.Ф.Рейсс поставив два експерименти. В одному він використовував U-образну трубку, в іншому занурив у глину 2 скляні трубки (рисунок 6.4).
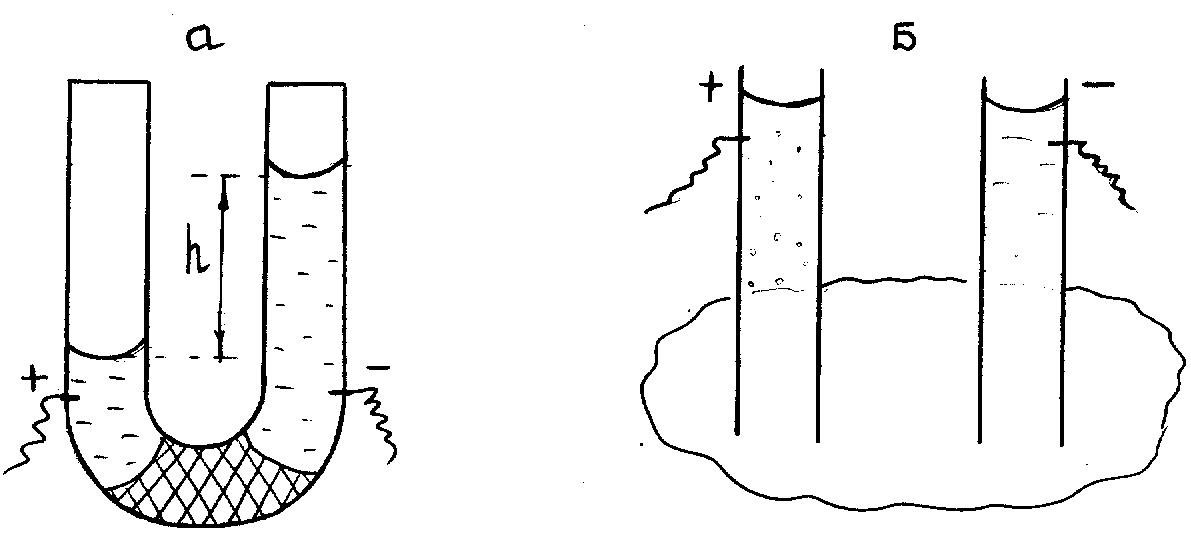
а б
Рисунок 6.4 – Схеми опитів Ф.Ф.Рейсса
При пропусканні постійного струму через прилад, який складається з U-образної трубки, середня частина якої заповнена кварцовим піском (рисунок 6.3а), вода в коліні з негативно зарядженим електродом (катодом) піднімалась, що свідчило про позитивний заряд води. Вода заряджалась при контакті з частками кварцу. Без діафрагми з піску рух рідини був відсутній.
Явище переміщення рідини в пористих тілах під дією електричного поля називається електроосмосом.
Явище електроосмосу використовується в промисловості при знесоленні води, при електроосушуванні пористих тіл (бетонів, боліт та ін.), при очистці лікарських препаратів, при дубленні шкіри та т.і.
При створенні різниці потенціалів у трубках, занурених у глину (рисунок 6.4б), рідина в трубці з позитивним полюсом мутніє - частки глини переносяться в електричному полі до позитивного полюсу.
Пізніше було встановлено, що частки рухаються в електричному полі з постійною швидкістю.
Швидкість тим більше, чим вище різниця потенціалів і діелектрична стала середовища, і тим менше, чим більше в'язкість середовища.
Переміщення часток дисперсної фази в електричному полі називається електрофорезом (катафорезом).
Електрофорез (катофорез) (грец. рhoresis – несення, перенесення) – явище спрямованого переміщення заряджених мікрочастинок у рідкому (найчастіше водному) середовищі під дією зовнішнього електричного поля.
Механізм електрофорезу (рисунок 6.5) полягає в тому, що під дією електричного поля ПЕШ частинок дисперсної фази розривається на межі ковзання, частинка набуває певного заряду і переміщується до протилежно зарядженого електрода, а протиіони дифузного шару рухаються у протилежний бік.

Рисунок 6.5 – Схема руху частинок при електрофорезі
Лінійна швидкість
переміщення зарядженої частинки
(дисперсної фази)
![]() визначається за рівнянням Гельмгольца
– Смолуховського:
визначається за рівнянням Гельмгольца
– Смолуховського:
![]() ,
(6.2)
,
(6.2)
де – відносна діелектрична проникність середовища;
![]() – електрична стала 8,854·10–12 Ф/м;
– електрична стала 8,854·10–12 Ф/м;
![]() – напруженість електричного поля;
– напруженість електричного поля;
– в’язкість середовища.
Електрофорез використовується для зневоднення нафти і нафтопродуктів (ЕЛОУ – електроочисні установки), при очистці газоподібних відходів виробництва (електрофільтри), при виготовленні виробів з латексу (дисперсій полімеру), в медицині - для введення в організм колоїдних ліків та ін.
Електроосмос (електроендоосмос) – (грец. osmos – штовхання, тиск) – явище спрямованого переміщення рідин через тверді капілярно-пористі матеріали і діафрагми під дією зовнішнього електричного поля. Механізм електроосмосу (рисунок 6.6) можна пояснити таким чином.
Рисунок 6.6 – Схема руху рідини при електроосмосі
На внутрішній
поверхні капілярів діафрагми утворюється
ПЕШ унаслідок поверхневої дисоціації
функціональних груп, вибіркової адсорбції
одного з іонів електроліту, що міститься
у розчині, або внаслідок адсорбції на
поверхні капіляра іонів Н+ або
ОН–, завжди присутніх у воді. При
накладенні електричного поля дифузний
шар протиіонів по межі ковзання рухається
паралельно до нерухомого адсорбційного
шару до електрода відповідного знаку,
при цьому з ним рухається і певна частина
дисперсійного середовища, бо між
гідратною оболонкою іона й оточуючою
рідиною діють сили внутрішнього тертя
і молекулярного зчеплення. До протилежного
електрода рухаються ті іони з об’єму
рідини, які мають знак, протилежний
знаку протиіонів. Об’ємна швидкість
течії рідини (![]() )
через пористу діафрагму визначається
за рівнянням Гельмгольца-Смолуховського:
)
через пористу діафрагму визначається
за рівнянням Гельмгольца-Смолуховського:
![]() ,
(6.3)
,
(6.3)
де – сила струму;
– питома електрична провідність;
![]() – площа поперечного перерізу капілярів.
– площа поперечного перерізу капілярів.
У наведене рівняння (6.3) не входять розміри капіляра, що дозволяє виміряти об’ємну швидкість течії рідини не через окремий капіляр, а через систему капілярів, тобто через пористу діафрагму.
Наступними дослідженнями були виявлені два явища, зворотні електрофорезу й електроосмосу.
Дорн у 1878 році виявив, що при осіданні яких-небудь часток в рідині (піску в воді) виникає електрорушійна сила між двома електродами, введеними в різні місця стовпа рідини - явищ одержало назву ефект Дорна або потенціал седиментації (осідання).
Квінке в 1859 році виявив, що при течії рідини через пористе тіло під впливом перепаду тисків виникає різниця потенціалів. Це явище, зворотне електроосмосу, названо потенціалом протікання або потенціалом течії. Виникнення різниці потенціалів Квинке спостерігав при течії води і водних розчинів через різні пористі матеріали (глина, пісок, дерево, графіт).
Схеми експериментів Квінке і Дорна наведено на рисунку 6.7.

а б
Рисунок 6.7 – Схема експериментів Квінке з потенціалу течії (а) і Дорна з потенціалу седиментації (б)
Явище, обернене електроосмосу, є потенціалом течії (рисунок 6.7а). При течії під тиском рідини через пористу діафрагму між протилежними поверхнями діафрагми (на кінцях капілярів) виникає різниця потенціалів, яку називають потенціалом течії. Він зумовлений наявністю ПЕШ на межі поділу фаз. При течії під тиском рідини через пористу діафрагму відбувається деформація ПЕШ, а іони дифузійного шару зміщуються в напрямку потоку рідини. Внаслідок цього руху зарядів уздовж межі виникає поверхневий струм і різниця потенціалів на кінцях капілярів діафрагми; ця різниця потенціалів, у свою чергу, призводить до появи струму провідності у зворотному напрямку. Різниця потенціалів збільшується, доки ці струми не зрівняються. З цього моменту вона набуває сталого значення:
![]() ,
(6.4)
,
(6.4)
де – тиск, який викликає течію рідини.
При осіданні
дисперсних частинок під дією сили
тяжіння (рисунок 6.7б) ПЕШ, які оточують
частинку, деформуються за рахунок тертя
об шар рідини. Внаслідок цього дифузні
іони відстають від частинок, які
рухаються, і по висоті осідання виникає
різниця потенціалів, яку називають
потенціалом седиментації
![]() –
явище, обернене електрофорезу. Потенціал
седиментації визначають за рівнянням:
–
явище, обернене електрофорезу. Потенціал
седиментації визначають за рівнянням:
![]() ,
(6.5)
,
(6.5)
де і – густина дисперсної фази і дисперсійного середовища;
– прискорення сили тяжіння;
![]() – об’ємна доля дисперсної фази, що для
сферичних частинок радіусом
і кількістю
в одиниці об’єму дорівнює
– об’ємна доля дисперсної фази, що для
сферичних частинок радіусом
і кількістю
в одиниці об’єму дорівнює
![]() .
.
Таким чином, за причинно-наслідковими ознаками електрокінетичні явища поділяють на дві групи.
До першої відносять явища, при яких відносний рух фаз викликається електричною різницею потенціалів - електрофорез і електроосмос.
До другої групи явищ відносять потенціал течії і потенціал седиментації, в яких електрична різниця потенціалів обумовлюється відносним рухом фаз.
Використання електрокінетичних явищ у різних галузях народного господарства відкриває широкі перспективи створення нових технологій виробництва, удосконалення відомих технологій з метою підвищення якості продукції, інтенсифікації технологічних процесів виробництва. За допомогою електрофорезу можна розділяти на фракції складні суміші, наносити тонкі однорідні плівки і покриття на складні поверхні. Електрофорез застосовується для руйнування аерозолів. Явище електроосмосу використовують у процесах сушіння, зокрема, при зневоднюванні пористих матеріалів, мікрофільтрації тощо.
Контрольні питання:
1 Які можливі причини виникнення подвійного електричного шару на міжфазній поверхні?
2 Наведіть приклади механізмів утворення ПЕШ в різних дисперсних системах.
3 Як утворюється подвійний електричний шар?
4 Яка будова подвійного електричного шару згідно з теоріями Гельмгольца, Гуї-Чепмена та Штерна?
5 Що називають термодинамічним потенціалом?
6 Напишіть рівняння реакції отримання золю AgJ, схему міцели AgJ, стабілізованої AgN03, та поясніть її будову.
7 Напишіть схему міцели AgJ, стабілізованої KJ, та поясніть її будову.
8 Що називають електрокінетичним потенціалом?
9 Від яких факторів залежить величина поверхневого і електрокінетичного потенціалів?
10 Чим відрізняються термодинамічний та електрокінетичний потенціали? Як вони залежать від концентрації електроліту у середовищі?
11 Опишіть схеми опитів Ф.Ф.Рейсса.
12 Який процес називають електрофорезом?
13 Опишіть механізм електрофорезу.
14 За яким рівнянням визначається лінійна швидкість переміщення зарядженої частинки (дисперсної фази) при електрофорезі?
15 Який процес називається електроосмосом?
16 Опишіть механізм електроосмосу.
17 Опишіть схеми експериментів Квінке і Дорна.
18 Яке явище називається потенціалом течії?
19 За яким рівнянням визначають потенціал седиментації?
20 Наведіть приклади практичного використання електрокінетичних явищ.
Рекомендована література:
1 Воюцкий С. С. Курс коллоидной химии / С. С. Воюцкий. – М. : Химия, 1975. – 512 с.
2 Фролов Ю. Г. Курс коллоидной химии / Ю. Г. Фролов. – 2-е изд., перераб. и доп. – М. : Химия, 1988. – 464 с.
Лекція 7 Стійкість та еволюція дисперсних систем
План лекції
7.1 Причини і форми нестійкості дисперсних систем
7.2 Коагуляція ліофобних золів електролітами
7.2.1 Дія електролітів на коагуляцію
7.2.2 Спільна дія електролітів при коагуляції
7.3 Кінетика швидкої коагуляції
