
- •0Bхімія довкілля: колоїдна хімія
- •4BКонспект лекцій
- •45BЛекція 1 Колоїдний стан речовини
- •42B1.1 Дисперсні системи
- •43B1.1.1 Основні ознаки дисперсних систем
- •44B1.1 Дисперсні системи
- •1BКрайовий кут є мірою змочування. Він визначається як кут між твердою поверхнею і дотичною в точці дотику трьох фаз. Кут відраховується в бік рідкої фази.
- •5B5.2.3 Полімолекулярна сорбція
- •34B7.4 Теорія агрегативної стійкості та коагуляції ліофобних золів длфо
- •33B7.2 Коагуляція ліофобних золів електролітами
- •35B7.2.2 Спільна дія електролітів при коагуляції
- •36B7.3 Кінетика швидкої коагуляції
- •40BРисунок 7.7 - Залежність швидкості коагуляції від концентрації електроліту
- •37B7.4 Теорія агрегативної стійкості та коагуляції ліофобних золів длфо
- •38B7.5 Старіння золів
- •39B7.6 Захисна дія молекулярних адсорбуючих шарів
1BКрайовий кут є мірою змочування. Він визначається як кут між твердою поверхнею і дотичною в точці дотику трьох фаз. Кут відраховується в бік рідкої фази.
У випадку рідини L2 (рисунок 5.3б) тенденція до розтікання по поверхні менш виражена і кут 0 900.
В третьому прикладі рідина не змочує поверхню (рисунок 5.3в) і контактний кут перевищує 900. Рідина прагне зменшити площу контакту з твердим тілом.
В стані рівноваги:
![]() .
(5.8)
.
(5.8)
Величина
![]() носить назву адгезійного
натягу. Рівняння
відомо як співвідношення
Юнга-Дюпре, яке встановлює
умови рівноваги сил, з якого можна
визначити ПН твердого тіла або міжфазний
натяг:
носить назву адгезійного
натягу. Рівняння
відомо як співвідношення
Юнга-Дюпре, яке встановлює
умови рівноваги сил, з якого можна
визначити ПН твердого тіла або міжфазний
натяг:
![]() ,
(5.9)
,
(5.9)
![]() .
(5.10)
.
(5.10)
Поверхневий натяг розглянуто як сили, прикладені перпендикулярно до одиниці довжини периметра змочування і діючі по дотичній до відповідних поверхонь (рисунок 5.4).

Рисунок 5.4 - Дія трьох сил (пограничних) поверхневого натягу
Змочуванню
сприяє низька вільна енергія поверхні
розділу, висока поверхнева енергія
твердого тіла і низька вільна енергія
поверхні рідини.
![]() і
і
![]() визначаються
експериментально, а
визначаються
експериментально, а
![]() і
і
![]() розрахунковим шляхом. Величини
розрахунковим шляхом. Величини
![]() і
і
![]() зазвичай невідомі і аби їх визначити
розглядають молекулярні сили та їхню
роботу, яка визначає значення усіх
і
.
При цьому розрізняють сили когезії
(злипання) й адгезії (прилипання). Перші
діють між молекулами всередині фази,
другі - в різних фазах. Робота когезії
зазвичай невідомі і аби їх визначити
розглядають молекулярні сили та їхню
роботу, яка визначає значення усіх
і
.
При цьому розрізняють сили когезії
(злипання) й адгезії (прилипання). Перші
діють між молекулами всередині фази,
другі - в різних фазах. Робота когезії
![]() визначається як сила, необхідна для
розриву однорідної об'ємної фази,
віднесена до одиниці площі розриву.
визначається як сила, необхідна для
розриву однорідної об'ємної фази,
віднесена до одиниці площі розриву.
Оскільки при цьому утворюються дві нові поверхні рідини, то:
![]() .
(5.11)
.
(5.11)
Робота
адгезії
![]() ,
також віднесена до одиниці площі,
визначається як робота розриву міжфазного
поверхневого шару. Витрачається вона
на утворення двох нових поверхонь, при
цьому зникає вихідна міжфазна межа:
,
також віднесена до одиниці площі,
визначається як робота розриву міжфазного
поверхневого шару. Витрачається вона
на утворення двох нових поверхонь, при
цьому зникає вихідна міжфазна межа:
![]() .
(5.12)
.
(5.12)
Вільна енергія зменшується за рахунок роботи сил взаємодії. З цих двох рівнянь витікає рівняння, відоме як рівняння Дюпре:
![]() .
(5.13)
.
(5.13)
За цим
рівнянням обчислюють
![]() ,
експериментально визначаючи
,
експериментально визначаючи
![]() і
.
Воно показує, що чим вище адгезія, тим
більше
і
.
Воно показує, що чим вище адгезія, тим
більше
![]() ,
тобто змочування.
,
тобто змочування.
Таким чином, сили адгезійої взаємодії (адгезійні сили) прагнуть розтягнути краплю, а сили когезії стягують краплю, перешкоджаючи розтіканню.
Визначення
![]() (поверхневого натягу твердого тіла)
представляє певні труднощі. В.Зисман
ввів поняття про
(поверхневого натягу твердого тіла)
представляє певні труднощі. В.Зисман
ввів поняття про
![]() -
критичний ПН змочування, що дозволяє
оцінити ПН твердого тіла.
-
критичний ПН змочування, що дозволяє
оцінити ПН твердого тіла.
Ця величина визначається як
значення
![]() в точці перетину графіка залежності
в точці перетину графіка залежності
![]() від
з горизонтальною лінією, відповідній
від
з горизонтальною лінією, відповідній
![]() =1
(рисунок 5.5).
=1
(рисунок 5.5).
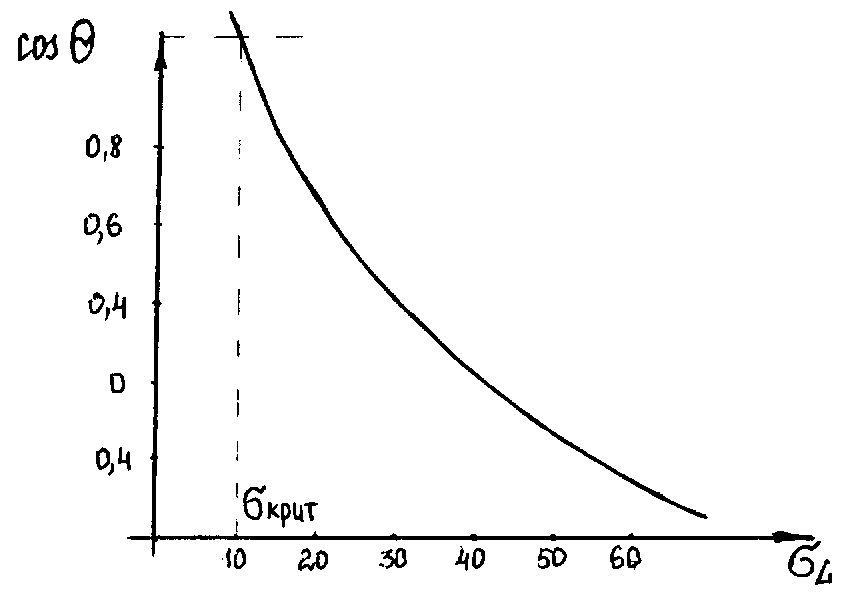
Рисунок 5.5 – Визначення за В.Зисманом
Рідина з
![]() розтікається по поверхні твердого тіла.
Чисельно
розтікається по поверхні твердого тіла.
Чисельно
![]() прирівнюють до
,
хоча, на думку Ю.С.Липатова (Юрій Сергійович
Липатов, 1927 р.н., радянський фізико-хімік)
для цього нема достатніх підстав. Відомо
емпіричне співвідношення, яке дотримується
для багатьох систем – це правило
Антонова:
прирівнюють до
,
хоча, на думку Ю.С.Липатова (Юрій Сергійович
Липатов, 1927 р.н., радянський фізико-хімік)
для цього нема достатніх підстав. Відомо
емпіричне співвідношення, яке дотримується
для багатьох систем – це правило
Антонова:
![]() .
(5.14)
.
(5.14)
Зв'язок
між величинами
![]() постулюється в рівнянні:
постулюється в рівнянні:
![]() ,
(5.15)
,
(5.15)
де Ф - емпіричний параметр, який можна розрахувати теоретично з молекулярних властивостей через константи Гамахера та потенціал Леннарда-Джонса.
Розглянемо явище адсорбції, ізотерму адсорбції та рівняння Гіббса.
ПН
розчинів зазвичай відрізняється від
ПН розчинника. Розчинена речовина може
не змінювати
![]() ,
підвищувати і знижувати його.
,
підвищувати і знижувати його.
Поверхнева вільна енергія
прагне до мінімуму, тому при підвищенні
![]() речовина буде видалятись з поверхні
всередину рідини. Повному видаленню
молекул розчиненої речовини з поверхні
запобігає тепловий рух, під дією якого
речовина прагне до рівномірного розподілу
в об'ємі.
речовина буде видалятись з поверхні
всередину рідини. Повному видаленню
молекул розчиненої речовини з поверхні
запобігає тепловий рух, під дією якого
речовина прагне до рівномірного розподілу
в об'ємі.
Під впливом цих двох факторів встановлюється рівновага, в результаті якої концентрація речовини в поверхневому шарі зменшується порівняно з концентрацією в об'ємі.
Якщо розчинена речовина знижує , то концентрація його в поверхневому шарі збільшується.
Самочинна зміна концентрації речовини в поверхневому шарі, віднесена до одиниці поверхні, називається адсорбцією, означається через Г і виражається в кмоль/м2, або моль/см2.
Якщо Г 0 адсорбцію називають позитивною, якщо Г0 - негативною.
Якщо розчинена речовина не змінює , адсорбція Г = 0 і речовина рівномірно розподілена між поверхневим шаром і об'ємом.
Просте термодинамічне
співвідношення між поверхневою
концентрацією Г і зміною ПН з активною
концентрацією розчинюваної речовини
![]() було виведено Гіббсом:
було виведено Гіббсом:
![]() ,
(5.16)
,
(5.16)
де - активність розчину;
- універсальна газова стала;
- абсолютна температура.
Для розбавлених розчинів активність замінюють концентрацією С:
![]() .
(5.17)
.
(5.17)
З рівняння витікає, що тільки
ті речовини показують позитивну
адсорбцію, з підвищенням концентрації
яких ПН знижується,
![]()
0. Якщо
0. Якщо
![]()
0, концентрація розчиненої речовини в
поверхневому шарі буде зменшуватись:
Г
0.
0, концентрація розчиненої речовини в
поверхневому шарі буде зменшуватись:
Г
0.
Речовини, що підвищують ПН, називаються негативно поверхнево-активними речовинами (інактивними, такими є неорганічні солі). Речовини, що знижують ПН називають поверхнево-активними (ПАР).
До ПАР відносяться органічні речовини, молекули яких побудовані з ділянок з різко відмінними властивостями. Одна частка молекули полярна, інша – неполярна (вуглеводневий радикал). Полярна: -OH, -COOH, -SO3Na, -SO3H, -NH2, -SO2H. Полярна частка гідрофільна, неполярна – гідрофобна. ПАР характеризуються величиною ГЛБ (гідрофільно-ліпофільного балансу).
Величина
![]() ,
за Ребиндером, є мірою здатності речовини
знижувати поверхневу енергію, вона
називається поверхневою активністю й
позначається
,
за Ребиндером, є мірою здатності речовини
знижувати поверхневу енергію, вона
називається поверхневою активністю й
позначається
![]() .
Її розмірність – Н/м.
.
Її розмірність – Н/м.
В гомологічному ряду жирних кислот, спиртів і амінів зниження тим більше, чим довше ланцюг.
Згідно правила Дюкло-Траубе, при подовженні ланцюга на групу СН2 поверхнева активність зростає на межі розчин-повітря в 3-3,5 рази.
Для визначення цієї
характеристики будують залежність
![]() .
Використовуючи рівняння Гіббса, будують
залежність
.
Використовуючи рівняння Гіббса, будують
залежність
![]() .
.
Розглянемо
порядок побудови ізотерми адсорбції
і знаходження величин
![]() .
.
Ізотерма адсорбції описується рівнянням Ленгмюра:
![]() ,
(5.18)
,
(5.18)
де
![]() -
гранична концентрація речовини,
адсорбованої на 1 м2
поверхні, кмоль/м2;
-
гранична концентрація речовини,
адсорбованої на 1 м2
поверхні, кмоль/м2;
- константа рівноваги, рівна відношенню констант швидкостей процесів десорбції й адсорбції.
Знаючи Г можна розрахувати площу S, що приходиться на 1 молекулу.
Число адсорбованих молекул
на 1 м2
становить:
![]() .
Звідси:
.
Звідси:
![]() .
(5.19)
.
(5.19)
Зі збільшенням
![]() величина
зменшується і при
величина
зменшується і при
![]() досягає мінімального значення
досягає мінімального значення
![]() :
:
![]() .
(5.20)
.
(5.20)
Використовуючи
![]() ,
обчислюють товщину
насиченого поверхневого шару:
,
обчислюють товщину
насиченого поверхневого шару:
![]() ,
(5.21)
,
(5.21)
де
![]() -
молекулярна маса;
-
молекулярна маса;
- щільність адсорбованої речовини.
Будують ізотерму ПН (залежність від концентрації ПАР). За ізотермою ПН розраховують Г за рівнянням Гіббса. Для цього до кривої в декількох точках проводять дотичні до перетину їх з віссю ординат, проводячи також паралельні прямі до перетину з віссю ординат (рисунок 5.6).
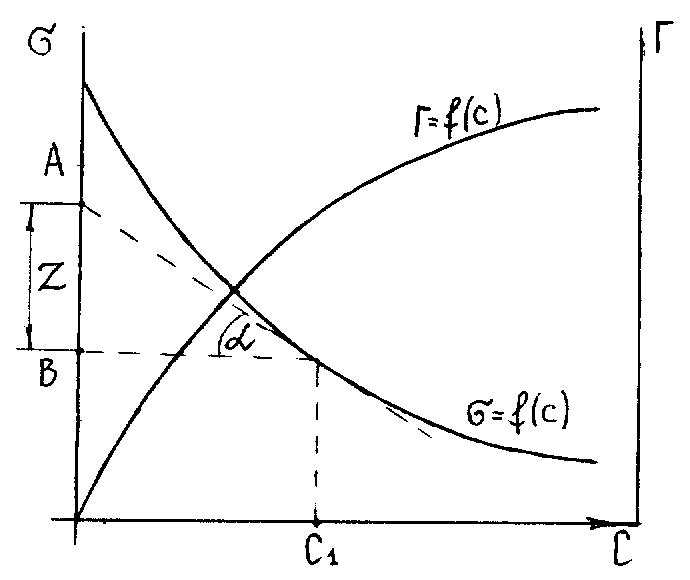
Рисунок 5.6 – Побудова ізотерми адсорбції за ізотермою поверхневого натягу
З трикутника
АВD находять
![]() або
або
![]() .
Находять декілька значень
.
Находять декілька значень
![]() для C1, C2, C3,…і будують
залежність
для C1, C2, C3,…і будують
залежність![]() .
.
Кожній концентрації С відповідає відрізок Z на осі ординат.
Довжина відрізка, виражена
в одиницях ПН є рівною:
![]() ,
оскільки згідно побудови
,
оскільки згідно побудови
![]() .
.
Підставивши одержані значення Z у рівняння:
, (5.22)
отримаємо:
![]() .
(5.23)
.
(5.23)
Використовуючи Z для ряду концентрацій, розраховують адсорбцію Г.
Будують ізотерму адсорбції, відкладаючи по вісі абсцис С, а по вісі ординат Г.
Де складно провести дотичну
(в інтервалі концентрацій 0,2-0,15 моль/л)
розраховують зміну:
![]() і
і
![]() та визначають
та визначають
![]() для середньої концентрації
0,1.
для середньої концентрації
0,1.
Дані заносять у таблицю:
|
|
|
|
|
|
|
|
|
|
Значення визначають графічно за рівнянням Ленгмюра, перетворивши його у рівняння прямої лінії (рисунок 5.7):
![]() .
(5.24)
.
(5.24)
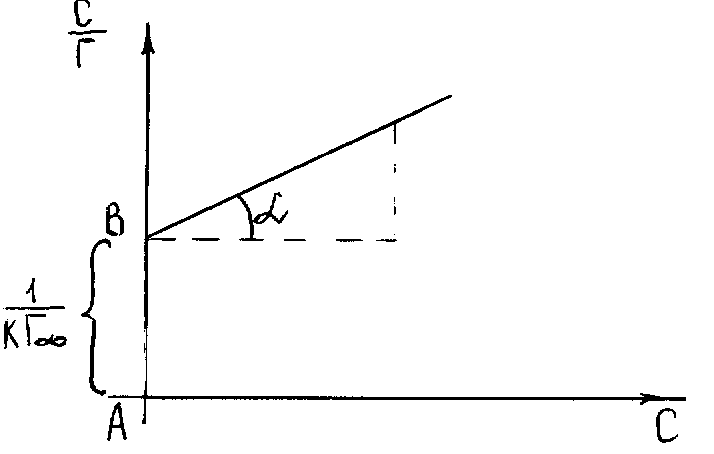
Рисунок 5.7 – Графік рівняння Ленгмюра в прямолінійних координатах
Кут
![]() на рисунку 5.7 дозволяє визначити
:
на рисунку 5.7 дозволяє визначити
:
![]() .
Відрізок
.
Відрізок
![]() .
З цього рівняння визначають
.
.
З цього рівняння визначають
.
![]() обчислюють за рівнянням:
обчислюють за рівнянням:
![]() .
(5.25)
.
(5.25)
обчислюють за рівнянням:
![]() .
(5.26)
.
(5.26)
5.2 Теорії адсорбції
5.2.1 Теорія мономолекулярної адсорбції Ленгмюра
В теорії Ленгмюра виходять з наступних положень:
- адсорбція є локалізованою і забезпечується силами, близькими до хімічних, такими Ленгмюр вважав усі сили, які забезпечують когезійну міцність речовини;
- адсорбція протікає на активних центрах поверхні;
- в результаті адсорбції утворюється мономолекулярний шар адсорбтиву на поверхні;
- адсорбція супроводжується десорбцією, тобто молекули можуть через час відриватись від поверхні. Їхнє місце займають нові молекули. Час перебування молекул адсорбтиву в адсорбованому стані залежить від температури.
Процес адсорбції представляється як утворення адсорбційного комплексу між адсорбентом й адсорбтивом:
адсорбтив + адсорбент адсорбційний
комплекс
Виходячи з наведених положень, Ленгмюр одержав рівняння адсорбції, яке має вигляд:
![]() ,
()5.27)
,
()5.27)
де - величина адсорбції;
- ємність адсорбційного моношару, або число адсорбційних центрів, що приходяться на одиницю площі поверхні або на одиницю маси адсорбенту.
Для сорбції газів і парів рівняння Ленгмюра має вигляд:
![]() .
(5.28)
.
(5.28)
Типову ізотерму адсорбції Ленгмюра показано на рисунку 5.8.
Г
Г

с (р)
Рисунок 5.8 – Ізотерма адсорбції Ленгмюра
Рівняння Ленгмюра перетворюють на рівняння прямої:
![]() .
(5.29)
.
(5.29)
Така залежність дозволяє графічно визначити обидва постійних параметра адсорбційної ізотерми. На рисунку 5.9 представлена типова ізотерма адсорбції в лінійних координатах.

![]()
![]()



![]()

Рисунок 5.9 - Ізотерма адсорбції Ленгмюра в прямолінійних координатах.
Екстраполяція залежності до
осі ординат дає відрізок, рівний
![]() ,
а тангенс кута нахилу прямої рівний
,
а тангенс кута нахилу прямої рівний
![]() .
.
Ізотерма адсорбції може мати ступінчастий вигляд, як показано на рисунку 5.10.
Г



Рисунок 5.10 - Ізотерма ступінчастої адсорбції
5.2.2 Ізотерма адсорбції Фрейндлиха
Фрейндлих - німецький фізико-хімік (1880-1941р.р.). Уявлення Ленгмюра ідеалізують і спрощують реальну картину адсорбції. В дійсності поверхня більшості адсорбентів неоднорідна й адсорбція не обмежується утворенням мономолекулярного шару, внаслідок чого рівняння адсорбції ускладнюється. Фрейндлих припустив, що адсорбція залежить від тиску і концентрації та запропонував емпіричне рівняння, яке має вигляд ступеневої функції:
![]() або
або
![]() ,
(5.30)
,
(5.30)
де - маса адсорбованої речовини, що приходиться на 1 г адсорбуючого матеріалу, г.;
- тиск;
- концентрація;
![]() і
- константи, які не мають фізичного сенсу
і відіграють роль підгінних коефіцієнтів.
Для більшості випадків
і
- константи, які не мають фізичного сенсу
і відіграють роль підгінних коефіцієнтів.
Для більшості випадків
![]() .
.
В логарифмічній формі рівняння має вигляд:
![]() ,
(5.31)
,
(5.31)
тобто сорбція виражається лінійною залежністю (рисунок 5.11).

Рисунок 5.11 - Ізотерми адсорбції Фрейндлиха
Нахил
прямої прямо пропорційний
![]() ,
на осі ординат відсікається відрізок,
рівний
,
на осі ординат відсікається відрізок,
рівний
![]() .
Пізніше радянський академік Я.Б.Зельдович
теоретично вивів рівняння, емпірично
запропоноване Фрейндлихом.
.
Пізніше радянський академік Я.Б.Зельдович
теоретично вивів рівняння, емпірично
запропоноване Фрейндлихом.
