
3. Моль/дм3
4. г/100 см3
151. Густина води при t = 4°С дорівнює:
1. 0,9982 г/см3
2. 1,0000 г/см3
3. 0,9973 г/см3
4. 1,0020 г/см3
152. Метод, заснований на вимірюванні маси речовини і маси води в одному і тому ж об’ємі, має назву:
1. Вестфаля-Мора
2. ареометричний
3. гідростатичного зважування
4. пікнометричний
153. Висушування пікнометра проводять:
1. спиртом і етером
2. у сушильній шафі
3. на повітрі
4. спиртовим розчином КОН
154. Ексикатор використовують для:
1. охолодження
2. термостатування
3. запобігання попаданню вологи в продукт
4. охолоджування, запобігання попаданню вологи
155. Метод інфрачервоного випромінювання відносять до:
1. експрес-метода
2. класичних методів
3. маркеровочних методів
4. арбітражних аналізів
156. Етиловий спирт у водних розчинах визначають методом:
1. фотометрії
2. поляриметрії
3. хроматографії
4. рефрактометрії
157. Безпосереднє рефрактометричне визначення етилового спирту можливо проводити для розчинів з концентрацією спирта:
1. 0-55%
2. 90-95%
3. 75-90%
4. 55-75%
158. При змішуванні однієї частини спирту та двох частин води коефіцієнт розведення дорівнює:
1. 2
2. 3
3. 4
4. 1
159. Налагодження рефрактометру проводять з використанням еталонної рідини:
1. дистильованої води
2. спирту
3. етеру
4. кислоти
160. Переваги рефрактометричного аналіза:
1. точність
2. простота, точність, швидкість, мінімальна кількість речовини, можливість автоматизації
3. мінімальна кількість речовини
4. автоматизація
161. До складу аміачного буфера входять:
1. NH3 + NH4Cl
2. NH3 + NaCl
3. H2O + NH3
4. NH4Cl + H2O
162. Хром (VI) у пробі визначають методом:
1. поляриметрії
2. рефрактометрії
3. потенціометрії
4. фотоколориметрії
163. Розрахункова формула при фотоколориметричному визначенні вмісту хрому (VI)методом порівняння в пробі стічної води (мг/дм3):
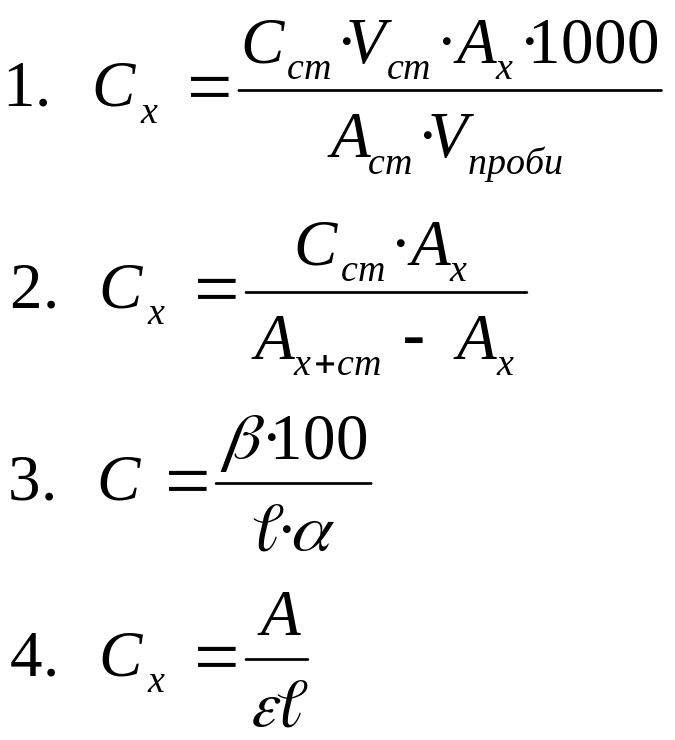
164. Сульфатну кислоту, при приготуванні стандартного розчину солі феруму ІІІ, використовують з метою:
1. розчинення солі
2. пригнічування гідролізу іонів Fe3+
3. ускорення гідролізу
4. утворення комплексів феруму (ІІІ)
165. Метод осадження (кип’ятіння води) проводять з метою:
1. збільшення кислотності середовища
2. іонного обміну
3. зв’язування іонів Са2+, Mg2+ в комплекси
4. усунення твердості води
166. Речовини, що мають здатність обмінювати власні катіони на катіони, які знаходяться у розчині, мають назву:
1. іоніти
2. сорбенти
3. катіоніти
4. аніоніти
167. Регенерування катіоніту проводять, використовуючи розчин:
1. натрію гідроксиду
2. хлоридної кислоти
3. натрію хлориду
4. калію хлориду
168. Аніонування води відносять до методів:
1. осадження
2. обезсолювання
3. комплесоутворення
4. іонного обміну
169. Хром (VI) утворює сполуки червоно-фіолетового кольору з дифеніл- карбазидом у середовищі:
1. кислому
2. лужному
3. нейтральному
4. сильно лужному
170. При визначенні хрому (VI) дифенілкарбазидним методом стабілізатором виступає:
1. хлоридна кислота
2. сульфатна кислота
3. фосфатна кислота
4. нітратна кислота
171. Дифенілкарбазидний метод використовують при концентрації хрому (VI):
1. 0,005 г/дм3 – 0,1 г/дм3
2. 0,5 г/дм3 – 5 г/дм3
3. 1 мг/дм3 – 10 мг/дм3
4. 0,005 мг/дм3 – 1 мг/дм3
172. При визначенні хрому (VI) дифенілкарбазидним методом домішку молібдену маскують:
1. 8-оксихиноліном
2. фосфорною кислотою
3. щавелевою кислотою
4. сульфатною кислотою
173. При приготуванні розчину дифенілкарбазиду (ω = 0,5%), останній розчиняють в:
1. спирті
2. хлороформі
3. оцтовій кислоті
4. спирті та оцтовій кислоті
174. При визначенні хрому (VI) дифенілкарбазидним методом кислотність розчину впливає на:
1. маскування домішок
2. руйнування забарвленого комплексу
3. інтенсивність забарвлення
4. зменшення концентрації солі хрому (VI)
175. Кислотність розчину, при визначенні хрому (VI) дифенілкарбазидним методом слід підтримувати до значення рН:
1. рН = 7
2. рН = 1
3. рН = 9
4. рН = 5
176. Рибофлавін добре розчинний у:
1. розчинах лугів
2. спирті
3. ацетоні
4. бензолі
177. 0,5% розчин рибофлавіну у водно-спиртовому розчині калію гідроксиду має питомий кут обертання:
1. від 110 до 130°
2. від 18 до 21°
3. від 50 до 53°
4. від 25 до 28°
178. Назва вітаміну В2 походить від:
1. кольору азобарвника
2. здатності до фруоресценції
3. утворення жовтого кольору при додаванні концентрованої сульфатної кислоти
4. залишку багатоатомного спирту, похідного цукру рибози, та кольору розчина вітаміна В2 (лат. Flavus – жовтий)
179. Забарвлення розчину рибофлавіну зникає при додаванні:
1. натрію гідросульфіту
2. натрію гідроксиду
3. сульфатної кислоти
4. натрію сульфату
180. Розчин рибофлавіну в УФ-світлі має флуоресценцію:
1. блакитну
2. зеленувато-жовту
3. рожеву
4. жовту
181. Метод, заснований на вимірюванні оптичної густини забарвленого розчину рибофлавіну, має назву:
1. рефрактометрія
2. поляриметрія
3. фотоколориметрія
4. потенціометрія
182. Титрантом метода алкаліметрії в аналізі рибофлавіна виступає стандартний розчин:
1. хлоридної кислоти
2. нітратної кислоти
3. натрію гідроксиду
4. сульфатної кислоти
183. Левоміцетин відносять до речовин:
1. оптично-активних
2. здатних до флуоресценції
3. групи гормонів
4. групи вітамінів
184. Оптична ативність левоміцетину зумовлена присутністю в молекулі:
1. двох асиметричних атомів карбону
2. нітрогрупи
3. угрупування -CH2OH
4. гідроксидної групи
185. 5% розчин левоміцетину в спирті має питоме обертання:
1. від +18 до +21°
2. від +15 до +20°
3. від -11 до 1 12,6°
4. від -18 до -21°
186. Фенолфталеїн застосовують як:
1. індикатор в ацидиметрії
2. індикатор в цериметрії
3. індикатор в алкаліметрії
4. індикатор в комплексонометрії
187. Для визначення кислотності середовища потенціометричним методом використовують індикаторний електрод:
1. Платиновий
2. Скляний
3. Хлорсрібний
4. Срібний
188. При фотометричному визначенні у воді хрому (VІ) використовують реагент:
1. Дифеніламін
2. Дифенілкарбазид
3. Хромотропову кислоту
4. Саліцилову кислоту
189. Для визначення у забарвленому розчині вмісту калію гідроксиду кислотно-основним методом з використанням потенціометричного титрування індикаторним електродом є:
1. Скляний
2. Срібний
3. Хлорсрібний
4. Платиновий
190. Для визначення в розчині іонів заліза (ІІ) перманганатометричним методом з використанням потенціометричного титрування індикаторним електродом є:
1. Скляний
2. Платиновий
3. Хлорсрібний
4. Срібний
191. Для кількісного визначення аніліну методом діазотування використовують зовнішній індикатор
1. Йодкрохмальний папірець
2. Лакмусовий папірець
3. Куркумовий папірець
4. Універсальний індикаторний папірець
192. Для ідентифікації левоміцетину визначають
1. показник заломлення
2. Питомий кут обертання
3. рН розчину
4. Питому електропровідність
193. Перманганатометричне визначення іонів феруму (ІІІ) проводять у середовищі
1. Лужному
2. Нейтральному
3. Кислому
4. Амоніачному
194. При прямому перманганатометричному методі індикатором є
1. фенолфталеїн
2. Крохмаль
3. Сам титрант
4. Метилоранж
195. Кількісне визначення бензойної кислоти проводять методом
1. Кислотно-основного титрування в неводному середовищі
2. Перманганатометрії в кислому середовищі
3. йодометрії
4. нітритометрії
196. Аналіз фенола методом броматометрії проводять у середовищі:
1. Нейтральному
2. Кислому
3. Амонійному
4. Лужному
197. Аналіз аніліну на вміст основної речовини проводять методом:
1. Дихроматометрії
2. Йодометрії
3. Перманганатометрії
4. Діазотування
198. Лікарський засіб, формула якого представлена, відноситься до:
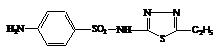
1. Сульфаніламідів
2. Вітамінів
3. Сполук піразолона
4. Алкалоїдів
199. Для кількісного визначення сульфадиметоксину нітритометричним методом з використанням потенціометричного титрування індикаторним електродом є:
1. Скляний
2. Платиновий
3. Срібний
4. Хлорсрібний
200. Для кількісного визначення рибофлавіну використовують метод
1. нефелометрії
2. Фотоколориметрії
3. Рефрактометрії
4. Потенціометрії
Розрахункові задачі
1. Розрахувати масу наважки Na2S2O3∙5H2O (M = 248 г/моль) для приготування 1 дм3 розчину, для якого С (Na2S2O3 ∙ 5H2O) ≈ 0,1 моль/дм3:
2,48 г 2. 24,8 г 3. 0,248 г 4. 248 г
2. На титрування досліджуваного розчину аніліну використали 10 см3 розчину натрій нітриту. Визначити вміст аніліну в пробі, якщо Т (NaNO2 / C6H5NH2) = 0,009349 г/см3:
0,9349 г 2. 0,09349 г 3. 0,0009349 г 4. 9, 3490 г
3. Для визначення аскорбінової кислоти методом йодометрії приготували стандартний розчин йоду з фіксаналу, С(1/2 I2) = 0,1 моль/дм3. Розрахувати TI2/С6Н8О6 , якщо М(1/2С6Н8О6) = 88,06 г/моль:
0,08806 г/см3 2. 0,0008806 г/см3 3. 0,8806 г/см3 4. 0,008806 г/см3
4. Розрахувати концентрацію стандартного розчину рибофлавіну (г/см3), якщо 0,0500 г рибофлавіну розчинили у мірній колбі місткістю 500 см3:
0,5∙10-3 г/см3 2. 0,1∙10-3 г/см3 3. 0,2∙10-3 г/см3 4. 1∙10-3 г/см3
5. Розрахувати ТK2Cr2O7, якщо C (1/6K2Cr2O7) = 0,1 моль/дм3, М (1/6K2Cr2O7) = = 49 г/моль:
0,004900 г/см3 2. 0,4900 г/см3 3. 0,0004900 г/см3 4. 0,04900 г/см3
6. 0,0500 г сульфадиметоксину (субстанція) розчинили в мірній колбі місткістю 100 см3. Розрахувати вміст сульфадиметоксину в мг/см3:
0,0500 2. 5,0000 3. 0,5000 4. 0,0050
7. С(1/2 H2SO4) = 0,09837 моль/дм3. Розрахувати коефіцієнт поправки (К):
9,8370 2. 0,009837 3. 0,9837 4. 0,09837
8. С(NaNO2) = 0,1038 моль/дм3. Розрахувати коефіцієнт поправки (К):
0,01038 2. 1,0380 3. 10,380 4. 0,1038
9. С(1/2I2) = 0,1 моль/дм3. К = 0,9915. Розрахувати практичну концентрацію розчину титранта:
0,09915 моль/дм3 3. 0,09915 г/дм3
2. 0,9915 моль/дм3 4. 0,009915 моль/дм3
10. Розрахувати масу наважки AgNO3 для приготування 1 дм3 розчину, де C(AgNO3) = 0,01 моль/дм3, М(AgNO3) = 170 г/моль:
17 г 2. 1,7 г 3. 0,170 г 4. 0,0170 г
11. Визначити карбонатну твердість води, якщо на титрування 100 см3 проби витратили 7,20 см3 стандартного розчину хлоридної кислоти. С(HCl) = 0,1 моль/дм3 (титрант приготували із фіксаналу).
7,20 ммоль/дм3 2. 0,72 ммоль/дм3 3. 7,20 моль/дм3 4. 7,20 г/дм3
