
1. 0,1 Моль/дм3
2. 2,480 г
3. 0,2480 г
4. 0,01240 г
50. Маса йоду в 1 дм3 розчину, де Се(1/2 І2) = 0,1 моль/дм3 дорівнює:
1. 127 г
2. 12,7 г
3. 1,27 г
4. 2,54 г
51. Окисні властивості має кислота:
1. хлоридна
2. сульфатна розведена
3. нітратна
4. фосфатна
52. Хлоридну кислоту в розчині визначають методом:
1. дихроматометрії
2. ацидиметрії
3. алкаліметрії
4. трилонометрії
53. Натрію гідроксид в розчині визначають методом:
1. алкаліметрії
2. ацидиметрії
3. аргентометрії
4. трилонометрії
54. рН розчину сульфатної кислоти, де Се(1/2H2SO4) = 0,01 моль/дм3 становить:
1. 1
2. 2
3. 0
4. 3
55. рОН розчину натрію гідроксиду, де Се(NaOH) = 0,001 моль/дм3 становить:
1. 3
2. 11
3. 1
4. 4
56. рН розчину калію гідроксиду , де Се(КОН) = 0,1 моль/дм3 становить:
1. 1
2. 13
3. 14
4. 7
57. рН = 0. Надайте характеристику середовища:
1. лужне
2. кисле
3. дуже кисле
4. нейтральне
58. При визначенні сульфатної кислоти методом алкаліметрії використовують титрант:
1. хлоридну кислоту
2. нітратну кислоту
3. натрію гідроксид
4. калію дихромат
59. При визначенні натрію гідроксиду методом ацидиметрії використовують титрант:
1. ЕДТА
2. хлоридну кислоту
3. калію гідроксид
4. аргентуму нітрат
60. При визначенні кислоти в розчині методом алкаліметрії використовують індикатори:
1. кислотно-основні
2. металоіндикатори
3. адсорбційні
4. редокс-індикатори
61. При визначенні лугів в розчині методом ацидиметрії використовують індикатори:
1. редокс-індикатори
2. адсорбційні
3. металоіндикатори
4. кислотно-основні
62. При титруванні розчину сильної кислоти стандартним розчином лугу рН в точці еквівалентності становить:
1. 10,0
2. 7,0
3. 4,0
4. 3,8
63. Інтервал рН переходу кольору метилового оранжевого становить:
1. 4,2-6,2
2. 8,2-10,0
3. 3,1-4,4
4. 5,0-8,0
64. Інтервал рН переходу кольору метилового червоного становить:
1. 8,2-10,0
2. 4,2-6,2
3. 5,0-8,0
4. 3,1-4,4
65. В основі нітритометричного метода аналізу ароматичних амінів лежить реакція:
1. утворення осаду
2. кислотно-основної взаємодії
3. бромування
4. діазотування
66. Титрантом метода нітритометрії є стандартний розчин:
1. натрію нітрату
2. натрію нітриту
3. аргентуму нітрат
4. нітратна кислота
67. Суміш реактивів, які необхідні для виконання якісної реакції на первинні ароматичні аміни:
1. Хлоридна кислота, β-нафтол
2. натрію нітрит, хлоридна кислота
3. натрію нітрит, хлоридна кислота, β-нафтол, натрію гідроксид
4. нітритна кислота, β-нафтол, натрію гідроксид
68. Реакція діазотування відбувається в середовищі:
1. кислому
2. лужному
3. нейтральному
4. сильнолужному
69. Каталізатором реакції діазотування є:
1. хлоридна кислота
2. натрію нітрит
3. калію бромід
4. калію йодид
70. Стандартизацію натрію нітриту проводять, використовуючи первинний стандарт:
1. сульфанілову кислоту
2. ацетилсаліцилову кислоту
3. калію перманганат
4. саліцилову кислоту
71. Реакція діазотування протікає за умовами:
1. підвищеної температури
2. підвищеного тиску
3. зниженого тиску
4. зниженої температури
72. До внутрішніх індикаторів метода нітритометрії відносять:
1. еозин
2. лакмус
3. тропеолін ОО
4. мурексид
73. Йодкрохмальний папір відносять до індикаторів:
1. кислотно-основних
2. метало-індикаторів
3. внутрішніх
4. зовнішніх
74. Індикаторним електродом при потенціометричному титруванні аніліну розчином натрію нітрату є:
1. платиновий
2. скляний
3. хлорсрібний
4. іон-селективний
75. На йодкрохмальному папері (метод нітритометрії) відбувається реакція поміж хімічними речовинами:
1. І2 + NaNO2 + HCl
2. KI + NaNO2 + HCl
3. анілін + NaNO2 + HCl
4. крохмаль + NaNO2 + HCl
76. Загальна формула сульфаніламідних препаратів:

77. Сульфаніламідні препарати мають пролонговану дію за рахунок угрупування:
1. –NH2
2. –SO2NH2
3. –OCH3
4. –СН3
78. Пролонговану дію мають сульфаніламідні засоби:
1. норсульфазол
2. сульфадимезин
3. стрептоцид
4. сульфадиметоксин
79. Кислотні властивості сульфаніламідних засобів обумовлені наявністю:
1. гідрогену в аміногрупі
2. гідрогену в сульфамідній групі
3. гідрогену в метоксігрупі
4. гідрогену ароматичного ядра
80. Основні властивості сульфаніламінів обумовлені наявністю:
1. аміногрупи
2. сульфогрупи
3. імідної групи
4. сульфамідної групи
81. Сульфаніламіди реагують з катіонами важких металів за рахунок:
1. гідрогену в аміногрупі
2. гідрогену в метоксігрупі
3. гідрогену в сульфамідній групі
4. гідрогену ароматичного ядра
82. Молярна маса еквівалента сульфадимезину при визначенні методом броматометрії дорівнює:
1. Мм
2. ¼ Мм
3. ½ Мм
4. 1/3 Мм
83. Реакція діазотування сульфаніламідів відбувається за рахунок угрупування:

2. –СН3
3. –OCH3
4. –NH2
84. Тип реакції діазотування сульфаніламідів:
1. окисно-відновна
2. реакція заміщення
3. реакція нейтралізації
4. автокаталітична
85. Загальна якісна реакція на сульфаніламідні препарати протікає з утворенням:
1. солі діазонія
2. азобарвника
3. блакитного барвника
4. ауринового барвника
86. Для ідентифікації сульфадимезину використовують реакцію взаємодії з солями важких металів:
1. CuSO4
2. FeCl3
3. CoCl2
4. CdSO4
87. Для ідентифікації сульфадиметоксину використовують реакцію взаємодії з солями важких металів:
1. CdSO4
2. CoCl2
3. FeCl3
4. CuSO4
88. Лікарський засіб, формула якого представлена, має назву:
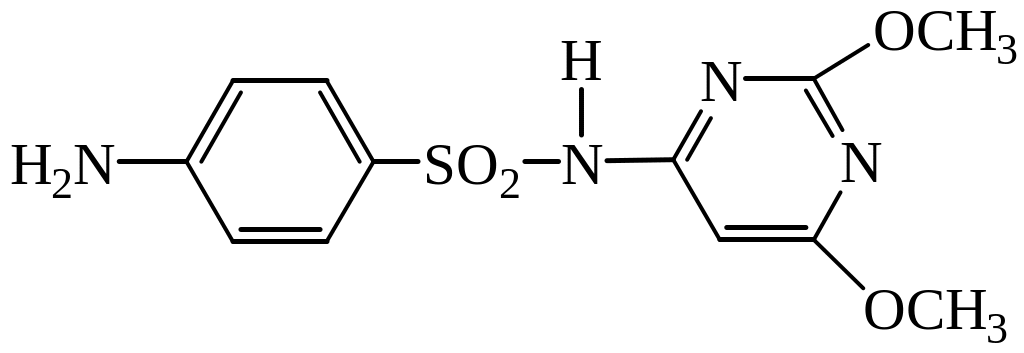
1. норсульфазол
2. сульфадимезин
3. сульфален
4. сульфадиметоксин
89. Аналітичні прийоми, які використовуються при визначенні фенолу методом броматометрії:
1. метод прямого титрування
2. метод зворотнього титрування; метод заміщення
3. метод заміщення
4. метод подвійного зворотнього титрування
90. Для одержання брому у розчині використовують суміш:
1. β-нафтол, натрію гідроксид
2. калію іодид, хлоридна кислота
3. калію бромід, хлоридна кислота
4. бромід калію, бромат калію, хлоридна кислота
91. Для проведення ідентифікації фенола використовують:
1. хлорид феруму (ІІІ)
2. срібла нітрат
3. натрію нітрат
4. хлоридну кислоту
92. Розчин фенолу з бромною водою утворює осад:
1. оранжевий
2. білий
3. жовтий
4. червоний
93. Розчин фенолу з нейтральним розчином FeCl3 дає забарвлення:
1. червоне
2. синьо-фіолетове
3. оранжево-червоне
4. блакитне
94. Похідні ароматичних вуглеводів, що містять у молекулі одну або декілька гідроксидних груп, безпосередньо пов’язаних з ароматичним ядром, мають назву:
1. кислоти
2. альдегіди
3. феноли
4. кетони
95. Лікарський засіб, формула якого представлена, має назву:

1. пірогалол
2. пірокатехін
3. гідрохінон
4. резорцин
96. Молекулярна маса еквівалента фенолу, при визначені методом броматометрії, дорівнює:
1. Мм
2. ½ Мм
3. 1/3 Мм
4. 1/6 Мм
97. Надлишок брому в розчині підтверджує:
1. блакитне забарвлення розчину
2. жовте забарвлення розчину
3. темно-буре забарвлення розчину
4. безкольоровий розчин
98. Контрольний (холостий) дослід виконують з метою зменшення похибок:
1. абсолютної та відносної
2. реактивної
3. психологічної
4. випадкової
99. Калію бромід та калію бромат реагують у середовищі:
1. нейтральному
2. лужному
3. кислому
4. сильно-лужному
100. Для визначення залишку брома в розчині методом йодометрії використовують аналітичний прийом:
1. пряме титрування
2. зворотнє титрування
3. подвійне зворотнє титрування
4. метод заміщення
101. Для визначення залишку брома в розчині використовують метод:
1. перманганатометрії
2. йодометрії
3. дихроматометрії
4. нітритометрії
102. При визначенні фенолу методом броматометрії йодид калію додають з метою одержання еквівалентної кількості речовини:
1. брома
2. йода
3. фенола
4. калію йодата
103. При бромуванні фенола утворюється речовина:
1. бромфенол
2. дибромфенол
3. трибромфенол
4. бромфенолйод
104. Хімічна сполука, формула якої представлена має назву:

1. виноградна кислота 2. винна кислота
3. лимонна кислота 4. яблучна кислота
105. Вміст лимонної кислоти у лимонах становить:
1. 6-7%
2. 90-95%
3. 0,1-0,2%
4. 50-55%
106. Лимонна кислота відноситься до кислот:
1. двоосновних
2. одноосновних
3. трьохосновних
4. чотирьохосновних
107. Кількісний аналіз лимонної кислоти проводять методом:
1. алкаліметрії
2. ацидиметрії
3. комплексонометрії
4. аргентометрії
108. При визначенні лимонної кислоти методом кислотно-основного титрування використовують індикатор:
1. метиловий оранжевий
2. метиловий червоний
3. фенолфталеїн
4. лакмус
109. рН в точці еквівалентності при визначенні лимонної кислоти становить:
1. рН ≈ 9
2. рН > 7
3. рН = 7
4. рН = 1
110. Молярна маса еквівалента лимонної кислоти при визначенні методом алкаліметрії дорівнює:
1. Мм
2. ½ Мм
3. 1/3 Мм
4. ¼ Мм
111. Лимонну кислоту відносять до класу органічних сполук:
1. карбонових кислот ароматичного ряду
2. ненасичених карбонових кислот
3. оксикарбонових кислот
4. амінокарбонових кислот
112. При визначенні лимонної кислоти методом алкаліметрії використовують прийом:
1. пряме титрування
2. метод заміщення
3. метод зворотнього титрування
4. метод подвійного зворотнього титрування
113. При визначенні лимонної кислоти потенціометричним методом використовують індикаторний електрод:
1. платиновий
2. скляний
3. хлорсрібний
4. каломельний
114. При потенціометричному визначенні лимонної кислоти на кривій титрування спостерігаються стрибки:
1. один
2. два
3. чотири
4. три
115. Лікарський засіб, формула якого представлена, має назву:

1. левоміцетин
2. фурацилін
3. сульфален
4. сульфадимезин
116. Аскорбінову кислоту в аскорбінометрії використовують як титрант, тому що вона має властивості:
1. окисні
2. відновні
3. кислотні
4. слабкого електроліту
117. Аскорбінова кислота не реагує з хімічними речовинами:
1. KIO3
2. KMnO4
3. KI
4. AgNO3
118. В якісній реакції з аргентуму нітратом аскорбінова кислота виявляє властивості:
1. окисні
2. відновні
3. кислотні
4. вітамінні
119. Для кількісного визначення вітаміна С використовують метод алкаліметрії, тому що вітамін С є:
1. окисником
2. кислотою
3. відновником
4. лугом
120. В методі алкаліметрії при визначенні вітаміну С використовують індикатор:
1. фенолфталеїн
2. метиловий червоний
3. лакмус
4. метиловий оранжевий
121. Молярна маса еквівалента аскорбінової кислоти в методі алкаліметрії дорівнює:
1. Мм
2. ½ Мм
3. ¼ Мм
4. 1/3 Мм
122. Аскорбінову кислоту відносять до вітамінів ряду:
1. аліфатичного
2. аліциклічного
3. ароматичного
4. гетероциклічного
123. Вітамін С має хімічну формулу:

Кислотний характер вітаміну С обумовлен атомом гідрогену гідроксільної групи в положенні:
1. 2
2. 3
3. 5
4. 6
124. Аскорбінова кислота є оптично-активною речовиною за рахунок асиметричних атомів карбону в положенні:
1. С2, С3
2. С3, С4
3. С5, С6
4. С1, С2
125. Основні хімічні властивості і фізіологічна активність аскорбінової кислоти обумовлена угрупуванням:

126. В методі йодатометрії при визначенні аскорбінової кислоти використовують розчин титранта:
1. KIO3
2. I2
3. KIO4
4. KI
127. Визначення аскорбінової кислоти йодатометричним методом проводять у середовищі:
1. лужному
2. кислому
3. нейтральному
4. дуже лужному
128. В методі йодатометрії використовують індикатор:
1. крохмаль
2. еозин
3. тропеолін 00
4. мурексид
129. Молярна маса еквівалента аскорбінової кислоти при визначенні методом йодатометрії дорівнює:
1. 1/3 Мм
2. ¼ Мм
3. ½ Мм
4. Мм
130. В методі йодатометрії додають в розчин калію йодид з метою:
1. для підвищення відновних властивостей аскорбінової кислоти
2. для підвищення іонної сили розчину
3. утворення вільного йоду в точці еквівалентності
4. для зменшення відновних властивостей аскорбінової кислоти
131. Молярна маса еквівалента калію йодата в методі йодатометрії дорівнює:
1. 1/5 Мм
2. Мм
3. ½ Мм
4. 1/6 Мм
132. При визначенні аскорбінової кислоти методом кислотно-основного потенціометричного титрування використовують індикаторний електрод:
1. срібний
2. платиновий
3. скляний
4. хлорсрібний
133. При визначенні аскорбінової кислоти окисно-відновними методами з використанням потенціометричного титрування індикаторним електродом є:
1. платиновий
2. скляний
3. каломельний
4. срібний
134. Ідентифікація левоміцетину проводять методом:
1. рефрактометрії
2. поляриметрії
3. фотоколориметрії
4. флуориметрії
135. Проба, що характеризує кількість продукту в одному тарному місці або на певному рівні, має назву:
1. аналітична 2. Середня 3. Контрольна 4.індивідуальна
136. Температурний інтервал при визначенні температури плавлення для чистих речовин лежить у межах:
1. 2-3°С
2. 0,5-1°С
3. 1-2°С
4. 2-5°С
137. При визначенні температури кипіння круглодонну колбу заповнюють:
1. спиртом
2. водою
3. нітратною кислотою
4. гліцерином
138.Арбітражні аналізи виконуються:
1. третьою незацікавленою стороною
2. підприємством споживачем
3. підприємством постачальником
4. цеховою лабораторією
139.При обробці та поділу проб сита використовують з метою:
1. перемішування
2. скорочення
3. просіювання
4. квартування
140. Температура, при якій пружність пари рідини дорівнює зовнішньому атмосферному тиску, має назву:
1. температура плавлення
2. температура кипіння
3. температура розкладання
4. температура твердіння
141. Температура, при якій речовина з твердого стану переходить у рідкий, має назву:
1. температура кипіння
2. температура розкладання
3. температура плавлення
4. температура твердіння
142. Температура кипіння характеризує:
1. склад речовини
2. чистоту речовини
3. кількість речовини
4. розчинність речовини
143. Операції, які необхідно виконати при приготуванні проби речовини до визначення температури плавлення:
1. висушування
2. перегонки, випарювання
3. випарювання
4. перекристалізація, висушування, подрібнення
144. Умови, які впливають на температуру кипіння:
1. температура приміщення, тиск
2. температура приміщення
3. зовнішній тиск
4. густина дослідної речовини
145. Параметри нормальних умов:
1. t = 25°С, P = 101325 Па
2. t = 25°С, P = 99058 Па
3. t = 0°С, P = 101325 Па
4. t = 4°С, P = 103925 Па
146. Метод, яким визначають густину дослідного розчину з точністю 0,0002г/см3 має назву:
1. ареометричний
2. гідростатичний
3. пікнометричний
4. Вестфаля-Мора
147. До фізичних методів визначення вологи відносять:
1. нітридний метод
2. інфрачервоного випромінювання
3. титрування з реактивом Фішера
4. карбідний метод
148. Метод, заснований на здатності води поглинати інфрачервоне випромінювання, має назву:
1. азеотропна дистиляція
2. висушування
3. зміни електропровідності
4. інфрачервоне випромінювання
149. Густиною речовини називають:
1. масу одного моля
2. масу одиниці об’єму
3. об’єм одиниці маси
4. об’єм одного моля
150. Одиниці вимірювання густини:
1. г/моль
2. г/см3 · кг/дм3
