
- •Хімічні властивості неметалів
- •Фізичні властивості неметалів
- •Застосування неметалів
- •2 Фізичні властивості оксидів Сульфуру
- •Хімічні властивості оксидів Сульфуру
- •Застосування сульфур(іv) оксиду та сульфітів
- •Застосування сульфур(vі) оксиду
- •Хімічні властивості
- •Хімічні властивості[ред. • ред. Код]
- •Добування аміаку[ред. • ред. Код]
- •Застосування[ред. • ред. Код]
- •Виробництво в Україні[ред. • ред. Код]
- •Фізичні властивості
- •7_Нітроген оксиди і фосфор оксиди
- •Фізичні властивості
- •Хімічні властивості
- •Одержання
- •Застосування
- •Харчова промисловість
- •Фізичні властивості ортофосфатної кислоти
- •Добрива
- •Одержання
- •Хімічні властивості
- •Отруйність
- •Як захиститися від небезпеки
- •Утворення в технологічних процесах.
- •Загальний опис[ред. • ред. Код]
- •Використання
- •Карбонатна кислота
- •Карбонати та гідрокарбонати
- •Силікатна кислота
- •Одиниці вимірювання
- •Способи усунення твердості води[ред. • ред. Код]
- •Місце металів у періодичній системі хімічних елементів. Металічний хімічний зв'язок. Загальні фізичні властивості металів
- •Класифікація
Застосування сульфур(vі) оксиду
Цю сполуку використовують для виробництва сульфатної кислоти та олеуму.
3Сульфатна кислота
Сульфатна кислотасполука сірки з формулою H2SO4.Безбарвна масляниста, дуже в'язка і гігроскопічна рідина.Сірчана кислота одна з найсильніших неорганічних кислот і є дуже їдкою та небезпечною. Ця кислота утворює два ряди солей:сульфати і гідрогенсульфати, в яких у порівнянні з сульфатною кислотою замінюються один або два атомигідрогену на катіони металів.Сірчана кислота є однією з найважливіших технічних речовин у світі і лідирує за кількістю виробництва.Вона в основному використовується для виробництва добрив і інших неорганічних кислот. В основному використовуються водні розчини цієї кислоти.
Фізичні властивості
Майже вся 99% сірчана кислота втрачає SO3 при кипінні з утворенням 98,3% кислоти. 98% кислота є стабільнішою при зберіганні, і зазвичай також називається концентрованою. Інші концентрації використовуються для різних цілей. Дані про різні концентрації:
Масова частка H2SO4 |
Щільність (кг/л) |
Концентрація (моль/л) |
Назва |
10% |
1,07 |
~1 |
Розведена сульфатна кислота |
29-32% |
1,25-1,28 |
4,2-5 |
акумуляторна кислота (використовується в свинцево-кислотних акумуляторних батареях) |
62-70% |
1,52-1,60 |
9,6-11,5 |
Фотопаратна кислота Добривна кислота |
78-80% |
1,70-1,73 |
13,5-14 |
Вежова кислота Гловерова кислота |
95-98% |
1,83 |
~18 |
Концентрована сульфатна кислота |
Хімічно чиста сульфатна кислота являє собою важку безбарвну маслянисту рідину. Продається звичайно її 96,5% — ий водний розчин густиною 1,84 г/см3або так званий «олеум», тобто розчин SO3 в H2SO4. У воді H2SO4 розчиняється дуже добре (змішується з водою в необмежених кількостях). При цьому виділяється тепло, і розчин дуже сильно нагрівається (навіть до кипіння води). Тому при додаванні води до концентрованої сульфатної кислоти остання розбризкується внаслідок швидкого перетворення води в пару. Через це при розведенні концентрованої H2SO4 треба кислоту вливати у воду (а не навпаки!) тонким струменем при старанному розмішуванні розчину скляною паличкою. Концентрована сульфатна кислота як і чиста вода погано проводить струм внаслідок малої дисоціаціїї, питома електропровідність 1,044 · 10−2 S/см
Хімічні властивості
Дисоціація у водному розчині йде в декілька етапів:
![]()
Перший етап дисоціації;K2 = 2.4 x 106 (сильна кислота)
Це значення кислотності взяте як основне при визначені суперкислот.
![]()
Друга стадія дисоціаціїї;K1 = 1.0 x 10−2
Сульфатна кислота руйнує також багато органічних речовин, зокрема вуглеводи — дерево, папір, бавовняні тканини,цукор тощо. Руйнування цих речовин обумовлюється тим, що концентрована сульфатна кислота віднімає від них воденьі кисень у вигляді води, а вуглець залишається у вигляді пористого вугілля. При дії розведеної сульфатної кислоти наметали, які у електрохімічному ряді активності металів розташовані ліворуч водню, виділяється водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна реагувати, при нагріванні, навіть з благородними металами, такими як мідь, ртуть і срібло, хоча при цьому вона не взаємодіє з залізом. Тому для перевезення концентрованої сульфатної кислоти використовуються залізні цистерни.
![]()
Реакція міді з концентрованою сульфатною кислотою
Якісна реакція на сульфат-іон
В аналітичній хімії використовують реакцію взаємодії хлориду або нітрату Барію із утворенням барій сульфату. При цьому утворюється білий дрібнокристалічний осад, який не розчиняється в кислотах та лугах:
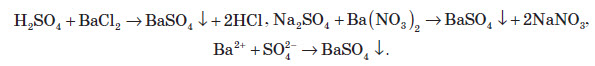
Отриманий осад розчиняється тільки в концентрованій сульфатній кислоті:
«Якісною реакцією на сульфатну кислоту і її солі є взаємодія їх із розчинами барій хлориду, або барій нітрату. У результаті реакції утворюється білий осад BaSO4, який практично не розчиняється ні у воді, ні в нітратній кислоті. Таким чином, реактивом на сульфат-іони є йони барію».
Взаємодія сірчаної кислоти з металами
Розбавлена і концентрована сірчані кислоти поводяться по-різному. Розбавлена сірчана кислота поводиться, як звичайна кислота. Активні метали, що стоять у ряді напруг лівіше водню
Li, До, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
витісняють водень з розбавленої сірчаної кислоти. Ми бачимо бульбашки водню при додаванні розведеної сірчаної кислоти в пробірку з цинком.
H2SO4 + Zn = Zn SO4 + H2 ↑
Мідь стоїть у ряду напруг після водню - тому розбавлена сірчана кислота не діє на мідь. Як поведуться цинк і мідь в концентрованої сірчаної кислоти?
Цинк, як активний метал, може утворювати з концентрованою сірчаною кислотою сірчистий газ, елементарну сірку, і навіть сірководень.
2H2SO4 + Zn = SO2 ↑ + ZnSO4 + 2H2O
Мідь - менш активний метал. При взаємодії з концентровано сірчаною кислотою відновлює її до сірчистого газу.
2H2SO4 конц. + Cu = SO2 ↑ + CuSO4 + 2H2O
Отже, в пробірках з концентрованою сірчаною кислотою ми спостерігаємо виділення сірчистого газу.
Значення сульфатної кислоти і сульфатів у народному господарстві
Сульфатна кислота є важливим продуктом хімічної промисловості, яка займається виробництвом кислот, лугів, солей, мінеральних добрив, хлору.
За різноманітністю застосування сульфатна кислота посідає перше місце. Найбільша її кількість витрачається для добування фосфатних і нітратних добрив. Як нелетка кислота, вона використовується для добування інших кислот - соляної, плавікової, ортофосфатної, оцтової та інших. Багато її витрачається на очищення нафтопродуктів - бензину, гасу і мастил - від шкідливих домішок. У машинобудуванні сульфатною кислотою очищають поверхню металу від оксидів, барвників, пластмас. Її використовують для заряджання акумуляторів. У сільському господарстві вона використовується як гербіцид.
Сульфатна кислота як двохосновна утворює дві групи солей: середні, що називаються сульфатами, і кислі, що називаєтьсягідроген сульфатами. Сульфати утворюються при повній нейтралізації кислоти лугом, коли луг береться у надлишку. Гідроген сульфати утворюються при недостачі лугу.
Багато солей сульфатної кислоти мають велике практичне значення. Наведемо найважливіші з них.
Натрій сульфат Na2SO4. З водних розчинів кристалізується їїNa2SO4 · 10H2O, який називається глауберовою сіллю. Глауберова сіль застосовується в медицині. Безводний натрій сульфат використовується у виробництві соди і скла.
Сульфат калію і амонію використовуються як добрива.
Сульфат барію BaSO4 застосовують у виробництві паперу, гуми та білої мінеральної фарби, а також у медицині для рентгеноскопії шлунку.
Серед сульфатів велике практичне значення мають купороси.Купороси - це технічна назва кристалогідратів сульфатів деяких важких металів (міді, заліза, цинку, магнію), тобто це солі, кристали яких містять кристалізаційну воду. Купороси використовуються в сільському господарстві для боротьби зі шкідниками рослин, у виробництві фарб, для просочення деревини як антисептичний засіб
4)Виробництво сульфатноъ кислоти
Сировиною для виробництва сірчаної кислоти є елементарна сірка яку отримують в величезних кільскостях на нафто- тагазовопереробних заводах, з сірководню, за допомогою процесу, який відомий як процес Клауса. Потім сірку оксилюють до діоксиду сірки:
![]()
Реакція сірки з киснем
Ще одним джерелом діоксиду сірки є виплавлення руд, що містять сірку. Прикладами є мідні, цинкові і свинцові сульфіди. Діоксид сірки утворюється при випаленні з киснем повітря.
![]()
Реакція під час випалу сульфіду цинку
У 1999 році в Європі було випалено близько 3 млн тонн піриту для виробництва сульфатної кислоти. В Азії ця цифра більша, оскільки і запаси його більші.[4] Для бідних ресурсами країнах, які не мають ні сірки, ні сульфідних руд, існує процес Мюллера-Кюне. В цьому процесі діоксид сірки утворюється при випаленні гіпсу і вугілля в печі. Цей процес можна зробити прибутковішим, якщо в піч додавати пісок і глину для утворення цементу як побічного продукту. Для подальшого виробництва потребується сірчаний ангідрид. Прямої реакції діоксиду сірки і кисню в триоксид сірки не існує, так як рівновага лежить на стороні триоксида сірки. Тому для проведення цієї реакції потрібні каталізатори.
![]()
Окиснення діоксиду сірки до триоксиду
Триоксид сірки не розбавляється у воді відразу ж. Спочатку його вводять у концентровану сірчану кислоту, цей розчин називають — олеумом. Потім олеум розчиняють у воді до утворення сірчаної кислоти.
![]()
Розчинення сірчаного ангідриту в концентрованій сірчаній кислоті з утворення дисульфатної кислоти
![]()
Розчинення дисульфатної кислоти у воді
В останні роки виробництво сірчаної кислоти зросло в основному в Китаї, у той час як в європейських країнах, виробництво скоротилося.
5)Будова молекули аміаку
Аміа́к, амоніа́к, NH3 — неорганічна сполука, безбарвний газ із різким задушливим запахом, легший за повітря, добре розчинний у воді. Одержують каталітичним синтезом з азоту і водню під тиском. Використовують переважно для виробництва азотних добрив, вибухових речовин і азотної кислоти. Рідкий аміак використовується в холодильних установках. Водний розчин аміаку (нашатирний спирт) застосовується в медицині.
Фізичні властивості[ред. • ред. код]
Аміак — безбарвний газ з характерним різким запахом і їдким смаком. Він майже у два рази легший від повітря. При −33,35°С і звичайному тиску аміак скраплюється в безбарвну рідину, а при −77,75 °C замерзає, перетворюючись у безбарвну кристалічну масу. Його зберігають і транспортують у рідкому стані в стальних балонах під тиском 6—7 атм.
У воді аміак розчиняється дуже добре: при 0°С і звичайному тиску в 1 об'ємі води розчиняється близько 1200 об'ємів NH3, а при 20°С — 700 об'ємів. Концентрований розчин містить 25% NH3 і має густину 0,91 г/см3. Розчин аміаку у воді називають аміачною водою або нашатирним спиртом. Звичайний медичний нашатирний спирт містить до 10%: NH3, амічна вода від 10% і більше. При нагріванні розчину аміак легко випаровується.
