
- •Хімічні властивості неметалів
- •Фізичні властивості неметалів
- •Застосування неметалів
- •2 Фізичні властивості оксидів Сульфуру
- •Хімічні властивості оксидів Сульфуру
- •Застосування сульфур(іv) оксиду та сульфітів
- •Застосування сульфур(vі) оксиду
- •Хімічні властивості
- •Хімічні властивості[ред. • ред. Код]
- •Добування аміаку[ред. • ред. Код]
- •Застосування[ред. • ред. Код]
- •Виробництво в Україні[ред. • ред. Код]
- •Фізичні властивості
- •7_Нітроген оксиди і фосфор оксиди
- •Фізичні властивості
- •Хімічні властивості
- •Одержання
- •Застосування
- •Харчова промисловість
- •Фізичні властивості ортофосфатної кислоти
- •Добрива
- •Одержання
- •Хімічні властивості
- •Отруйність
- •Як захиститися від небезпеки
- •Утворення в технологічних процесах.
- •Загальний опис[ред. • ред. Код]
- •Використання
- •Карбонатна кислота
- •Карбонати та гідрокарбонати
- •Силікатна кислота
- •Одиниці вимірювання
- •Способи усунення твердості води[ред. • ред. Код]
- •Місце металів у періодичній системі хімічних елементів. Металічний хімічний зв'язок. Загальні фізичні властивості металів
- •Класифікація
Хімічні властивості оксидів Сульфуру
Реакції без зміни ступеня окиснення
Ангідриди кислот — це речовини, які при взаємодії з водою утворюють відповідну кислоту. Таким чином, SO2 та SO3 — це ангідриди сульфітної та сульфатної кислот, відповідно:
![]()
Обидві речовини є кислотними оксидами, тобто реагують із основами:
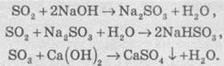
З основними оксидами:
![]()
При розчиненні SO3 у сульфатній кислоті утворюється олеум:
![]()
Олеум — це важливий продукт хімічної промисловості. Його використовують у виробництві лакофарбових та гумо-технічних виробів, для очищення нафти.
Сульфітна кислота
Сульфітна кислота є дуже нестійкою й існує тільки у водному розчині. При виділенні з розчину вона розкладається на сульфітний ангідрид та воду.
Сульфітна кислота досить слабка (Ка1 = 2 ∙ 10-2, Ка2 = 6 ∙ 10-8). Дисоціація кислоти відбувається за такою схемою:
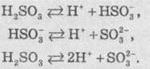
Сульфітна кислота утворює два ряди солей: середні (сульфіти) та кислі (гідрогенсульфіти). При нагріванні сульфіти лужних і лужноземельних металів диспропорціонують:
![]()
Сульфіти менш активних металів розкладаються на оксиди:
![]()
Більш сильні кислоти легко витісняють її із солей і розкладають на сульфур діоксид та воду:
![]()
Сульфіти лужних металів при сплавлянні із сіркою утворюють нову сполуку — тіосульфат:
![]()
Різниця між сульфатом і тіосульфатом полягає в тому, що один з атомів Оксигену сульфат-іона замінений атомом Сульфуру. Виходить, що в iоні тіосульфату один атом Сульфуру перебуває в ступені окиснення +6, а інший у ступені окиснення -2.
Реакції зі зміною ступеня окиснення
При нагріванні суміші сульфур(ІV) оксиду та кисню над каталізатором ванадій(V) оксидомV2O5 можна добути сульфур(VІ) оксид:
![]()
Сульфітна кислота и сульфур діоксид легко окислюються сильними окисниками:
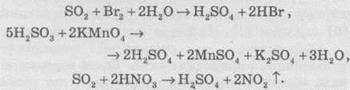
Останню реакцію використовують у промисловості при нітрозному методі добування сульфатної кислоти.
Сульфур Добування утворює два кислотні оксиди: оксид сульфуру (ІV) S02 і оксид сульфуру(VI) S03. Різний кількісний склад молекул (і різна їхня будова) зумовлюють відмінні властивості цих речовин.
Оксид сульфуру (IV) добувають спалюванням сірки, a також як побічний продукт випалювання сульфідних руд кольорових металів, наприклад:
S + O2 = SO2↑
2Pb + 3O2 = 2PbO + 2SO2↑
У лабораторних умовах оксид сульфуру (IV) добувають дією кислот на сульфіти. При цьому замість нетривкої сульфітної кислоти виділяється оксид сульфуру(IV):
Na2S03 + H2S04 = Na2S04 + H2S03 ↓ ↓ H2O SO2↑
Застосування сульфур(іv) оксиду та сульфітів
Велику частину добутого сульфур(ІV) оксиду використовують для виробництва сульфатної кислоти. Сульфітний ангідрид є добрим відновником, за рахунок чого він здатний відновлювати деякі природні й штучні барвники. Цю властивість сульфітного ангідриду застосовують у текстильній промисловості для вибілювання різних матеріалів, наприклад шовку, вовни та соломи. Сульфур(ІV) оксид знешкоджує різні бактерії й мікроорганізми, тому його також використовують для дезінфекції сирих приміщень.
Кальцій гідрогенсульфіт застосовують при так званому сульфітному варінні целюлози, задля того, аби надати їй певних якостей. У такий спосіб обробляють деревину та папір.
Натрій сульфіт використовують як проявник у фотографії.
