
- •Хімічні властивості неметалів
- •Фізичні властивості неметалів
- •Застосування неметалів
- •2 Фізичні властивості оксидів Сульфуру
- •Хімічні властивості оксидів Сульфуру
- •Застосування сульфур(іv) оксиду та сульфітів
- •Застосування сульфур(vі) оксиду
- •Хімічні властивості
- •Хімічні властивості[ред. • ред. Код]
- •Добування аміаку[ред. • ред. Код]
- •Застосування[ред. • ред. Код]
- •Виробництво в Україні[ред. • ред. Код]
- •Фізичні властивості
- •7_Нітроген оксиди і фосфор оксиди
- •Фізичні властивості
- •Хімічні властивості
- •Одержання
- •Застосування
- •Харчова промисловість
- •Фізичні властивості ортофосфатної кислоти
- •Добрива
- •Одержання
- •Хімічні властивості
- •Отруйність
- •Як захиститися від небезпеки
- •Утворення в технологічних процесах.
- •Загальний опис[ред. • ред. Код]
- •Використання
- •Карбонатна кислота
- •Карбонати та гідрокарбонати
- •Силікатна кислота
- •Одиниці вимірювання
- •Способи усунення твердості води[ред. • ред. Код]
- •Місце металів у періодичній системі хімічних елементів. Металічний хімічний зв'язок. Загальні фізичні властивості металів
- •Класифікація
Класифікація
Залежно від того, чи є відповідний оксид основним, кислотним або амфотерним, відповідно розрізняють:
основні гідроксиди (основи) — гідроксиди, що проявляють основні властивості (наприклад, гідроксид кальціюCa(OH)2, гідроксид калію KOH, гідроксид натрію NaOH та ін.);
кислотні гідроксиди (кислоти, які містять кисень) — гідроксиди, що виявляють кислотні властивості (наприклад,азотна кислота HNO3, сірчана кислота H2SO4, сірчиста кислота H2SO3 та ін.)
амфотерні гідроксиди, які виявляють в залежності від умов або основні, або кислотні властивості (наприклад,гідроксид алюмінію Al(ОН)3, гідроксид цинку Zn(ОН)2).
Термін «гідроксиди» часто використовують лише стосовно основних і амфотерних гідроксидів.
Калійні добрива — речовини, які використовують для живлення сільськогосподарських рослин, основним поживним елементом яких є калій. Вміст калію в рослинах коливається від 0,4 до 6% сухої речовини і дуже багато його в бобових, буряках, картоплі, соняшнику, гречці. Джерелом калію для рослин є калій грунтів або калійні добрива.
Калійні добрива виробляють з калійних агроруд: сильвін (KCl), сильвініт, карналіт, каїніт, лангбейніт (K2SO4•2MgSO4), шеніт (K2SO4•MgSO4•6H2O),полігаліт, глауконіт, глазерит.
Найважливішими калійними добривами є хлорид калію (KCl) і сульфат калію (K2SO4), а також калімагнезія (K2SO4•Mg2SO4), які одержують шляхом переробки мінералів — сильвініту (KCl • NaCl), каїніту (KCl • MgSO4 • 3H2O) і карналіту (KCl • MgCl2 • 6H2O).
Хлорид калію (52,4-61,9% К2О) застосовують під культури, не чутливі до хлору у грунті: зернові культури, бавовна, цукрові буряки, конопля; неефективно вносити під картоплю, гречку, конюшину, плодові ти цитрусові, - так як хлор знижує якість продукції. На суглинкових грунтах хлорид калію вносять восени, щоб за осінньо-зимовий період хлор вимився з верхньої частини грунту і це б дало змогу запобігти негативній дії хлору.
Як калійні добрива використовують також сирі подрібнені (сиромолоті) мінерали сильвініт і каїніт та концентровані продукти виготовлені з калійних руд: сильвіну, сильвініту, карналіту, каїніту, глауконіту.
Стебницьке (Львівська область) і Калусько-Волинське родовища є головними родовищами Прикарпатського родовища калійних солей[1]. Стебницький ДГХП «Полімінерал» випускав калімагнезію, а Калуський - хлорид калію і добриво під назвою калушит(K2SO4•Ca2SO4•H2O і домішки із вмістом К2О до 29%)
Солі натрію і калію
Натрій і калій утворюють солі з усіма кислотами. Солі натрію і калію дуже схожі за хімічними властивостями. Характерна особливість цих солей - хороша розчинність у воді, тому доступних якісних реакцій на іони цих елементів немає. Наявність в з'єднанні навіть мізерно малої кількості іонів натрію або калію визначають шляхом внесення цього з'єднання в безбарвне полум'я: у випадку натрію полум'я забарвлюється в жовтий колір, а в разі калію - в рожево-фіолетовий. Натрій і калій утворює середні, кислі, подвійні і комплексні солі. Більшість середніх солей натрію і калію - термічно стійкі речовини і розкладаються тільки при дуже високих температурах. При помірному нагріванні розкладаються тільки солі галогенсодержащих оксокислот, нітрати і деякі інші сполуки:
Кислі солі менш стійкі, при нагріванні всі вони розкладаються:
Основних солей ці елементи не утворюють.
З солей найбільше значення має хлорид натрію - NaCl - кухонна сіль. Це необхідна складова частина їжі, консервант, сировина для хімічної промисловості. З нього отримують гідроксид натрію, питну соду (NaHCO3), соду (Na2CO3) і багато інших з'єднань натрію. Багато солі натрію утворюють кристалогідрати. Na2S2O3? Н2О - тіосульфат натрію, відповідний тіосерной кислоті Н2S2O3, застосовується у фотографії, для фіксації проявлених паперів. Na2SO4? 10H2O - десятіводний сульфат натрію, глауберової сіль, використовується в сульфатному способі отримання соди і у виробництві скла. Na2CO3? 10H2O - карбонат натрію або кальцинована сода застосовується в скляної, миловарній, целюлозно-паперової, текстильної, нафтової, хімічної промисловостях, а також у побуті. NaNO3 - нітрат натрію, натрієва або чилійська селітра - використовується як мінеральне добриво. Солі калію - необхідні мінеральні добрива. Na2SiO3 - силікат натрію - використовується у виробництві скла. Солі калію виділяються з розчину в основному без кристалізаційної води. К2CO3 - карбонат калію або поташ - використовується у виробництві мила, у виробництві тугоплавкого скла, у фотографії. КNO3 - карбонат калію або калієва селітра - застосовується при виготовленні чорного пороху. КCl - хлорид калію - застосовується як добриво. Багато солі калію зустрічаються в природі: КCl? MgCl? 6Н2О - карналіт; КCl? NaCl - сильвініт. Солі К містяться в квасцах.
17) Магній і Кальцій — металічні елементи, тому до їх головних сполук належать основні оксиди, гідроксиди та солі.
Оксиди. Кальцій оксид називається негашеним вапном, магній оксид — білою магнезією. У вузлах кристалічних ґраток, переважно йонного типу, на відміну від оксидів лужних елементів містяться двозарядні йони Е2+ і О2-, сила взаємодії між якими більша, ніж між йонами в кристалах оксидів Натрію і Калію, тому їх кристали міцніші, ніж кристали оксидів лужних елементів.
Фізичні властивості. Це білі тверді кристалічні речовини (мал. 112). Завдяки більшій міцності їх кристалічних ґраток порівняно з оксидами лужних елементів вони мають вищі температури плавлення і більшу густину.
Добування оксидів Магнію і Кальцію в лабораторії та промисловості проводять випалюванням карбонатів
Хімічні властивості оксидів Магнію та Кальцію зумовлені їх приналежністю до класу основних оксидів: вони взаємодіють з кислотами, кислотними й амфотерними оксидами та амфотерними гідроксидами.
- Складіть рівняння відповідних реакцій.
Магній оксид у реакції з водою малоактивний. Під час реакції кальцій оксиду з водою виділяється велика кількість теплоти. Ця реакція називається гашенням вапна, а добутий кальцій гідроксид — гашеним вапном:
СаО + Н2О = Са(ОН)2
Головними сполуками Магнію та Кальцію є основні оксиди та гідроксиди, солі. Магній оксидMgO називається білою магнезією, кальцій оксид СаО — негашеним вапном. Як основні оксиди вони реагують з кислотними оксидами, кислотами, амфотерними оксидами і гідроксидами.
З водою частково реагує лише кальцій оксид. При цьому утворюється луг кальцій гідроксид, який називається гашеним вапном. Магній оксид за стандартних умов у воді не розчиняється. Прозорий розчин Са(ОН)2 називають вапняною водою, водну суспензію сполуки — вапняним молоком. При нагріванні цей гідроксид розкладається на оксид і воду.
Більшість солей Кальцію та Магнію (карбонати, сульфати, фосфати) поширені у природі й використовуються повсюдно.
Для допитливих. Історія відкриття цілющих властивостей коралової води пов’язана з вивченням довголіття населення японських островів Окінава і Токуносіма. Вчені-геронтологи помітили, що тривалість життя на цих островах на 10 — 15 років вище, їх мешканці різняться відмінним здоров’ям, ніж загалом у Японії. Пізніше було встановлено причину: виявляється, ці острови є кораловими атолами; внаслідок фільтрації коралами вода оточуючих морів насичується йонами Кальцію, які є цілющими для людини.
18) Положення Алюмінію в періодичній системі, будова його атома
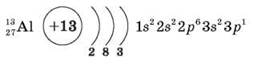
2. Фізичні властивості алюмінію
Сріблясто-білий метал, легкий і пластичний, ρ = 2,7 г/см3, tпл = 660 °С.
Легко витягується в дріт, прокочується в листи й фольгу. За електропровідністю поступається лише сріблу й міді. Входить до складу легких сплавів.
3. Природні сполуки Алюмінію
• Каолініт Al2O3 · 2SiO2 · 2H2O, входить до складу глини.
• Корунд Al2O3, кристали: червоні (рубіни), сині (сапфіри).
• Польовий шпат K2O · Al2O3 · 6SiO2.
• Боксит Al2O3 · nH2O.
• Нефелін Na2O · Al2O3 · 2SiO2.
• Кріоліт Na3[AlF6].
4. Способи одержання
Одержують електролізом Al2O3 у розплавленому кріоліті за температури близько 1 000 °С.
5. Хімічні властивості Алюмінію
1) Взаємодія з неметалами.
(Пропонуємо учням по ланцюжку дописати рівняння реакцій на дошці.)
Легко з’єднується з галогенами за кімнатної температури:
Al + Cl2 =
У результаті нагрівання:
Al + S =
Al + N2 =
Al + O2 = — сліпучий спалах.
2) Алюмінотермія:
Cr2O3 + 2Al = Al2O3 + 2Cr
3) З водою не взаємодіє, поверхня металу захищена оксидною плівкою, але якщо зняти її, протікатиме реакція:
Al + H2O =
(Допишіть ОВP.)
4) Алюміній легко взаємодіє з розчинами кислот.
Завдання. Допишіть рівняння реакцій окиснення-відновлення:
Al + HCl =
Al + HNO3 =
Al + H2SO4 (конц.) =
5) Реагує з лугами за нагрівання:
![]()
(Розставити коефіцієнти методом електронного балансу.)
6. Алюміній оксид Al2O3
Біла тугоплавка речовина, нерозчинна у воді, t = 2 050 °С.
Проявляє амфотерні властивості:
Al2O3 + HCl =
Al2O3 + NaOH =
Запишіть іонно-молекулярні рівняння.
7. Алюміній гідроксид Білий драглистий осад.
Демонстрація 4. Одержання алюміній гідроксиду та його амфотерні властивості
Al2(SО4) + 6NaОH = 2Al(ОH)3 + 3Na2SО4
Доведіть рівняннями хімічних реакцій амфотерність Al(OH)3.
Al(ОH) + HCl =
Al(OH)3 + NaOH = NaAlО2 + 2H2О (у процесі сплавлення)
Al(ОH)3 + NaOH = Na[Al(ОH)4] (у розчинах)
8. Солі Алюмінію
Тверді, білі речовини, дуже гідролізовані.
9. Застосування Алюмінію та його сполук
• Сплави.
• Алюмінотермія.
• Алюмінієві вироби.
19)
Положення в періодичній системі, будова атома
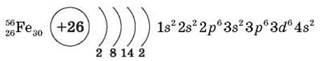
d-елемент, на зовнішньому 4s-рівні два електрони, важливу роль відіграє передзовнішнійd-підрівень. Ступені окиснення — +2 і +3, оскільки в реакціях бере участь один електронd-підрівня, валентності — II і III.
2. Фізичні властивості
Сріблястий, пластичний, ковкий, легко прокочується та піддається іншим видам механічної обробки.
Має здатність розчиняти в собі багато хімічних елементів (у тому числі Карбон, Силіцій). Проявляє магнітні властивості. tпл = 1 539 °С; tкип = 2 730 °С; ρ = 7,87 г/см3; твердість — 35-45 н/тм2.
3. Природні сполуки Феруму
(Розглядаємо колекцію мінералів.)
4 % маси — у земній корі у складі сполук. У вільному стані трапляється в метеоритах.
Основні ферумовмісні руди:
• магнітний залізняк Fe3O4, до 72 % Fe;
• червоний залізняк, гематит Fe2O3, до 65 % Fe;
• бурий залізняк, лимоніт 2Fe2O3 · 3H2O, до 60 % Fe;
• шпатовий залізняк, сидерит FeCO3;
• пірит, залізний колчедан FeS2, до 47 % Fe;
• Fe(HCO3)2 міститься у водах мінеральних джерел.
4. Одержання
(Звертаємося до таблиць виробництва чавуну та сталі.)
1) Відновлення воднем:
Fe2O3 + 3H2 = 2Fe + 3H2O
2) Алюмінотермія:
3Fe3O4 + 8Al = 4Al2O3 + 9Fe
3) Електроліз водних розчинів.
4) Відновлення С, CO.
5. Застосування заліза
ІІІ. Вивчення нового матеріалу
Семінар за планом
1. Хімічні властивості заліза
1) У вологому повітрі швидко іржавіє, вкривається бурим нальотом гідратів Fe2O3, які внаслідок своєї рихлості не захищають залізо від подальшого окиснення.
У воді залізо інтенсивно кородує за умови достатнього доступу кисню, утворюються гідратні форми:
4Fe + 3O2 + nH2O = 2Fe2O3 · nH2O
У разі нестачі кисню утворюється змішаний оксид FeO · Fe2O3, або Fe3O4:
3Fe + 2O2 + nH2O = Fe3O4 · nH2O
Завдання 1. Допишіть рівняння реакцій:
Fe + O2 =
Fe + S =
Fe + Cl2 =
2) Взаємодія з кислотами.
У розчинах кислот:
Fe - 2e- = Fe2+
Завдання 2. Допишіть рівняння реакцій у іонно-молекулярній формі:
Fe + HCl =
Fe + H2SО4 =
У концентрованих кислотах:
Fe -
3e- ![]() Fe3+
Fe3+
Завдання 3. Складіть ОВР, укажіть окисник, відновник:
Fe + H2SО4
Fe + HNО3
Залізо пасивує в 100%-й сульфатній H2SО4 і концентрованій нітратній HNО3 кислотах.
3) якісна реакція (демонстрація):
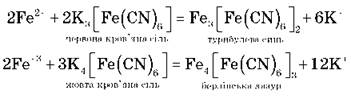
2. Сполуки Феруму(ІІ)
Ферум(ІІ) оксид FeO — основний, твердий, нерозчинний у воді.
Ферум(ІІ) гідроксид Fe(OH)2 — основний, твердий, зеленуватого кольору, нерозчинний у воді.
Утворюється в результаті дії лугів на розчинні солі.
Демонстрація 5
FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl
На повітрі окислюється:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 — бурий осад
Розчинний у кислотах:
Fe(OH)2 + HCl
Завдання 3. Запишіть рівняння в іонній формі.
Сполуки Fe2+ легко окислюються киснем повітря:
Fe2+ - e- Fe3+
FeSO4 · 7H2O — залізний купорос.
3. Сполуки Феруму(ІІІ)
Fe2O3 — амфотерний оксид коричневого кольору, твердий, нерозчинний у воді.
Fe(OH)3 — амфотерна основа бурого кольору, нерозчинна у воді.
Демонстрація 5
Одержують ферум(ІІІ) гідроксид дією лугів на розчини солей Fe3+:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl — бурий осад
Осад розчинний і в кислотах, і в надлишку лугу:
Fe(OH)3 + HCl
Fe(OH)3 + NaOH
Рівняння реакції записати в молекулярній та іонній формах.
Солі Fe3+ значною мірою гідролізуються, буре забарвлення Fe(OH)3 надає їм коричневого відтінку:
Fe3+ + H2O = FeOH2+ + H+
FeOH2+ + H2O = Fe(OH)2+ + H+
Fe(OH)2+ + H2O = Fe(OH)3 + H+
4. Нерозчинні основи й солі Феруму
Нерозчинні основи й солі Феруму(ІІ) й Феруму(ІІІ) розкладаються в процесі нагрівання.
Завдання 4. Допишіть рівняння:
20) Виробництво чавуну та сталі
Поширення металів у природі
Метали відрізняються активністю, що спричиняє й відмінності в їх поширенні в природі. У повітрі метали містяться в сполуках у вигляді часточок пилу, у воді — у розчинених у ній солях.
Найпоширеніший у земній корі метал — алюміній (5,5 %), далі йдуть: залізо (4 %), кальцій (3 %), магній (2 %). (Розглядаємо діаграму поширення хімічних елементів у природі.)
Найактивніші метали в природі існують у складі солей, метали середньої сили — у формі сульфідів та оксидів.
Благородні метали трапляються в природі й у вільному стані (самородки, «пісок»).
Лабораторний дослід 3. Ознайомлення зі зразками металевих руд
Розглядаємо колекцію природних мінералів, записуємо формули й назви руд деяких металів.
Заслуховуємо повідомлення учнів про поширення металів у природі, робимо на дошці записи про природні сполуки металів із зазначенням їхніх назв.
Демонстрація 6. Показ залізорудних родовищ на географічній карті України
IІІ. Вивчення нового матеріалу
1. Загальні способи одержання металів
Оскільки більшість металів у природі міститься у вигляді сполук, то будь-який спосіб одержання металів полягає у відновленні цих металів.
1) Найактивніші (K, Ca, Mg, Na) відновлюють електролізом.
Електроліз — це окисно-відновна реакція під дією постійного електричного струму.
Електроліз розплаву можна описати такою схемою:
2NaCl = 2Na + Cl2
На катоді: Na+ + e- = Na0 — відновлення катіонів.
На аноді: Cl- - e- = Cl0 — окиснення аніонів.
2) Менш активні метали відновлюють з оксидів або сульфідів (після попереднього випалу) одним зі способів:
а) коксом за високих температур:
SnO2 + C = CO2 + Sn
б) карбон(ІІ) оксидом:
Fe2O3 + 3CO = 3CO2 + 2Fe
в) воднем:
Fe2O3 + 3H2 = 2Fe + 3H2O
г) іншим, більш активним металом, наприклад алюмінієм (алюмінотермія):
3MnO2 + 4Al = 2Al2O3 + 3MnO
д) силіцієм (силікотермія):
2Al2О3 + 3Si = 4Al + 3SiО2
2. Виробництво чавуну та сталі
Демонстрація 7. Схема й макет доменного виробництва
Розглядаємо основні закономірності виробництва чавуну в доменній печі.
Згоряння коксу, утворення карбон(ІІ) оксиду:
С + О2 = СО2
С + СО2 = CO
С — основний відновник у доменній печі.
Відновлення заліза, виробництво чавуну:
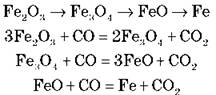
Одночасно відновлюються силіцій, манган, фосфор і сірка. Вуглець і відновлені речовини розчиняються в залізі.
Видалення домішок.
Домішки видаляються з допомогою флюсів:
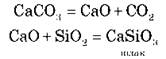
Демонстрація 5. Ознайомлення зі зразками чавуну та сталі
Поняття про чорну металургію
Чавун
Ливарний |
Переробний |
10 % від загальної маси |
90 % від загальної маси |
Для виготовлення залізних конструкцій, машин, плит, ґрат |
Для виробництва сталі |
Демонстрація 8. Модель кисневого конвертера Розглядаємо модель конвертера, пояснюємо хімічні процеси, що відбуваються під час виплавки сталі.
Окиснення домішок киснем.
Домішки: С, Si, S, Mn, P.
Реакції:
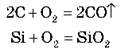
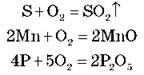
Одночасно окислюється й залізо:
2Fe + О2 = 2FeО
Окиснення домішок ферум(ІІ) оксидом
Видалення шлаків
Силіцій(IV) оксид і фосфор(V) оксид видаляють шляхом додавання флюсів:
Утворені в результаті цих реакцій речовини видаляються у вигляді шлаків.
Легування — це додавання до сплавів речовин (хрому, нікелю, кобальту, ванадію, вольфраму), що сприяють утворенню сплавів з потрібними складом, структурою, властивостями. У результаті легування утворюються леговані сталі.
Способи виробництва сталі
Киснево-конвертерний |
Електротермічний |
мартенівський |
1. Необхідна температура — 1 700 °С — досягається за рахунок окиснення домішок. 2. Економічний |
1. Температура 2 000 °С досягається дуговим методом. 2. Як сировину використовують металобрухт. 3. Використовують для одержання сталей, легованих тугоплавкими металами |
1. Окиснення домішок поверхневе. 2. Температура 1 700 °С досягається за рахунок спалювання палива. 3. Одержують сталь різних марок |
Демонстрація 8. Модель кисневого конвертера Розглядаємо модель кисневого конвертера, розповідаємо про його роботу.
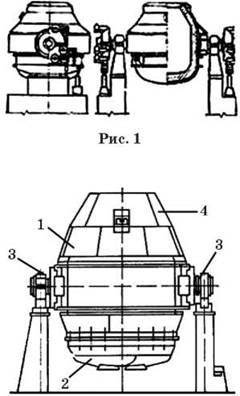
Рис. 2. Кисневий конвертер:
1 — корпус; 2 — днище; 3 — опорні підшипники; 4 — шолом
Рис. 3
IV. Узагальнення, підбиття підсумків
• Основні способи одержання металів ґрунтуються на відновленні металів з їх природних сполук.
• Виробництво заліза, чавуну та сталі — чорна металургія, решти металів та їхніх сплавів — кольорова металургія.
• Метали, що трапляються в природі в самородному стані, очищають, у тому числі й хімічними способами.
21 Формулювання періодичного закону. Структура періодичної системи. Періоди, групи, підгрупи. Зміна властивостей елементів у періодах та групах. Характеристика хімічних елементів за їх положенням у періодичній таблиці. Основи сучасної теорії будови атома. Склад атомних ядер. Електронні оболонки атомів. Розташування електронів по квантових електронних рівнях та підрівнях. Електронні формули атомів. Квантові комірки. Валентні електрони. Утворення хімічного зв‘язку. Типи хімічного зв‘язку. Періодичний закон і періодична таблиця елементів Періодичний закон хімічних елементів і його графічне відображення – періодична таблиця – є сучасною основою для вивчення властивостей елементів та їх сполук. Перше формулювання закону було таким: властивості елементів та їх сполук перебувають у періодичній залежності від величини атомної ваги елементів (Д.Менделєєв, 1869 р.). З часом формулювання закону змінювалось і в сучасному викладенні читається так: властивості хімічних елементів та їх сполук перебувають у періодичній залежності від величини заряду ядер їх атомів (порядкового номера або протонного числа). Періодична таблиця побудована за зростанням порядкових номерів елементів і поділяється на горизонтальні періоди і вертикальні групи відповідно з тим, що елементи періодично утворюють однотипні форми сполук, мають одакову валентність. Всього відомо 7 періодів і 8 груп елементів. Період – це сукупність (ряд) хімічних елементів, побудований в порядку зростання заряду ядер атомів, який починається (крім першого) активним лужним металом і закінчується благородним газом. Періоди діляться на малі і великі. Малі періоди: 1, 2, 3,- мають відповідно 2, 8, 8 елементів. Великі періоди: 4, 5, 6, - мають відповідно 18, 18, 32 елементів. 7 великий період незавершений. У періоді зліва направо спостерігається зменшення металічних властивостей елементів і зростання неметалічних. Останні члени ряду – благородні гази, хімічно мало активні. За подібністю хімічних властивостей елементи в таблиці поділяються на 8 груп, які складаються з двох підгруп: головної і побічної. Головні підгрупи містять елементи малих і великих періодів, наприклад, головна підгрупа І -ої групи складається з елементів H, Li, Na, K, Rb, Cs, Fr; головна підгрупа ІV-ої групи – з C, Si, Ge, Sn, Pb; головна підгрупа VII-ої групи – з F, Cl, Br, I, At. До побічних підгруп входять елементи тільки великих періодів: 4, 5, 6, 7, - які мають металічні властивості. Наприклад, побічна підгрупа І-ої групи складається з металів: Cu, Ag, Au; побічна підгрупа ІІІ-ої групи – Sc, Y, La, Ac; побічна підгрупа VІ-ої групи – Сr, Mo, W. Характеристика хімічних елементів за їх положенням у періодичній таблиці Знаючи місце елемента в періодичній таблиці: порядковий номер, період, групу, підгрупу, - можна досить чітко визначити деякі його властивості. По-перше, якщо елемент знаходиться на початку періоду, в І, ІІ, ІІІ групах, він має металічні властивості, якщо в кінці періоду – неметалічні властивості. Всі елементи побічних підгруп є металами. Можна також визначити атомну масу, густину, температуру плавлення та інше як середнє аріфметичне від відповідних костант його чотирьох “сусідів” ліворуч, праворуч, зверху, знизу. Наприклад, атомна маса селену АSe = (75 + 80 + 32 + 128) / 4 = 78,7, що дуже близько до табличної (78,96). Номер головної підгрупи дозволяє визначити валентність елемента за киснем і за воднем, як показано в темі 1. Наприклад, для елемента V- групи головної підгрупи № 33 миш‘яку As валентність за киснем дорівнює ІІІ або V; валентність за воднем: (8 - № групи) = 8 – 5 = 3 (ІІІ) в сполуках As2O3, As2O5; AsH3. У VIII групі знаходяться трiади елементів: Fe, Co, Ni; Ru, Ro, Pd; Os, Ir, Pt; які дуже схожі за фізичними і хімічними властивостями і називаються родинами: родина заліза, родина платини та ін. Також дуже схожі за властивостями елементи – лантаноїди і актиноїди, які розміщуються внизу таблиці. Періодичний закон і система елементів зробили великий вплив на розвиток хімії. Наприклад, видатні вчені В.Вернадський і О.Ферсман показали тісний зв‘язок між геохімічними властивостями елементів – їх поширеністю у земній корі, міграцією та інше – і періодичним законом. Велике значення має він для розвитку ядерної хімії та синтезу нових позауранових елементів, сучасної теорії сплавів, теорії каталізу. Велике філософське значення закону у пізнанні всесвіту. Основи сучасної теорії будови атома Всі елементи побудовані з атомів, які складаються з позитивно зарядженого ядра і електронів і відрізняються атомною масою. Маса атома складається з маси протонів +1 р і нейтронів 01n. Число протонів дорівнює порядковому номеру елемента в таблиці і числу електронів навколо ядра. Число нейтронів можна визначити, якщо від атомної маси відняти число протонів. ри хімічних реакціях cклад ядра атомів залишається сталим, змінюються тільки електронні оболонки. Тому для розуміння хімічної поведінки елементів треба знати будову електронних шарів їх атомів. Електронні шари на різних відстанях від ядра розрізняються енергією, утворюють енергетичний рівень. Число енергетичних рівнів в атомі дорівнює номеру періода, в якому знаходиться елемент, тобто всього відомо 7 енергетичних рівнів. Наприклад, елементи І-ого періоду мають один енергетичний рівень, другого – два, третього – три і т.д. до семи. Максимальне число електронів, яке може бути у тому чи іншому енергетичному рівні, дорівнює 2, 8, 18, 32, - і визначається за формулою Ne = 2 n2 , де n – головне квантове число або номер періоду. Енергетичні рівні діляться на підрівні. Всього відомо 4 енергетичних підрівня, які позначаються літерами s, p, d, f. Емність підрівнів: s2, p6, d10, f14. Число електронів на останньому зовнішньому підрівні дорівнює номеру групи в таблиці. Ці електрони називаються зовнішніми або валентними, вони беруть участь в утворенні хімічних зв‘язків з іншими атомами. Наприклад, атом магнію Mg, який знаходиться в 3-ому періоді і ІІ-ій групі, порядковий номер 12, має 12 електронів, які розташовані на трьох енергетичних рівнях по 2, 8, 2 електрона. Зовнішніми є два електрони третього періоду, вони знаходяться на підрівні s. Взагалі для будь-якого атома в таблиці порядок заповнення енергетичних рівнів і підрівнів має вигляд 1s2 2s22p6 3s23p6 4s23d104p6 5s24d105p6 6s24f145d106p6 7s25f146d10… З цього ряду видно, що елементи побічних підгруп в 4, 5, 6,7 періодах є d10- елементами – металами; лантаноїди і актиноїди – 4 f14 та 5f14 – елементами. Кожний період починається двома s – елементами – активними металами, а закінчується шістьма р-елементами - амфотерними металами і неметалами. За допомогою електронних формул можна записати електронну структуру будь-якого атома. Наприклад, електронна формула атома сірки, порядковий номер 16, має вигляд 1s22s22p63s23p4. Електронна формула атома заліза, порядковий номер 26, буде 1s22s22p63s23p64s23d6. Розподіл електронів на підрівнях можна зобразити за допомогою квантових комірок □. Кожна квантова комірка може бути зайнята двома спареними електронами. Тому для s-підрівня буде одна комірка, для р-підрівня три комірки, для d- підрівня п‘ять комірок і для f- сім. Неспарені електрони в комірках і є валентними, вони беруть участь в утворенні зв‘язку. Наприклад, атом літію має 3 електрони: 1s22s1; дві квантові комірки □ □ ; один неспарений електрон на підрівні 2s1 ; має валентність (І). Сполучення атомів у молекули. Хімічний зв‘язок Неспарені зовнішні електрони мають найбільшу енергію, є найбільш рухливими і можуть взаємодіяти із зовнішніми електронами інших атомів. Головною умовою такого об‘єднання є зниження енергії в системі та утворення хімічного зв‘язку. При цьому неспарені електрони можуть об‘єднуватись у просторі між ядрами атомів або повністю переходити від одного атома до іншого; утворюється ковалентний або іонний зв’язок. Ковалентний зв’язок поділяється на неполярний і полярний. Неполярний ковалентний зв’язок утворюється між атомами одного і того ж елемента, спільна електронна пара знаходиться в просторі між ядрами на однаковій відстані від них, наприклад, у молекулах H2, O2, N2, Cl2. Ковалентний полярний зв‘язок буде в молекулах, утворених атомами різних неметалів, спільна електронна пара зміщена до більш електронегативного атома, наприклад, у молекулах HCl, HF, H2O, H2S. Значення електронегативності всіх елементів можна знайти в таблицях. Іонний тип зв’язку може бути в молекулах, які утворені активними лужними та лужноземельними металами та активними неметалами, наприклад, галогенами: KCl, NaF, CaF2, BaCl2 та ін. В таких молекулах об’єднані не атоми, а іони елементів: K+Cl-, Na+F-, Ca2+F2-, Ba2+Cl2- . При розчиненні у воді вони розкладаються на іони, проводять електричний струм. Валентні електрони повністю передаються від атома металу до атома неметалу. Існують й інші типи хімічого зв’язку. В масі металу між атомами утворюється металічний зв’язок, ознакою якого є спільність всіх валентних електронів для всіх атомів. Завдяки такому зв’язку метали добре проводять електричний струм і тепло. є пластичними, легко куються і прокатуються. Між молекулами води виникають додаткові зв’язки, які називаються водневими. При замерзанні води водневі зв’язки фіксуються в просторі, тому густина льоду менша за густину рідкої води: лід плаває на поверхні, водойми не промерзають до дна, життя не припиняється.
22)хымычний зв*язок
Ковалентний неполярний зв'язок[ред. • ред. код] При взаємодії атомів з однаковою електронегативністю утворяться молекули з ковалентним неполярним зв'язком. Такий зв'язок існує в молекулах наступних простих речовин: H2, F2, Cl2, O2, N2. Хімічні зв'язки в цих газах утворені за допомогою спільних електронних пар, тобто при перекритті відповідних електронних хмар при зближенні атомів. Складаючи електронні формули речовин, потрібно пам'ятати, що кожна спільна електронна пара — це умовне зображення підвищеної електронної густини, що виникає внаслідок перекриття відповідних електронних хмар. Ковалентний полярний зв'язок[ред. • ред. код] При взаємодії атомів, значення електронегативностей яких відрізняються, але не різко, відбувається зміщення загальної електронної пари до більш електронегативного атома. Це найпоширеніший тип хімічного зв'язку, який зустрічається як в неорганічних, так і органічних сполуках. До ковалентних зв'язків в повній мірі відносяться і ті зв'язки, які утворені по донорно-акцепторному механізму, наприклад в іонах гидроксонія і амонія. |
|
Іо́нний хімі́чний зв'язо́к, також йонний хімічний зв'язок[1] — це тип зв'язку, при якому електрони переходять із одного атома до іншого, й основний вклад в притягання вноситься електростатичною взаємодією. |
|
еталі́чний зв'язо́к — тип хімічного зв'язку, при якому валентні електрони атомів делокалізуються і починають взаємодіяти з атомними остовами усього тіла. |
|
Водне́вий зв'язо́к — різновид хімічного зв'язку, що реалізується за донорно-акцепторним механізмом між двома ковалентно зв'язаними атомами з великим значенням електронегативності (О, N, F) за посередництвом атома Гідрогену Н
Вале́нтність — це число, яке показує, зі скількома одновалентними атомами може сполучатися атом даного елемента або сполуки; скільки таких атомів він може замістити. Валентність характеризує здатність атома утворювати певну кількість хімічних зв'язків, яка може бути пов'язаною із здатністю атомів віддавати або приєднувати певне число ементу є кількість атомів водню (або іншого одновалентного елементу), яку атом даного елементу може приєднати чи замістити. Так, у сполуках HCl, H2O і хлор є одновалентним, кисень — двовалентним, а азот — тривалентним, бо вони сполучені відповідно з одним, двома і трьома атомами водню.
23) 23Розчини й сам процес розчинення мають велике значення в природі, у нашому житті, у науці й техніці. Найчастіше ми маємо справу не з чистими речовинами, а із сумішами або розчинами. Вода морів, річок, озер, ґрунтові води, питна вода — це розчини. Повітря — це розчин газів. Більшість мінералів — це тверді розчини. Соки рослин, напої — це розчини. Засвоєння їжі пов'язане з розчиненням поживних речовин. Розчинами є кров, лімфа, ліки, лаки, фарби. Розчини використовуються в промисловості: текстильній, металообробній, фармацевтичній, при виробництві пластмас, синтетичних волокон, мила та ін. При розчиненні речовин відбувається їхнє подрібнення й розсіювання в об'ємі розчину. У розчині частинки однієї речовини рівномірно розподілені між частинками іншої. Якщо речовина розчинена до рівня молекул, то розчин буде однорідним, прозорим і не буде відстоюватися. Такий розчин є істинним. Наприклад, розчин солі у воді, столовий оцет, розчин цукру. Характерна ознака істинних розчинів — їхня однорідність. Розчинами називають багатокомпонентні однорідні системи змінного складу. У розчині завжди містяться розчинник і розчинена речовина. Розчинник — це компонент розчину, що перебуває в такому ж агрегатному стані, що й розчин, і кількісно переважає. У розчині солі у воді розчинником є вода, а в медичному спирті — спирт є розчинником, а вода розчиненою речовиною. Вода — найкращий розчинник для багатьох речовин. Гарними розчинниками є спирт, ацетон, бензин, ефіри. Розчинена речовина може бути в будь-якому агрегатному стані: твердому (цукор, сіль), рідкому (спирт), газоподібному (вуглекислий газ). Одночасно в розчині може бути розчинено декілька речовин, наприклад, у мінеральній воді розчинені різні солі. Кількість розчиненої речовини може бути різною. Розчини не мають постійного складу й у цьому полягає їхня основна відмінність від хімічних сполук. Розчинністю називається здатність речовини розчинятися в тому або іншому розчиннику. Мірою розчинності речовини за даних умов є її вміст у насиченому розчині. Якщо в 100 г води розчиняється більше 10 г речовини, то таку речовину називають добре розчинною (наприклад, сірчана кислота). Якщо розчиняється менше 1 г речовини — речовина малорозчинна (наприклад, гіпс). Речовину вважають практично нерозчинною, якщо в розчин переходить менше 0,01 г речовини (наприклад, срібло). Абсолютно нерозчинних речовин не буває. Навіть коли ми наливаємо воду в скляну посудину, дуже невелика кількість частинок скла неминуче переходить у розчин. Розчинність різних речовин обумовлюється багатьма причинами. Розчинність більшості твердих речовин зі збільшенням температури збільшується, а розчинність газів, навпаки, зменшується. Тиск не впливає на розчинність твердих речовин. Зате збільшення тиску підвищує розчинність газів. Розчини класифікують за різними ознаками. За агрегатним станом виділяють тверді розчини (сплави металів, мінерали), рідкі розчини (морська вода, чай, столовий оцет) й газоподібні розчини (повітря). За ступенем дисперсності, тобто за величиною частинок, розподілених у розчиннику, розрізняють грубодисперсні системи (з розміром частинок від 10-7 м до 10-5 м) і тонкодисперсні системи. У грубодисперсних системах речовина знаходитися у вигляді невеликих частинок, такі системи мутні, непрозорі, нестійкі в часі (наприклад, пісок у воді). До таких систем належать суспензії й емульсії. Суспензія — це система, в якій частки твердої речовини розподілені в рідині (наприклад, суміш глини з водою). Емульсія — це система, в якій частинки однієї рідини розподілені в іншій рідині (наприклад, суміш рослинної олії з водою). У тонкодисперсних системах речовина знаходиться у вигляді агрегатів декількох молекул або окремих молекул. Саме до них належать істинні розчини. За кількістю розчиненої речовини розчини бувають розведені або концентровані. Якщо в певному об'ємі розчину знаходиться відносно невелика кількість розчиненої речовини, то розчин називається розведеним, а якщо розчинено багато речовини, то розчин називається концентрованим. Розчин, у якому дана речовина при даній температурі вже більше не розчиняється
24) Усі електроліти поділяють на сильні та слабкі. Сильні електроліти в розчинах дисоціюють повністю, а слабкі — частково, тобто частина молекул залишається в недисоційованому стані. До сильних електролітів відносять усі солі (за незначним винятком), луги (гідроксиди лужних металів, а також Барію, Стронцію й Кальцію) та деякі кислоти (НСl, НВr, НІ, HNO3, H2SO4(розб)). Інші електроліти відносять до слабких. Силу електролітів можна пояснити ступенем іонності зв’язку, що підлягає розриву при дисоціації. Оскільки в солях між іонами металів та кислотних залишків зв’язок іонний, то майже всі солі належать до сильних електролітів. Аналогічний підхід справедливий також і для кислот та основ. Але якщо в основ полярність зв’язку між атомом металу й гідроксильною групою визначається тільки електронегативністю атома металу, то для кислот полярність зв’язку між атомами Оксигену та Гідрогену залежить від якісного й кількісного складу кислотного залишку. У кислот, до складу яких атоми Оксигену не входять НЕ, сила кислот залежить від розміру атома Е. Чим більший радіус атома, тим більша довжина зв’язку Н-Е, а отже, тим простіше його розірвати й тим більшою є сила кислоти. Таким чином, у ряді галогеноводневих кислот зі збільшенням порядкового номера галогену сила кислоти збільшується: плавикова кислота є слабкою, а йодоводнева кислота — сильною, тобто сила кислот змінюється в ряді: HF < НСl < НВr < НІ. Силу оксигеновмісних кислот можна визначити за формулою Е(ОН)mОn. Якщо n < 2 — кислота слабка, якщо n більше або дорівнює 2 — сильна. Взаємозв’язок сили кислоти із числом атомів Оксигену, які не входять до складу гідроксильних груп, можна пояснити в такий, спосіб. Атом Оксигену, як найбільш електронегативний, притягує до себе спільні електронні пари. У результаті електронна густина від атома Оксигену в групі ОН зміщується в бік кислото-твірного елемента й зв’язок між атомами Оксигену та Гідрогену в гідроксильній групі стає більш полярним. Чим більше число атомів Оксигену, які не входять до групи ОН, тим полярніший зв’язок і сильніша кислота. Залежність сили кислот від складу кислотного залишку Кислота Формула n Характер електроліту HmEOn+m E(OH)mOn Сульфатна H2SO4 S(OH)2O2 2 Сильний Сульфітна H2SO3 S(OH)2O 1 Слабкий Нітратна HNO3 N(OH)O2 2 Сильний Нітритна HNO2 N(OH)O 1 Слабкий Карбонатне H2CO3 C(OH)2O 1 Слабкий Ортофосфатна H3PO4 P(OH)3O 1 Слабкий Гіпохлоритна HClO Cl(OH) 0 Слабкий Хлоритна HClO2 Cl(OH)O 1 Слабкий Хлоратна HClO3 Cl(OH)O2 2 Сильний Перхлоратна HClO4 Cl(OH)O3 3 Сильний Ступінь дисоціації Для кількісного опису сили електролітів використовують поняття «ступінь дисоціації». Ступенем дисоціації а називають відношення числа молекул, що розпалися на іони (продисоційованих), до загального числа розчинених молекул. Різні електроліти дисоціюють на іони різною мірою. Як випливає з наведеного рівняння, ступінь дисоціації може змінюватися від 0 до 1. Ступінь дисоціації часто виражають у відсотках. Слід зазначити, що при дисоціації відбувається збільшення числа частинок у розчині. Наприклад, якщо в розчині перебуває електроліт типу Kat+An”, який повністю розпадається на іони, то число частинок збільшується у два рази. Ступінь дисоціації також є характеристикою, за якою можна визначити, є електроліт сильним чи слабким. Так, якщо ступінь дисоціації електроліту в 0,1 М розчині більший 30 %, то його відносять до сильних електролітів, а якщо менший 3% — до слабких. Електроліти, в яких ступінь дисоціації має проміжні значення, відносять до електролітів середньої сили. Ступені дисоціації слабкого електроліту, визначені різними способами (наприклад, за виміром електропровідності або температурою кипіння розчину), найчастіше збігаються. Однак для сильних електролітів визначення ступеня дисоціації різними способами дає різні результати. Отже, величина ступеня дисоціації не характеризує реальну (справжню) ступінь дисоціації, а представляє уявну величину. Цей, а також низка інших фактів призвели до перегляду теорії Арреніуса у 20-х роках минулого сторіччя й до уточнення, внаслідок чого з’явилася нова теорія електролітів, яка враховує елек
