
- •Хімічні властивості неметалів
- •Фізичні властивості неметалів
- •Застосування неметалів
- •2 Фізичні властивості оксидів Сульфуру
- •Хімічні властивості оксидів Сульфуру
- •Застосування сульфур(іv) оксиду та сульфітів
- •Застосування сульфур(vі) оксиду
- •Хімічні властивості
- •Хімічні властивості[ред. • ред. Код]
- •Добування аміаку[ред. • ред. Код]
- •Застосування[ред. • ред. Код]
- •Виробництво в Україні[ред. • ред. Код]
- •Фізичні властивості
- •7_Нітроген оксиди і фосфор оксиди
- •Фізичні властивості
- •Хімічні властивості
- •Одержання
- •Застосування
- •Харчова промисловість
- •Фізичні властивості ортофосфатної кислоти
- •Добрива
- •Одержання
- •Хімічні властивості
- •Отруйність
- •Як захиститися від небезпеки
- •Утворення в технологічних процесах.
- •Загальний опис[ред. • ред. Код]
- •Використання
- •Карбонатна кислота
- •Карбонати та гідрокарбонати
- •Силікатна кислота
- •Одиниці вимірювання
- •Способи усунення твердості води[ред. • ред. Код]
- •Місце металів у періодичній системі хімічних елементів. Металічний хімічний зв'язок. Загальні фізичні властивості металів
- •Класифікація
Як захиститися від небезпеки
Потрібно, щоб усі побутові прилади були справні та щоб фахівці регулярно оглядали їх. Якщо полум'я газу жовте, а не блакитне, вважайте, що це попередження про якусь несправність, і, можливий, вихід чадного газу. При користуванні побутовими приладами, які можуть стати причиною поширення чадного газу, завжди виявляйте обачність. Ознакою отруєння є сонливість, спричинена зменшенням доступу кисню (СО оборотньо блокує гемоглобін). Найкращим заходом допомоги ураженому є свіже повітря й рух. (Рос. приказка «носится как угорелый» пішла саме від типового самолікування уражених чадним газом). Несмертельні дози не мають акумулятивного ефекту. Звичайні протигази не дають захисту (СО не сорбується активованим вугіллям).
Контроль на шахтах. При роботі в шахтах ведеться постійний контроль його вмісту в повітрі. Транспортні і вантажні машини при підземних і відкритих гірничих роботах обладнуються пристроями для очищення вихлопних газів.
Утворення в технологічних процесах.
Утворюється внаслідок згоряння вуглецю і його сполук при нестачі повітря, в значних кількостях присутній у топкових газах, газах двигунів внутрішнього згоряння, продуктах детонації.
11) Силіцій оксид
Силіцій оксид при нормальних умовах являє собою склоподібну тверду речовину з високими температурами фазових переходів; Тпл =+1600 °С; Ткип =+2600 °С.
Силіцій оксид, так само, як і карбон(ІV) оксид, є кислотним оксидом, хоча сам він з водою не реагує (це знає кожен, тому що SiO2 — це не що інше, як пісок, а пісок з водою не взаємодіє). Силіцій оксиду відповідає силікатна кислота — H2SiO3. Ця кислота не розчиняється у воді.
При сплавлянні силіцій оксиду з лугами або основними оксидами утворюються силікати. Силікати — це солі силікатної кислоти:
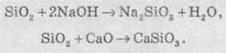
Силікатна кислота являє
собою тверду, не розчинну у воді речовину
білого кольору, яка при добуванні з
концентрованих розчинів утворює
сирнистий осад, а з розведених розчинів
виділяється у вигляді колоїдного
розчину. Колоїдний розчин — це проміжний
стан між справжнім розчином і суспензією,
а розміри частинок у таких розчинах
порядку 10 ![]() 100
молекул.
100
молекул.
Силікатна кислота — це слабка двохосновна кислота (Ка1 = 2 ∙ 10-10, Ка2 = 2 ∙ 10-12). Її добувають дією на розчинні у воді силікати хлоридною або сульфатною кислотами:
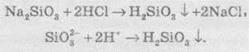
З усіх силікатів у воді розчиняються тільки силікати лужних металів. Амоній силікат не отриманий. Зазвичай силікати добувають сплавлянням оксидів, гідроксидів або карбонатів металів із кремнеземом (силіцій(ІV) оксидом):
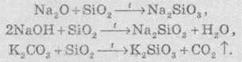
Силікати широко застосовують у виробництві будівельних матеріалів, що добре ілюструє таблиця:
Матеріал |
Метод добування |
Застосування |
Азбест 3MgO ∙ 2SiO2 ∙2Н2O |
Природний мінерал |
Для виготовлення вогнетривких матеріалів, картону, паперу тощо |
Рідке скло (канцелярський клей) Na2SiO3 |
Сплавляння натрій карбонату (соди) з силіцій оксидом:
|
Для виготовлення кислототривких цементів і бетонів, для склеювання металевих та скляних поверхонь, для укріплення ґрунтів, для надання вогнетривкості деревині й тканинам |
Скло віконнеNa2O ∙ CaO ∙ 6SiO2 |
Сплавляння негашеного вапна СаО (або вапняку СаСO3) з натрій карбонатом Na2CO3 (або натрій сульфатом з коксом Na2SO4 + С) іSiO2:
|
Скло використовують як прозорий теплоізолятор у вікнах, як ізолятор у радіотехніці, як основу багатьох оптичних приладів, для захисту людей від ультрафіолетового випромінювання |
Свинцеве скло (кришталь) К2O ∙ PbO ∙ 6SiO2 |
Сплавляння відповідних карбонатів з силіцій діоксидом:
|
За рахунок високого коефіцієнта заломлення використовується в оптиці, нагадує брильянт і тому використовується в ювелірній справі, для виготовлення посуду |
Різні керамічні матеріали (цегла, черепиця, дренажні труби, посуд тощо) |
Спікання суміші глини, піску та (іноді) польового шпату. Насамкінець основним компонентом виступає алюміній силікат Al2(SiO3)3. Кольору надає матеріалам Fe2O3 що міститься в глині |
Червона цегла — один з основних будівельних матеріалів. Додаючи в плав певні компоненти, можна добувати жаростійку цеглу, кислотостійку, декоративну тощо |
Негашене вапно СаО |
Прожарювання вапняку:
|
Негашене вапно на повітрі поглинає карбон діоксид, перетворюючись у досить міцний матеріал. Колись використовували в суміші з піском замість цементу |
Цемент, кальцій алюмосилікат СаО ∙ 2SiO ∙2Аl2O3 |
Спікання вапняку й глини при +1500 °С |
Дуже розповсюджена зв’язувальна речовина для будівельних матеріалів. Використовують для добування бетону |
Бетон, затверділа суміш цементу, піску та дрібних каменів |
До суміші цементу, піску й дрібних каменів додають воду до утворення так званого густого «цементного тіста». Це тісто заливають у форми й сушать |
Бетон застосовують при будівництві майже будь-яких об’єктів. Часто використовують залізобетон, який являє собою бетон із залізним каркасом, що збільшує надійність системи |
