
- •Дифференциальная диагностика ургентной абдоминальной патологии эвристическая схема диагностического процесса
- •Основные методические подходы к дифференциальной диагностике острой хирургической патологии. Структура диагностического процесса.
- •Изнурительная обильная рвота возможна при
- •Подкожная эмфизема встречается при
- •Классификация острых абдоминальных синдромов:
- •Виды соматических абдоминальных болевых синдромов:
- •Основные нехирургические причины болей (р. Стиллман):
- •Дифференциальный диагноз острого аппендицита
- •Эндокринные и метаболические расстройства, как причина острого абдоминального болевого синдрома.
- •Основные показания к срочной лапаротомии:
- •Дифференциальная диагностика “tumor abdominis”
- •Исследование проводится в горизонтальном положении в условиях хорошего освещения в положении способствующем расслаблению мышц живота (слегка приподнята верхняя половина туловища).
- •Опухоли брюшной стенки
- •Опухоли свободной брюшинной полости.
- •Ретроперитонеальные опухоли:
- •Характеристика эпигастральных, мезогастральных и гипогастральных опухолей.
- •Острая кишечная непроходимость
- •Определение окн. Классификация.
- •Классификация: Патогенетические формы.
- •Этиология острой непроходимости желудочно-кишечного тракта
- •Обтурационная (1% - туберкулез).
- •Странгуляционная.
- •Функциональная (перивисцерит).
- •Ранняя (10 дней);
- •Средних сроков;
- •Поздняя (позже 2-х месяцев).
- •Виды спаек (а.О. Верещинский, 1925):
- •Плоскостные;
- •Перепончатые;
- •Шнуровидные;
- •Основные патогенетические звенья окн
- •Ретенционный
- •Клинические формы окн Обструктивная тонкокишечная непроходимость: Компенсированная:
- •Субкомпенсированная:
- •Декомпенсированная:
- •II клиническая форма – узлообразование (75% случаев возникает внезапно во время сна после обильной еды).
- •Дифференциальная диагностика деструктивной окн:
- •IV клиническая форма - заворот сигмовидной, поперечно-ободочной и слепой кишки:
- •Общие показания к оперативному лечению
- •«…Больного с кишечной непроходимостью нужно оперировать прежде чем над ним сядет или взойдет солнце» т.Е. В течение нескольких часов (и. Литтманн, 1982):
- •Показания к оперативному лечению опухолевой толстокишечной непроходимости
- •Экстренные (первые сутки)—перитонит, неэффективность консервативных мероприятий в течение 3-6-х часов.
- •Срочные (от 12 до 24 ч)— возобновление непроходимости после определенного клинического эффекта (обычно через 5-6 ч).
- •Ранние (отсроченные) (через 5-6 дней после госпитализации) после непродолжительной подготовки.
- •Выбор оперативного вмешательства
- •Литература
- •Патофизиология, диагностика и лечение панкреатопатий Основы анатомии и физиологии поджелудочной железы.
- •Классификация патологии поджелудочной железы.
- •Патоморфология.
- •Основные звенья патогенеза хронического панкреатита
- •Классификации хронического панкреатита
- •Клиника и дифференциальная диагностика. Клиническая классификация
- •Ведущие клинические проявления хронического панкреатита.
- •Хирургическое лечение
- •Прогноз.
- •Панкреонекроз (стандарты диагностики и лечения)
- •Клинико-морфологическая классификация острого панкреатита
- •Диагностика острого панкреатита:
- •Основные направления и методы комплексной терапии деструктивного панкреатита.
- •1. Интенсивная терапия – направлена на:
- •4. Антибактериальная профилактика и терапия.
- •7. Хирургическое лечение панкреонекроза
- •Хирургические доступы:
- •Кисты и свищи поджелудочной железы.
- •Показания к хирургическому лечению.
- •Методики оперативного лечения.
- •Свищи поджелудочной железы. Классификация (а.П. Радзиховский, 1985; м.В. Данилов, в.Д. Федоров, 1995).
- •Внутренние панкреатические свищи.
- •Гастродуоденальные кровотечения Терминология
- •Неотложная помощь
- •Низкие желудочно-кишечные кровотечения
- •Этиология
- •Диагностика
- •Лечение
- •Эндоскопические меоды гемостаза при острых желудочно-кишечных кровотечениях Показания
- •Клинико-эндоскопические критерии высокого риска рецидива гастродуоденального кровотечения:
- •Методы эндоскопического гемостаза
- •Показания к неотложным оперативным вмешательствам
- •Эндобилиарные вмешательства в диагностике и лечении опухолей гепатопанкреатодуоденальной зоны
- •Классификация опухолей гепатопанкреатодуоденальной зоны.
- •Клиника и диагностика
- •Лечение
- •Проблема послеоперационных осложнений в абдоминальной хирургии
- •Характеристика и основные причины послеоперационных осложнений в хирургии органов брюшной полости.
- •Особенности фаз послеоперационного периода.
- •Ранняя диагностика послеоперационных осложнений.
- •Тромбоэмболия легочных артерий (тэла)
- •Способы профилактики венозных тромбоэмболитических осложнений
- •Лечение осложнений
- •Заключение
- •Актуальные вопросы диагностики и лечения сепсиса
- •Эпидемиология
- •Факторы, способствующие повышению заболеваемости сепсисом:
- •Определения
- •Диагностика
- •Лечение
- •1. Стабилизация состояния пациента.
- •2. Эрадикация микроорганизмов из кровотока.
- •3. Проведение дополнительных мер по контролю очага инфекции.
- •Травма груди Классификация
- •Патогенез расстройств при травмах груди
- •Клинические признаки травмы груди
- •Другие исследования:
- •Рентгенологическое исследование пищевода
- •Принципы лечения травмы груди
- •Отдельные виды травм Ранения сердца, перикарда
- •Повреждение аорты и крупных сосудов
- •Повреждение пищевода Обнажение шейного и грудного отделов пищевода.
- •Пневмоторакс
- •Переломы ребер
- •Повреждение паренхимы легкого
- •Разрывы и ранения трахеи и бронхов Проявления:
- •Хилоторакс
- •Разрыв диафрагмы
- •Сочетанные ранения груди и живота
- •Клиника и диагностика.
- •Повреждения брюшной стенки.
- •Повреждение полых органов.
- •Повреждения печени
- •Повреждения поджелудочной железы.
- •Повреждения селезенки
- •Травма почек
- •Рекомендуемая литература
- •Инфузионная терапия и парентеральное питание в хирургии инфузионная терапия
- •Три основные задачи инфузионной терапии:
- •Парентеральное питание
- •Артериопатии
- •1. Поражения артериальной стенки
- •2. Поражения стенки сосуда вследствие травмы
- •3. Поражения стенки сосуда вследствие сдавления
- •4. Поражения вследствие внутрисосудистого фактора, метаболических нарушений
- •5. Поражения и дисфункция капилляров (ангиоригоз или трофоангионевроз)
- •Варикозная болезнь5 сеар-классификация (1995)
- •Формы варикозной болезни
- •Диагностика
- •Методика компрессионной флебосклерозирующей терапии
- •Острый варикотромбофлебит
- •Диагностика
- •Лечение
- •Хирургическая фармакология Фармакологическая характеристика соматостатина.
- •Простой и низкомолекулярный гепарин (нмг).
- •Лечение рефлюксной болезни
- •Противовоспалительная терапия.
острые парапанкреатические жидкостные образования (ранняя несформированная ложная киста):
А. Неинфицированные
В. Инфицированные (данные тонкоигольной биопсии УЗИ, КТ)
Панкреатогенный абсцесс (4 неделя и позже)
поддиафрагмальный
сальниковой сумки
преджелудочной сумки
Септическая флегмона забрюшинных клетчаточных пространств (4 неделя и позже): парапанкреатического, параколического, паранефральных, тазового.
Бактериальный перитонит (3-4 неделя и позже):
- серозно-фибринозный
– гнойный
Механическая желтуха (первая неделя и позже)
Острые ЖКК на почве острых язв (1-4 неделя)
Аррозивное кровотечение (4 неделя и позже)
Сформированная псевдокиста (3 месяца и позже):
- стерильная
– инфицированная
Внутренние и наружные свищи желудочно-кишечного тракта (3-4 неделя и позже).
.Острая почечная недостаточность (ранняя, поздняя).
Основной клинико-морфологической формой деструктивного панкреатита в ранние сроки заболевания является стерильный панкреонекроз. Инфицированные формы панкреонекроза выявляют в среднем у 25 % больных на 1-й неделе, у 30 % на 2-й и у 70 % — па 3-й неделе заболевания. В сроки более 3 нед. заболевания, как правило, развиваются панкреатогенные абсцессы.
Диагностика острого панкреатита:
детальная оценка клинической картины заболевания,
определение активности панкреатических ферментов в крови (амилаза, липаза), моче (амилаза), экссудате брюшинной полости,
динамики гомеостатических показателей (лейкоциты крови, лейкоцитарный индекс интоксикации, гематокрит, глюкоза, билирубин, мочевина, креатинин, общий белок, альбумин, Ал АТ, Ас АТ, ЛДГ, Na, К, Са, Сl, раСО2),
инструментальное обследование, включающее:
- данные ультразвукового исследования (УЗИ) органов забрюшинного пространства и брюшной полости (всем больным),
- лапароскопию (при неясном диагнозе),
- компьютерную томографию (по возможности).
- рентгенография грудной клетки и брюшной полости (позволяет облегчает дифференциальный диагноз с перфорацией полого органа, механической кишечной непроходимостью, установить наличие острого повреждения легких (ателектаз, пневмония, РДСВ, содружественный плеврит)).
Диагноз острого панкреатита (степени тяжести) должен быть верифицирован в течение первых 24 часов с момента госпитализации больного в хирургический стационар.
ОЦЕНКА СТЕПЕНИ ТЯЖЕСТИ, ВКЛЮЧАЮЩАЯ ТРИ ОСНОВНЫХ ЭТАПА:
Первичная (исходная) оценка тяжести острого панкреатита подразумевает клиническую дифференциацию на интерстициальную форму заболевания и панкреонекроз на основании выраженности: болевого, диспептического (рвота, парез ЖКТ), гемодинамического синдромов, местной симптоматики (напряжение мышц передней брюшной стенки, нарушения микроциркуляции на коже живота). Точность и прогностическая значимость ~50 %.
На втором этапе оценка тяжести заболевания строится на анализе клинико-лабораторных шкал интегральной оценки параметров физиологического состояния больного острым панкреатитом, которые позволяют повысить точность прогнозирования исхода заболевания и развития постнекротических осложнений до 70-80 %. Наиболее распространенными системами интегральной оценки тяжести состояния больного и прогноза острого панкреатита являются шкалы Ranson (1974), Glasgow (1984), APACHE II (1984).
— При значениях шкалы Ranson/Glasgow более 4 баллов, APACHE II более 9 баллов развитие деструктивного панкреатита носит преимущественно осложненный характер.
— Динамическая ежедневная оценка тяжести состояния больного по шкале APACHE II составляет основу объективизации показаний к операции и дифференцированного подхода в выборе тактики комплексного лечения при панкреонскрозе.
— Использование интегральных шкал позволяет дать объективную оценку результатам различных методов лечения.
На современном уровне для точного прогнозирования течения острого панкреатита и его осложнений целесообразным является определение активности трансаминидазы крови, уровня содержания С-реактивного белка, при возможности, прокальцитонина, в крови больного панкреатитом в динамике заболевания.
На третьем этапе оценка тяжести заболевания основана на определении распространенности и характера поражения ПЖ, забрюшинного пространства и брюшной полости при панкреонекрозе на основании результатов УЗИ, КТ и, при необходимости, лапароскопии.
УЗИ — является обязательным скрининговым методом оценки состояния ПЖ, билиарной системы, брюшной и плевральной полостей при остром панкреатите. УЗИ позволяет поставить диагноз острого панкреатита в 40-85 % случаев, но не всегда помогает достоверно верифицировать форму острого панкреатита, характеризовать состояние забрюшинной клетчатки. Привлечение методики измерения параметров гемодинамики в висцеральных сосудах, плотности ПЖ и забрюшиннюй клетчатки позволяет повысить специфичность, чувствительность и точность УЗИ при панкреонекрозе.
Метод видеолапароскопии позволяет выполнять декомпрессивные операции на желчном пузыре, некрсеквестрэктомии через сформированную оментопапкреатобурсостому, а также проводить динамическую лапароскопию и санацию брюшной полости при панкреатогенном перитоните.
Показания к лечебно-диагностической лапароскопии:
1. Дифференциальный диагноз перитонита различной этиологии.
2. Выполнение лапароскопической холецистостомии при гипертензии в билиарном тракте.
КТ является "золотым стандартом" и самым чувствительным методом исследования при остром панкреатите и его осложнениях, дающим разностороннюю информацию о состоянии ПЖ и забрюшинного пространства, вовлечение в процесс желчевыводящих путей, предлежащих сосудистых структур и отделов желудочно-кишечного тракта.
Показания к КТ при остром панкреатите:
— Верификация клинической формы острого панкреатита при недостаточной информации по клиническим, лабораторным и инструментальным (УЗИ) данным.
— Оценка распространенности и характера поражения ПЖ и различных отделов забрюшинной клетчатки при панкреонекрозе в течение 3- 10 сут от момента госпитализации (сроки исследования определены по оптимальному времени развития демаркации в ПЖ).
— Ухудшение тяжести состояния больного в связи с подозрением на развитие осложненных форм.
— Наличие пальпируемого инфильтрата в сочетании с признаками системной воспалительной реакции и интоксикации.
— Для планирования и проведения транскутанных диагностических и лечебных пункций и/или дренирования жидкостных образований забрюшинной локализации.
— Для определения рационального оперативного доступа и планирования объема хирургического вмешательства.
Данные КТ составляют основу объективизированной оценки тяжести острого панкреатита. КТ с контрастным усилением (панкреатоангиосканирование — не ранее 2 недели) позволяет с высокой точностью диагностировать наличие панкреонекроза, оцепить его распространенность и локализацию, выявить разнообразные ангиогенные осложнения (аррозию панкреатических и парапанкреатических сосудов, образование псевдоаневризм, окклюзию ветвей воротной вены).
Следует выделять пять степеней тяжести заболевания по данным КТ с контрастным усилением, которые могут быть суммированы в виде шкалы интегральной оценки распространенности и характера поражения при остром панкреатите:
A) Нормальная ПЖ (0 байтов).
B) Локальное или диффузное увеличение ПЖ в сочетании с гиподенсивными включениями в ее ткани с нечеткими контурами, расширение панкреатического протока (1 балл).
C) Изменения ткани /7Ж аналогичные стадии В, к которым присоединяются воспалительные изменения, в парапанкреатической клетчатке (2 балла).
D) Изменения С + единичные жидкостные образования вне ПЖ (3 балла).
Е) Изменения D + два или более жидкостных образований вне ПЖ или наличие абсцесса — газообразование (4 балла).
КТ и УЗИ позволяют дифференцировать жидкостные образования от мягкотканных воспалительно-некротических масс, но не обеспечивают диагностику стерильного и инфицированного характера деструкции. В этой связи методом ранней и точной дифференциальной диагностики стерильного панкреонекроза и его септических осложнений является чрескожная пункция под контролем УЗИ или КТ с немедленной окраской мазка биосубстрата по Граму с последующим бактериологическим исследованием для определения вида микроорганизмов и их чувствительности к антибиотикам.
Эндоскопическая визуализация Фатерова сосочка и ретроградная панкреатохолангиография (ЭРХПГ), а при необходимости эндоскопическая папиллотомия показаны при билиарном панкреатите с механической желтухой и/или холангитом (ущемленный камень фатерова соска, рубцовый остиум-, субтотальный палиллосфинктеро-, Y- формы стеноза papillae duodeni major) с учетом выявления расширенного в диаметре общего желчного протока по данным УЗИ (более 8 мм) , в первые часы заболевания.
Лечебная тактика при остром панкреатите
Тактика и методы комплексного лечения деструктивного панкреатита определяются фазой патологического процесса и тяжестью состояния больного. Комплексное лечение больного с тяжелым (оценка по шкалам) деструктивным панкреатитом следует проводить в условиях отделения интенсивной терапии.
Основные направления и методы комплексной терапии деструктивного панкреатита.
1. Интенсивная терапия – направлена на:
- восстановление ОЦБ – нативая плазма (400-800 мл), растворы гидрооксиэтилкрахмала;
- регидратацию – дисоль, трисоль, 0,9% раствор NaCl в зависимости от степени дегидратации (три степени), не менее 2 л;
- коррекцию нарушений КОС?
- поддержание оптимального уровня доставки кислорода – реополиглюкин (10 мл/кг), ВСЛОК.
2. Блокада секреторной функции ПЖ и медиатоза.
- в первую очередь применение октреотида или сандостатина в дозе 50 (вес до 70 кг) или 100 мкг (масса тела больного > 70 кг) 3 раза в сутки подкожно на протяжении 2-5 дней;
- или антиметаболитов (5-фторурацил) в дозе 10 мг/кг однократно, реже двукратно.
Отсутствие доказательных данных об эффективности ингибиторов протеаз при панкреонекрозе не позволяет рекомендовать в настоящее время их дальнейшее клиническое применение.
3. Экстракорпоральная детоксикация только при экзотоксикозе (отравление суррогатами алкоголя)- плазмаферез.
4. Антибактериальная профилактика и терапия.
Основой выбора антибактериальных препаратов при панкреонекрозе являются данные микробиологических исследований. Спектр действия антибиотиков должен охватывать грамотрицательные и грамположительные аэробные и анаэробные микроорганизмы возбудителей панкреатогенной инфекции. Это обеспечивает рациональный эмпирический режим антимикробной профилактики и терапии при панкреонекрозе.
Второй детерминантой эффективности действия антибиотиков является их способность селективно проникать в ткани ПЖ через гематопанкреатический барьер.
В зависимости от различной пенетрирующей способности в ткани ПЖ можно выделить три группы антибактериальных препаратов.
Группа I. Аминогликозиды, аминопенициллины и цефалоспорины I поколения, концентрация которых после внутривенного введения не достигает минимальной подавляющей концентрации (МПК) в ткани ПЖ для большинства бактерий.
Группа II представлена антибактериальными препаратами, тканевая концентрация которых после внутривенного введения превышает МПК в отношении многих микроорганизмов, встречающихся при панкреатической инфекции: защищенные пенициллины широкого спектра: пиперациллин/тазобактам и тикарциллин/клавуланат; цефалоспорины III поколения: цефоперазон и цефотаксим; цефалоспорины IV поколения (цефепим).
III группу составляют фторхинолоны (ципрофлоксацин и особенно пефлоксацин) и карбапенемы (тиенам, имипенем/циластатин, меропенем), которые создают концентрации в панкреатических тканях, значительно превышающие МПК для большинства возбудителей инфекции при панкреонекрозе. Метронидазол также достигает бактерицидной концентрации в тканях ПЖ для анаэробных бактерий, поэтому может быть использован как компонент комбинированной антибактериальной терапии (цефалоспорин III-IV поколения + метронидазол).
Принципы применения антибактериальных препаратов при остром панкреатите:
- при отечном панкреатите антибактериальная профилактика не показана
- диагноз панкреонекроза является абсолютным показанием к назначению антибактериальных препаратов (группа II и III), создающих эффективную бактерицидную концентрацию в зоне поражения.
Дифференцировать сразу цель назначения антибиотиков при панкреонекрозе — профилактическую или лечебную — во многих случаях сложно, учитывая высокий риск инфицирования некротической ПЖ и трудности его определения клинико-лабораторными и инструментальными методами в реальном режиме времени.
- развитие фатального сепсиса при панкреонекрозе требует немедленного назначения антибактериальных препаратов с максимальным эффектом и минимальным побочным действием.
- фактор эффективности должен доминировать по отношению к фактору стоимости.
- препаратами выбора как для профилактического, так и лечебного применения при панкреонекрозе являются: - карбапенемы (тиенам), — фторхинолоны (особенно пефлоксацин) + метронидазол, — цефалоспорины III-IV поколения + метронидазол, - защищенные пенициллины (пиперациллин/тазобактам, тикарциллин/клавуланат).
- продолжительность антибактериальной терапии при панкреонекрозе определяется сроками полного регресса симптомов системной воспалительной реакции.
- принимая во внимание важную роль интестиногенной транслокации бактерий в патогенезе инфекционных осложнений панкреонекроза целесообразно включение режима селективной деконтаминации кишечника, в частности пероральное введение аминогликозидов (гентамицин/тобрамицин 320 мг/сут + полимиксин М 400 мг/сут) или фторхинолонов (пефлоксацин 800 мг/сут).
- панкреонекроз является фактором риска развития грибковой суперинфекции, что определяет целесообразность включения антифунгальных средств (флуконазол) в программу лечения больных панкреонекрозом.
Учитывая динамику патологического процесса при панкреонекрозе от стерильного к инфицированному и часто многоэтапный характер оперативных вмешательств, для эффективной антибактериальной терапии следует предусмотреть смену ее режимов по клинико-лабораторным, а не временным признакам.
5. Нутритивная поддержка показана:
- при тяжести состояния больного с острым панкреатитом по шкале Ranson >2 баллов, по шкале APACHE II >9 баллов,
1) при верификации клинического диагноза панкреонекроза.
2) при выявлении отечной формы панкреатита и наличии положительного ответа на его комплексное лечение в течение 48-72 ч, через 5-7 дней показан переход на естественное питание в соответствии с диетой 1 и 5.
Эффективность длительного (2-3 нед) полного парентерального питания при панкреонекрозе сомнительна. Это объясняется его следующими отрицательными эффектами: атрофия энтероцитов, усиление контаминации и энтерогенной транслокации бактерий и микробных токсинов, опасность развития ангиогенной инфекции и холестаза, имунносупрессия и высокая стоимость этого метода питания. В этой связи более целесообразным и эффективным при панкреонекрозе считают переход на энтеральное искусственное питание в ранние сроки заболевания.
- нутритивную поддержку осуществляют через назоеюнальный зонд, установленный дистальнее связки Трейтца эндоскопическим способом или во время операции.
- питательные смеси — стандартные: берламин, нутризон, нутрилан и др.
- режим энтерального питания — стартовый по темпу и объему, с постепенным переходом от глюкозо-солевых растворов и химусоподобных смесей к олигомерным питательным смесям в возрастающих концентрациях 5-10-20 %.
- в случае развития непереносимости энтерального питания (увеличение уровней амилаз- и липаземии, стойкий парез кишечника, диарея, аспирация) у больных панкреонекрозом показан переход на полное парентеральное питание (р-р аминокислот + 10% жировые эмульсии + р-ры 20% глюкозы + основные электролиты в суточной дозировке) с возвратом к энтеральному питанию по мере восстановления функции желудочно-кишечного тракта.
6. Профилактика острых язв ЖКТ (Н2-блокаторы, ингибиторы протонной помпы (IPP) + антацид (маолокс, фосфалюгель, альмагель)).
7. Хирургическое лечение панкреонекроза
Показаниями к операции при панкреонекрозе являются:
— Панкреатогенный абсцесс, септическая флегмона забрюшинной клетчатки, гнойный перитонит независимо от степени полиорганных нарушений.
Для объективизации показаний к операции необходимо использовать интегральные шкалы оценки тяжести состояния больного (Ranson/Glasgow, APACHE II), распространенности и характера поражения ПЖ и забрюшинной клетчатки (шкала КТ):
— оперативное лечение показано больным, у которых, по данным КТ с контрастным усилением (на 2 и более неделе заболевания), распространенность некроза превышает 50 % паренхимы ПЖ и/или диагностировано обширное распространение некроза на забрюшинное пространство, что соответствует высокому риску инфицирования и фатальных системных осложнений.
Хирургические доступы:
верхне-срединная или верхняя поперечная лапаротомия.
Методы хирургического лечения варьируют, что определяется динамикой патоморфологического процесса в ПЖ, забрюшинной клетчатке и брюшной полости. Техническое решение этапа некрсеквестрэктомии однотипно и предполагает ее выполнение в максимально возможном объеме с сохранением естественных отграничивающих структур — брюшины мезентериального синуса и брыжейки ободочной кишки.
В настоящее время используют три основных метода дренирующих операций при панкреонекрозе, которые обеспечивают различные условия для дренирования забрюшинного пространства и брюшной полости в зависимости от масштаба (распространенности) и характера поражения ПЖ, забрюшинной клетчатки и органов брюшной полости.
Предлагаемые методы дренирующих операций включают определенные технические способы наружного дренирования различных отделов забрюшинной клетчатки и брюшной полости, что обязательно предполагает выбор определенных тактических режимов повторных вмешательств: — программируемых ревизий и санаций всех зон некротической деструкции и инфицирования в различных отделах забрюшинного пространства ("по программе"); — неотложных и вынужденных повторных вмешательств ("по требованию") вследствие имеющихся и/или развившихся осложнений (продолжающаяся секвестрация, неадекватное дренирование, кровотечение и т. д.) в динамике патоморфологической трансформации зон некроза/инфекции в забрюшинном пространстве и брюшной полости.
Методы дренирующих операций забрюшинного пространства и брюшной полости при панкреонекрозе:
- "Закрытый"
- "Открытый"
- "Полуоткрытый"
"Закрытый" метод дренирующих операций включает активное дренирование забрюшинной клетчатки и брюшной полости в условиях анатомической целостности полости сальниковой сумки и брюшной полости. Это достигается имплантацией многоканальных силиконовых дренажных конструкций для введения антисептических растворов фракционно или капельно в очаг деструкции (инфекции) с постоянной активной аспирацией. "Закрытый" метод дренирования предполагает выполнение повторных вмешательств только "по требованию". Контроль за очагом деструкции/инфекции и функцией дренажей осуществляется по результатам УЗИ, КТ, видеооптической техники, фистулографии.
Целесообразно применение методов лапароскопической "закрытой" бурсооментоскопии и санации сальниковой сумки. С использованием специально разработанного инструментария из минилапаротомного доступа осуществляют осмотр ПЖ, некрсеквестрэктомию и формируют панкреатооментобурсостому. Начиная с 3-5-го дня после операции, с интервалом 1-3 сут выполняют этапную санацию. В межоперативном периоде проводят лаваж полости сальниковой сумки.
Применяют методы эндоскопического дренирования и санации забрюшинного пространства через поясничный внебрюшинный доступы. Все большее распространение получают малоинвазивные хирургические методы чрескожного пункционного дренирования парапанкреатической зоны и других отделов забрюшинной клетчатки, желчного пузыря под контролем УЗИ и КТ. Малоинвазивные вмешательства легко выполнимы, малотравматичны и эффективны при обоснованном показании и соблюдении методологии. При неэффективности вышеперечисленных методов дренирования при панкреонекрозе показана лапаротомия.
"Открытый" (основной) метод дренирующих операций при панкреонекрозе предполагает выполнение программируемых ревизий и санаций забрюшинного пространства и имеет два основных варианта технических решений, определяемых преимущественным масштабом (распространенностью) и характером поражения забрюшинного пространства и брюшной полости. Этот метод включает: панкреатооментобурсостомию + люмботомию; — панкреатооментобурсостомию.
Основными показаниями к "открытому" методу дренирования забрюшинного пространства являются: — крупномасштабные формы панкреонекроза в сочетании с поражением забрюшинной клетчатки; — инфицированный панкреонекроз и панкреатогенный абсцесс в сочетании с крупноочаговыми формами инфицированного панкреонекроза; — релапаротомия после неэффективного "закрытого" или "полуоткрытого" методов дренирования.
Показанием к панкреатооментобурсостомии + люмботомии является инфицированный распространенный панкреонекроз в сочетании с поражением парапанкреатической, параколической и тазовой клетчатки. Панкреатооментобурсостому формируют путем подшивания (или без подшивания) фрагментов желудочно-ободочной связки к париетальной брюшине в верхней трети срединной лапаротомной раны по типу (псевдо) марсупиализации и дренированием всех зон некроза/инфекции дренажами Пенроза в комбинации с мно-гопросветными трубчатыми конструкциями. Дренаж Пенроза, именуемый в отечественной литературе как "резиново-марлевый тампон", пропитывают антисептиками и мазями на водорастворимой основе ("Левосин", "Левомеколь"). Такая хирургическая тактика обеспечивает в последующем беспрепятственный доступ к этим зонам и выполнение адекватных некрсеквестрэктомий в программируемом режиме с интервалом 48-72 ч. Этапная замена дренажей Пенроуза позволяет устранить их существенный недостаток, связанный с кратковременной дренажной функцией и экзогенным (ре) инфицированием. По мере очищения забрюшинной клетчатки от некрозов и детрита, при появлении грануляционной ткани показан переход к "закрытому" методу дренирования.
При развитии распространенного гнойного перитонита и крайней степени тяжести состояния больного при распространенном и/или инфицированном панкреонекрозе (тяжелый сепсис, септический шок, тяжесть состояния по шкалам APACHE II > 13 баллов, Ranson >5 баллов) показана лапаростомия (ретроперитонеостомия), проведение программируемых санаций забрюшинной клетчатки и/или брюшной полости через 12-48ч.
"Полуоткрытый"метод дренирования при панкреонекрозе предполагает установку трубчатых многопросветных дренажных конструкций в комбинации с дренажем Пенроуза. В этих условиях лапаротомную рану ушивают послойно, а комбинированную конструкцию дренажей выводят через широкую контрапертуру в пояснично-боковых отделах живота (люмботомия). Такого рода операции получили название "традиционных", когда смена дренажных конструкций, как правило, отсрочена на 5-7 сут. При крупномасштабном некрозе и секвестрации, сложной топографии формируемых каналов зачастую создаются условия для неадекватного дренирования очагов некроза/инфекции и повторные операции у 30-40 % больных выполняют с опозданием во времени в режиме "по требованию". Поэтому для предупреждения этих осложнений потенциал дренирования забрюшинной клетчатки можно повысить, если производить адекватную замену дренажей в режиме "по программе", т. е. не реже чем через 48-72 ч пропитывать дренаж Пенроуза антисептическими растворами, совмещать с сорбентами или мазями на водорастворимой основе ("Левосин"/"Левомеколь"). Реализация адекватной хирургической тактики в условиях "полуоткрытого" метода наружного дренирования при панкреонекрозе достигается выполнением только программируемых оперативных вмешательств.
Следует отметить, что представленные методы "закрытого" и "открытого" дренирования забрюшинной клетчатки не являются конкурирующими, так как при соблюдении методологии и обоснованных показаниях призваны обеспечить адекватную и полную санацию всех зон некротической деструкции и панкреатогенной инфекции.
Вопросы, требующие в первую очередь дальнейшего изучения в доказательных многоцентровых исследованиях
Эффективность различных методов и средств иммунокоррекции.
Эффективность различных методов экстракорпоральной детоксикации.
Показания, сроки и выбор метода дренирующих операций (в том числе малоинвазивных технологий) и режима хирургического лечения при панкреонекрозе.
Кисты и свищи поджелудочной железы.
Кисты поджелудочной железы представляют ретенционные, дегенеративные или пролиферативные полостные образования, расположенные интра- или экстрапанкреатически, источником возникновения которых является поджелудочная железа.
Классификация (J. Berk, W. Haubrich, 1965; Г.Д. Вилявин, 1977; М.В. Данилов, В.Д. Федоров, 1995 в модификации авторов).
Истинные кисты (выстланные слизистым эпителием):
Врожденные:
единичные или множественные кисты только в самой железе (2,8-12% больных);
сочетанные с кистами в других органах (почках, печени и др. – 1,2-5%) – болезнь Линдау;
кистозный фиброз поджелудочной железы;
дермоидные кисты.
Приобретенные:
ретенционные кисты (3,5-15%)– возникают вследствие задержки панкреатического секрета; обычно исходят из дистальной части железы, тонкостенны, достаточно больших размеров, чаще формируются в результате хронического панкреатита, реже опухолевой или паразитарной обтурации панкреатических протоков. При этом оставшаяся часть железы изменена мало, а сами кисты не имеют грубых сращений с окружающими тканями (М.В. Данилов, В.Д. Федоров,1995);
паразитарные кисты (эхинококковые и др.);
опухолевые кисты – первичные (цистаденомы, цистаденокарциномы) – малоотличимы от ретенционных кист (15%) и метастатические.
Псевдокисты (ограничены преимущественно фиброзной капсулой, с возможной эпителизацией последней). Псевдокисты, диаметр которых превышает 6 см почти никогда не ликвидируются самостоятельно (E. Bradley, 1990):
экстрапанкреатические (более 50%) – достигают значительных размеров, могут занимать всю сальниковую сумку, всю эпигастральную область, располагаться в других отделах брюшной полости;
интрапанкуреатические – (21,1-88%) имеют меньшие размеры, располагаются чаще в головке поджелудочной железы и сообщаются с панкреатическими протоками.
Деструктивно-воспалительные – исход панкреонекроза (50% случаев панкреонекроза; 2-10% всех форм острого панкреатита (E/ Bradley и соавт., 1979).
Посттравматические (20-30% травм поджелудочной железы осложняется кистообразованием [R. Bach, C. Fray, 1971]):
открытые и закрытые травмы поджелудочной железы;
оперативные вмешательства на самой железе или прилежащих органах.
Идеопатические.
Сообщающиеся с главным или добавочным панкреатическими протоками и их ветвями и несообщающиеся.
По клиническим признакам и течению:
По степени сформированности (деструктивно-воспалительные и посттравматические кисты) (Р.Г. Карагюлян, 1974):
острые – I стадия (до 1,5 мес с момента возникновения – киста не сформирована, представляет полость распада в сальниковой сумке) – подвергаются спонтанному разрешению в 15-30% случаев (G. Arachna et al, 1983);
подострые – II стадия (2-3 мес – стенка кисты состоит из рыхлой грануляционной ткани);
III стадия (3 мес – 1 год – стенка псевдокисты прочна и тесно связана с окружающими тканями);
IV стадия – свыше года – стенка кисты представлена плотной фиброзной капсулой, хорошо отграничена от окружающих тканей (иногда возможно вылущивание кисты).
По тяжести течения:
простые;
осложненные – 15-20% больных (нагноение, кровотечение, перфорация, малигнизация, фистулообразование, сдавление окружающих органов и др.).
Первичные и рецидивирующие кисты.
Показания к хирургическому лечению.
Сформированные кисты поджелудочной железы – III-IV стадия по Р.Г. Карагюляну ( 1974) (споннтанная регрессия представлена «единичными» случаями, % осложнений достаточно велик).
Подозрение на опухолевый характер кисты или ее малигнизацию.
Осложнение кисты во II стадии формирования (нагноение; кровотечение в полость кисты, желудочно-кишечный тракт, серозную полость; перфорация).
Методики оперативного лечения.
Дистальные резекции железы (с сохранением или без сохранения селезенки)
сформированные кисты тела и хвоста железы малых и средних размеров.
ПДР (панкреатэктомия) – опухолевый характер кисты;
множественные мелкие кисты головки с выраженным болевым синдромом, механической желтухой (трудно исключить опухолевый характер поражения, а также малая эффективность других методов оперативного лечения).
Внутреннее дренирование кист – предложено Омбреданном в 1912 году, -(цистоеюностомия по Генле (1927) или Дюкомбе (1939); трансвентрикулярная цистогастростомия по Юрашу и цистодуоденостомия (М. Киршнер, 1929) – вынужденные операции при обширных кистах проксимальных отделов железы и тесном их сращении с задней стенкой желудка):
однокамерные зрелые псевдокисты;
доказанное (панкреатикография) сообщение кисты с магистральными панкреатическими протоками;
кистозное расширение главного панкреатического протока («цепь озер», ретенционные кисты и др.);
расположение сформированных псевдокист в головке поджелудочной железы.
Сочетание дистальной резекции железы и внутреннего дренирования (сочетание кисты с плохим дренажем магистральных протоков в остающейся части железы) (операция Дюваля).
Наружное дренирование кист.
острые несформированные кисты при быстром увеличении размеров кисты, опасности ее разрыва;
нагноение кист;
рецидив кист в условиях панкреонекроза;
особенность патанатомии сформированных кист (истончение стенки, ее обильная васкуляризация, множество секвестров в полости кисты и др.) не позволяющих выполнить более радикальное вмешательство или делающая его выполнение крайне опасным из-за возможных осложнений;
дополнение внутреннего дренирования с целью повышения его безопасности при определенной патоморфологии кисты.
Свищи поджелудочной железы. Классификация (а.П. Радзиховский, 1985; м.В. Данилов, в.Д. Федоров, 1995).
По этиологии
постпанкреатические (56,9-64,4%). Такие свищи формируютсяу 1-3% больных деструктивным панкреатитом;
посттравматические (18-60%);
после наружного дренирования кист поджелудочной железы.
По клиническому течению
острые (возникают в ближайшие дни после операции, достаточно хорошо поддается консервативному лечению);
хронические (существующие более 2-3 месяцев, без склонности к самостоятельному заживлению, либо с рецидивирующим течением; с наличием сформированного свищевого хода).
По локализации свищевого отверстия
наружные;
внутренние.
По связи с другими органами
изолированные;
смешанные (панкреатобилиарные, панкреатодигестивные).
В зависимости от сообщения с панкреатическими протоками
истинные (терминальные – полные и боковые – неполные)– сообщаются с просветом главного панкреатического протока или сообщающейся кистой магистральных протоков железы;
гнойно-панкреатические – гнойно-панкреатическое отделяемое в результате сообщения с мелкими разветвлениями секвестрированной поджелудочной железы.
Лечение наружных панкреатических свищей.
Радикальные операции, направленные на резекцию свищнесущего отдела железы.
Внутреннее дренирование протоковой системы железы (прямы анастомозы протоков поджелудочной железы с желудочно-кишечным трактом после частичного иссечения, рассечения свища, отделения его от желудка и поперечноободочной кишки и выделения до места сообщения с главным панкреатическим протоком).
Окклюзия истинных панкреатических свищей и протоков (терминальные истинные панкреатические свищи).
Паллиативные операции при гнойно-панкреатических свищах (частичное иссечение свища, вскрытие гнойных затеков с удалением секвестров, гноя из обнаруженных полостей и их последующее наружное дренирование).
Внутренние панкреатические свищи.
Относительно редкое осложнение заболеваний и повреждений поджелудочной железы. Выделяют две разновидности внутренних панкреатических свищей:
Патологическое сообщение протоковой системы поджелудочной железы с полыми органами системы пищеварения (панкреато- и цистодигестивные свищи). Возможно вторичное желудочно-кишечное кровотечение. Требуют последующего длительного консервативного лечения, что заставляет термин «самоизлечение», употребляемый в подобных случаях, поставить в кавычки. Редко возникает необходимость в оперативном лечении.
Патологический дренаж протоков и кист поджелудочной железы в серозные полости: брюшную (цистоперитонеальный свищ, «панкреатический асцит» [Vantini J., Gavallini G.]), плевральную, перикард. Для хронического «панкреатического асцита» характерно:
появление на фоне обычного для больного хронического течения панкреатита;
деструкция небольшого участка стенки хронической кисты поджелудочной железы;
не возникает клиники перитонита;
высокое содержание белка и амилазы в асцитическом содержимом, а также гиперамилаземия и диастазурия в течение длительного времени;
наличие постоянных или приступообразных болей в животе в анамнезе;
пальпаторно определяемое образование в эпигастрии;
наличие в 31% случаев плеврального выпота (Y. Geffory, 1975).
Лечение панкреатоперитонеальных свищей исключительно оперативное (резекции поджелудочной железы вместе с кистой, внутреннее дренирование). Число рецидивов не превышает 10% (Лещевкер В.М., 1982).
Гастродуоденальные кровотечения Терминология
Профузное кровотечение – быстрая потеря как минимум 1 л крови или любое острое кровотечение, приводящее к гиповолемии.
Гиповолемия (острая и хроническая) – уменьшение ОЦК, проявляющееся снижением систолического АД менее 100 мм рт. ст., ЦВД и тахикардией (или постуральные изменения).
Кровотечение из верхних отделов ЖКТ – кровотечение из пищевода, желудка и двенадцатиперстной кишки.
Haematemesis – рвота алой (свежей) кровью.
Maelenemesis – рвота кровью коричневого или черного цвета («кофейной гущей»).
Haematochezia – наличие свежей (алой) крови в кале. Maelena – дегтеобразный стул.
Рвота свежей кровью наблюдается при следующих заболеваниях (в порядке убывания частоты):
Язва двенадцатиперстной кишки;
Гастрит, стрессовые язвы;
Язва желудка;
Варикоз вен пищевода;
Синдром Меллори-Вейсса;
Рак желудка;
Заглатывание крови (носовое кровотечение, кровохарканье);
Эзофагит и язва пищевода;
Рак пищевода;
Аортодуоденальный свищ;
Рак фатерова соска;
Травма пищевода (инородное тело);
Нарушения свертывания крови;
Гемобилия;
Доброкачественная опухоль желудка (лейомиома, гемангиома);
Наследственная геморрагическая телеангиоэктазия;
Эластическая псевдоксантома;
Очень редкие причины.
В 85% случаях кровотечение обусловлено язвой желудка, двенадцатиперстной кишки или гастритом.
Необходимо установить:
Факт кровотечения.
Продолжается кровотечение или нет.
Причину, механизм и источник кровотечения.
Степень кровопотери.
Неотложная помощь
восстановить ОЦК; (2) определить источник кровотечения; приблизительно оценить степень кровопотери; установить продолжается кровотечение или нет ( в 85% случаев профузное кровотечение из верхних отделов ЖКТ прекращается до поступления в клинику или сразу после госпитализации).
Объем кровопотери можно оценить по изменению АД и ЧСС при перемещении больного из положения лежа в положение сидя.
Таблица 1 Изменение ЧСС и АД при гиповолемии
-
ОЦК
Положение больного
Лежа на спине
Сидя
мл
%
АД
ЧСС
АД
ЧСС
Норма
100
Норма
Норма
Норма
Норма
-500
-5
Норма
Норма
Норма
Норма или
-1000
От –10 до – 15
Норма
Норма или
Норма или
-1500
-20
Норма или
или
-2000
-30
или
или
В крупную вену одной руки устанавливают катетер большого диаметра для измерения ЦВД, в одну из вен другой руки – катетер для в/в инфузий.
Определяют группу крови.
Из вены берут кровь для определения протромбинового времени и активированного частичного тромбопластинового времени (АЧТВ) (дисфункция печени, коагулопатия).
Для переливания крови заказывают сразу не менее 6 доз (одна доза – 500 мл).
Каждая доза эритромассы повышает гематокрит на 2-3%. И наоборот, потеря каждых 500 мл снижает гематокрит на 2-3%.
После начала трансфузии приступают к сбору анамнеза.
После стабилизации состояния больного проводят эндоскопию и в случае ее неинформативности и продолжающемся кровотечении селективную ангиографию.
Можно произвести эмболизацию кровоточащего сосуда или оставить ангиографический катетер для введения вазопрессина в течение 2-6 суток.
Рентгеноконтрастные исследования с барием противопоказаны.
Тактика лечения.
Кровотечение остановилось. Источник известен. При язве желудка или duodenum если на дне язвы виден сосуд показано срочное хирургическое лечение или эндоскопический гемостаз. Если видимого сосуда нет – введение в желудок антацидов до рН в желудке на уровне 5,0
Кровотечение остановилось, но источник выявить не удалось. Селективная ангиография. Зонд в желудок и введение антацидов (под наблюдением за отделяемым из желудка) до рН выше 6,0. Антациды каждый час. Антихолинергические препараты на ранних сроках после профузного ЖКК противопоказаны. Больные не должны принимать пищу минимум 72 ч.
Кровотечение продолжается. Эндоскопическая диатермия (не удается прижечь сосуд диаметров 2 мм и более); склеротерапия; обкалывание места кровотечения раствором адреналина (1:10 000), 98% этанолом, гипотоническим раствором хлорида натрия.
При кровотечении из варикозных вен пищевода – зонд Блейкмора, вазопрессин в/в 20 ед на 100 мл 5% глюкозы со скоростью 0,2 ед в мин (1 мл/мин), не более 2 мл/мин. При назначении вазопрессина необходимо регистрировать ЭКГ и следить за показателями гемодинамики. При появлении побочных симптомов вводить атропин при брадикардии, нитроглицерин при стенокардии.
Введение соматостатина в/в.
Экстренная операция показана:
Сочетание прободения и кровотечения.
Гемодинамика не стабилизировалась после быстрого переливания 2500 мл крови.
АД и ЧСС стабилизировалось, но для поддержания их на нормальном уровне требуется свыше 1500 мл крови менее чем за 24 ч.
Кровотечение продолжается более 24 ч. Лишь немногие больные в состоянии перенести кровотечение, продолжающееся в течение 24-48 ч.
Рецидив кровотечения.
Отсутствует достаточное количество крови.
Неизбежно повторное кровотечение (например при аортодуоденальном свище).
По Стиллману:
А. Потерях, превышающих 2000 мл в целом или быстрая кровопотеря более 1000 мл.
Б. Кровоточащий сосуд виден при эндоскопии.
В. Гемотрансфузия невозможна из-за отсутствия крови или редкой группы крови.
Г. Повторное кровотечение.
Низкие желудочно-кишечные кровотечения
О кровотечениях из нижних отделов желудочно-кишечного тракта (ЖКТ) принято говорить в тех случаях, когда источник кровотечения располагается в кишечнике дистальнее связки Трейтца Кровотечения из нижних отделов ЖКТ могут быть явными (умеренно выраженными или массивными) или скрытыми (оккультными).
Этиология
Основные причины кровотечений из нижних отделе! ЖКТ (их сравнительная частота может варьировать е зависимости от возраста) представлены следующим образом:
• ангиодисплазии тонкой и толстой кишки;
• дивертикулез кишечника (в том числе дивертикул Меккеля);
• опухоли и полипы толстой кишки;
• опухоли тонкой кишки;
• хронические воспалительные заболевания кишечника;
• инфекционные колиты;
• ишемические поражения кишечника;
• радиационный колит;
• туберкулез кишечника;
• геморрой и анальные трещины;
• инородные тела и травмы кишечника;
• аортокишечные свищи:
• гельминтозы.
Кавернозные гемангиомы и ангиодисплазии слизистой оболочки тонкой и толстой кишок (артериовенозные мальформации) оказываются причиной массивных кишечных кровотечений в 30 % случаев. Выделяют три типа ангиодиспластических поражений кишечника.
Ангиодисплазии 1 типа выявляются "главным образом" у пожилых людей и локализуются в толстой кишке. Размеры пораженных сосудов обычно не превышают 5 мм, что затрудняет их диагностику даже при лапаратомии. Нередким бывает сочетание указанных сосудистых изменений со стенозом устья аорты или пролапсом ми-трального клапана.
Ангиодисплазии II типа носят, как правило, врожденный характер, выявляются у лиц моложе 50 лет, локализуются в тонкой кишке, имеют больший размер по сравнению с ангиодисплазиями 1 типа и обычно хорошо видны на операции.
Клинические проявления кровотечений из низких отделов ЖКТ |
|
Характер кровотечения |
Возможный источник |
Алая кровь, выделяется в виде капель
Прожилки алой крови в кале коричневого цвета Темно-красная кровь, равномерно перемешанная с калом Черный дегтеобразный стул (мелена) |
Поражение прямой кишки (геморрой, трещины) Поражение сигмовидной кишки
Поражение проксимальных отделов толстой кишки Поражение тонкой кишки |
К ангиодисплазиям III типа, обозначаемым обычно как синдром Вебера — Ослера — Рандю, относятся телеангиоэктазии, которые могут располагаться в любом отделе ЖКТ и сочетаться с телеангиоэктазией слизистой оболочки полости рта, носоглотки, а также кожных покровов Этот синдром наследуется по аутосомно-доминантному типу, и его признаки у родственников больного часто удается выявить при сборе семейного анамнеза
Дивертикулез кишечника как причина массивных кишечных кровотечений обнаруживается в 17 % случаев При этом, несмотря на более частую локализацию дивертикулов в левой половине толстой кишки, источником кровотечения служат преимущественно дивертикулы правой половины Кровотечения чаще возникают при наличии дивертикулита, но могут наблюдаться и при отсутствии воспаления, развиваясь вследствие травматизации кровеносных сосудов У большинства больных с дивертикулами кишечника кровотечения возникают однократно, однако у 20 — 25 % пациентов отмечаются повторные геморрагии
Массивные кровотечения у детей и лиц молодого возраста в редких случаях могут быть вызваны изъязвлениями слизистой оболочки дивертикула подвздошной кишки (дивертикула Меккеля) Изъязвленные злокачественные опухоли и полипы толстой кишки редко выступают причиной массивных кишечных кровотечений, чаще способствуя развитию умеренно выраженных или скрытых кровотечений
Кровотечения могут встречаться при воспалительных заболеваниях кишечника (неспецифическом язвенном колите или болезни Крона), острых инфекционных колитах (например, псевдомембранозном колите), опухолях тонкой кишки (лимфомы), туберкулезе кишечника.
Другими причинами кровотечений из нижних отделов ЖКТ могут быть острые ишемические поражения кишечника, возникающие в результате тромбоза или эмболии ветвей мезентериальных артерии (при атеросклерозе, васкулитах, травме живота), радиационный колит, развивающийся у больных, получавших курсы лучевой терапии по поводу злокачественных новообразований органов брюшной полости и забоюшинного пространства, (включая опухоли гинекологической и урологической природы.
Диагностика
К диагностическим методам, применяемым для установления источника кровотечений из нижних отделов ЖКТ, относятся
• пальцевое ректальное исследование,
• исследование кала на скрытую кровь,
•аноскопия,
•ректороманоскопия,
•колоноскопия,
• ангиография,
• сцинтиграфия,
• компьютерная томография и ЯМР
Установление возможного источника кровотечения из нижних отделов ЖКТ предполагает тщательный сбор анамнеза заболевания (например, выявление предшествующих курсов лучевой терапии.
Диагностическое значение боли при кровотечении из нижних отделов ЖКТ
Характер болей
|
Возможные причины
|
Внезапные боли с последующим профузным кишечным кровотечением
|
Острые или хронические воспалительные заболевания кишечника |
Боли предшествуют кишечным кровотечениям
|
Разрыв аневризмы аорты в просвет тонкой кишки
|
Боли в области прямой кишки, возникающие во время дефекации или после нее
|
Геморрой, анальные трещины |
Безболевое кишечное кровотечение
|
Телеангиоэктазии слизистой оболочки кишечника
|
Если при использовании эндоскопических методов источник кишечного кровотечения установить не удается, применяются селективная ангиография и сцингиграфия.
При ангиографии с заполнением бассейна верхней и нижней брыжеечных артерий можно обнаружить выход контрастного вещества из кровеносных сосудов (экстравазаты) в просвет кишечника. Метод оказывается полезным в диагностике кишечных кровотечений, связанных с дивертикулезом и ангиодисплазией, и дает положительные результаты в 40 — 85 % случаях, если объем кровопотери превышает 0,5 мл в 1 мин.
Сцинтиграфия, проводимая с эритроцитами, меченными пертехнетатом технеция (99тТс) или тромбоцитами, меченными In, позволяет выявить источник кровотечения, если объем кровопотери превышает 0,05 — 0,1 мл в 1 мин. Сцинтиграфия считается более чувствительным методом диагностики кишечных кровотечений, чем ангиография, и к тому же относится к неинвазивным методам. Вместе с тем Сцинтиграфия требует больше времени для проведения и, кроме того, сопровождается накоплением радиоактивных изотопов в печени и селезенке, что может маскировать экстравазаты данной области и, таким образом, затруднять интерпретацию результатов исследования.
По показаниям могут использоваться и другие методы исследования: ультрасонография (включая эндоскопическую), определение раково-эмбрионального антигена, исследование кала на патогенную микрофлору, специальные серологические исследования. В диагностике аортокишечных фистул может оказаться полезным применение компьютерной томографии или магнитной резонансной томографии.
Если перечисленные диагностические методы не позволяют обнаружить причину кровотечения, то при его продолжении и прогрессировании анемии ставится вопрос о проведении диагностической лапаротомии. При диагностической лапаротомии также далеко не всегда удается выявить источник кровотечения, однако ее эффективность можно повысить при интраоперационном проведении эндоскопического исследования кишечника.
Оккультные кишечные кровотечения распознаются только при обнаружении положительной реакции кала на скрытую кровь. Тесты для выявления скрытой крови широко используются в настоящее время в скрининговых исследованиях, проводимых с целью раннего распознавания колоректального рака.
Лечение
В 80 % случаев острые кишечные кровотечения останавливаются самопроизвольно. При умеренно выраженных кровотечениях проводят консервативную терапию, характер которой определяется заболеванием, послужившим причиной их развития.
В тех случаях, когда кишечные кровотечения бывают обусловлены дивертикулезом, их остановка в 90 % случаев достигается с помощью инфузии вазопрессина во время проведения ангиографии. При этом катетер может быть оставлен в месте введения для пролонгированной инфузионной терапии, поскольку в течение первых 48 ч кровотечение нередко рецидивирует.
Эндоскопические меоды гемостаза при острых желудочно-кишечных кровотечениях Показания
Основными показаниями к неотложному эндоскопическому исследованию верхних отделов пищеварительного тракта являются симптомы гастродуоденального кровотечения либо подозрение на него и необходимость проведения гемостаза через эндоскоп.
Показанием к повторной динамической эзофагогастродуоденоскопии (ЭГДС) являются:
— необходимость активного мониторинга источника кровотечения в связи с сохраняющимся риском его рецидива (активная контрольная ЭГДС);
— рецидив кровотечения, развившийся в стационаре у больного предельного операционно-анестезиологического риска с язвенным кровотечением либо у пациента с кровотечением неязвенной этиологии («ЭГДС по требованию»).
Отказ от экстренной эндоскопической диагностики может быть оправдан при продолжающемся профузном кровотечении, особенно если по данным анамнеза можно предположить его язвенную этиологию, а также у больных в агональном состоянии.
ЭГДС при крайне тяжелом состоянии «декомпенсированных» больных целесообразна в ситуации, когда «эндоскопическое вмешательство отчаяния» предпринимается непосредственно для остановки продолжающегося кровотечения.
Показания к проведению эндоскопического гемостаза при первичном осмотре:
— продолжающееся в момент эндоскопического исследования кровотечение — Forrest I для язвенных кровотечений;
продолжающееся струйное аррозивное кровотечение — Forrest la — встречается у 8—10% больных, из них риск потенциального рецидива кровотечения существует у 80—85%;
продолжающееся капиллярное кровотечение в виде в виде диффузного просачивания - Forrest Ib — встречается у 10—15% больных,
— остановившееся в момент эндоскопического осмотра кровотечение со стигмами (следами недавно перенесенного кровотечения) в дне и/или краях источника — Forrest II для язвенных кровотечений;
— видимый крупный тромбированный сосуд — Forrest IIa — встречается у 25—40% больных из них риск потенциального рецидива кровотечения существует у 40—50%;
— плотно фиксирован к язвенному кратеру тромб-сгусюк — Forrest IIb — встречается у 15—20°о больных, из них риск рецидива кровотечения существует у 40—50%;
— мелкие тромбированные сосуды в виде темно-коричневых или темно-красных пятен — Forrest IIc — встречаются у 10 % больных, из них риск потенциального рецидива кровотечения существует у 5%.
Показания к проведению эндоскопического гемостаза при динамической ЭГДС:
— отрицательная динамика состояния источника кровотечения, заключающаяся в сохранении интактными ранее «обработанных» сосудистых структур, появлении новых сосудов либо в развитии рецидива кровотечения (повторный эндоскопический гемостаз выполняется в том случае, если больной не подлежит экстренной операции "по рецидиву";
- выявление сосудистой дуги в непосредственном близости (< 1 мм) от дна язвенного дефекта по данным эндоскопической ультрасонографии.
Эндоскопическая ультрасонография источника кровотечения показана:
- при гастродуоденальных кровотечениях из острых и хронических язв, артерио-венозных мальформаций;
— после его остановки эндоскопическими методами;
— во всех случаях, когда необходимо получить достоверные признаки пенетрации или прикрытой перфорации язвенного дефекта, проконтролировать эффективность эндоскопического гемостаза, уточнить прогноз риска рецидива кровотечения, а следовательно, показания к срочной операции либо к повторному воздействию на источник кровотечения через эндоскоп.
Клинико-эндоскопические критерии высокого риска рецидива гастродуоденального кровотечения:
Клинические и лабораторные
Клинические признаки геморрагического шока
Обильная рвота кровью и/или массивная мелена
Дефицит глобулярного объема, соответствующий тяжелой степени кровопотери
Эндоскопические
Продолжающееся артериальное кровотечение в момент исследования Крупные тромбированные сосуды в язвенном кратере Язвенный дефект большого диаметра и глубины Локализация язвы в проекции крупных сосудов.
Одним из многообещающих способов контроля и прогнозирования рецидива гастродуоденального кровотечения является метод эндоскопической допплеровской ультрасонографии, который позволяет выявить активный кровоток в сосудах, расположенных в дне язвенного дефекта, но недоступных осмотру при обычной эндоскопии в видимом свете. Наиболее обнадеживающе выглядят результаты авторов, использующих для этих целей импульсную эндоскопическую допплеровскую ультрасонографию.
Оценка риска рецидива язвенного гастродуоденального кровотечения методом решающего правила:
Параметр
|
Градация параметра
|
Баллы
|
Признаки геморрагического шока на догоспитальном этапе или при поступлении
|
1)нет 2) да
|
-1 +2
|
Болезни печени (гепатит, цирроз, опухоль) в анамнезе или в момент поступления
|
1)нет 2) да
|
0 +6
|
Частота сердечных сокращений при поступлении в стационар
|
1) <100в 1 минуту 2) > 100 в 1 минуту
|
-1 +3
|
Количество патологических примесей в желудочном содержимом при зондировании
|
1) отсутствие 2) небольшое (до 150 мл) 3) умеренное (150-500 мл) 4) большое (>500 мл)
|
-6 +1 +3 +5
|
Дефицит объема циркулирующей крови
|
1) менее 10% 2) от 10 до 20% 2) более 20%
|
0 +2 +5
|
Глубина язвы двенадцатиперстной кишки
|
|
-1 +5
|
Глубина язвы желудка
|
1)<=6мм 2) >6 мм
|
+5
|
Эндоскопическая ультрасонография источника кровотечения — еще один шаг к объсктивизации и повышению достоверности прогноза рецидива гастродуоденального кровотечения. Исследование выполняется либо непосредственно после окончания эндоскопического гемостаза, либо в ближайшие 12—24 ч, то есть в то время, которое отпущено на принятие решения о необходимости срочной операции.
С помощью радиально сканирующего эхоэндоскопа GF-UM 20 (частота сканирования 7,5/12 МГц) или ультразвуковых мини-зондов MH-2R MH-3R (частота сканирования 12/20 МГц) определяются размеры и глубина язвы соответственно слоям стенки желудочно-кишечного тракта, распространение за пределы серозной оболочки -пенетрация, точная топографическая локализация дефекта, наличие в дне язвы сосудистых структур, их размеры и глубина залегание.
При выявлении или сохранении в процессе динамической эндосонографии в непосредственной близости (1 мм) от дна язвенного дефекта сосудистых структур в виде линейных дугообразных анэхогенных образований ~ 1,5 мм в диаметре (которые невозможно обнаружить при традиционной эндоскопии в видимом свете) делают вывод о неэффективности эндоскопической терапии и сохраняющейся угрозе повторного кровотечения. Это, в свою очередь, в соответствии с тактическими установками позволяет определить показания к срочному оперативному вмешательству либо к выполнению повторного эндоскопического воздействия на источник кровотечения.
Методы эндоскопического гемостаза
Методы |
Тип
|
Основной механизм действия
|
Термические |
Электрокоагуляция Термокаутеризация |
Тромбоз сосуда в зоне кровотечения |
|
Лазерная фотокоагуляция Аргоноплазменная коагуляция.
|
|
|
|
|
Инъекционные |
Адреналин
|
Вазоконстрикция
|
|
Алкоголь. Склерозанты
Цианакрилаты
|
Химическая коагуляция + дегидратация
Клеевая пломбировка
|
|
Тромбин
|
Клеевая пломбировка |
|
Фибриновый клей |
|
|
|
|
Механические |
Клипирование. Лигирование |
Лигирование сосуда и источника желудочно-кишечного кровотечения |
Термокаутеризация (прижигание или тепловая коагуляция) многими специалистами рассматривается как метод выбора для проведения эндоскопического гемостаза.
В отличие от диатермокоагуляции действующим началом термокаутеризации является не электрический ток, а разогреваемый им до температуры свыше 100 °С рабочий наконечник термозонда. С помощью такого «мини-паяльника» осуществляются прижигающее и, как результат, ге-мостатическое воздействие на кровоточащий или тромбированный сосуд.
Благодаря тому, что наконечник термозонда покрыт тефлоновым слоем, он меньше пригорает к кровяному сгустку. Одновременно сохраняются все положительные свойства контактного метода. Подаваемая под давлением струя жидкости одновременно охлаждает зонд и смывает с источника кровотечения накопившуюся кровь, обеспечивая более выгодные условия для каутеризации.
При остановке продолжающегося кровотечения наконечник зонда целесообразно прижимать непосредственно к кровоточащему сосуду, прекратив таким образом временно кровотечение, а затем приступать к нагреву рабочей головки термозонда.
При остановке продолжающегося кровотечения применяется достаточно большое количество теплоты — 20—30 Дж. Для коагуляции тромбиро-ванных сосудов и создания более прочного коагулята воздействуют более низкими параметрами энергии — 10—20 Дж.
Степень нагрева термозонда легко дозируется и регулируется; при соблюдении элементарных правил работы он не вызывает глубоких ожогов и успешно используется практически при всех видах неварикозных гастродуоденальных кровотечений.
Лазерная фотокоагуляция источника кровотечения, пережив этап повального увлечения и обнадеживающего энтузиазма, в последние годы практически отошла на второй план.
В большинстве клинических ситуаций лазерная фотокоагуляция уступила место аналогичным по эффективности, но значительно менее дорогим и громоздким, зато более простым в исполнении и безопасным как для пациента, так и для медицинского персонала методам эндоскопического гемостаза.
Одним из важнейших преимуществ метода аргоноплазменной коагуляции состоит в том, что он является бесконтактным, а следовательно, лишенным побочных эффектов в виде рецидива кровотечения вследствие отрыва тромба-сгустка.
Аргоноплазменную коагуляцию можно использовать для гемостаза в труднодоступных участках за счет сродства аргоновой плазмы к зонам высокой электропроводимости (жидкая кровь и свежие тромбы) и режима работы путем «стекания за угол».
Немаловажен и тот факт, что методика практически не обладает эффектом -«минус тканью. Аргоноплазменная коагуляция минимально испаряет и повреждает ткани и не «выжигает» углубление в источнике кровотечения, а формирует плотный защитный слой, как бы заваривая его.
Коагулирующий эффект аргоновой плазмы легко дозируется. Она не обладает выраженным термическим воздействием на глубокие слои кишечной стенки: проникновение аргоновой плазмы вглубь ткани составляет не более 2-3 мм. Следовательно, аргоновая плазма безопасна и не вызывает перфорации органов.
Первые клинические опыты показали, что использование аргоновой плазмы особенно эффективно при кровотечениях из сосудистых пороков развития, таких, как поражения Дьелафуа, телеангиэктазии, когда необходимо обеспечить мощный гемостатический эффект и чрезмерно не разрушить слизистую оболочку. Однако аргоноплазменная коагуляция находит все более широкое применение при кровотечениях язвенной этиологии и опухолях.
Инъекционные методы гемостаза широко используются в клинической практике. Механическое сдавление сосудов раствором жидкости в сочетании с местным гемостатическим склерозирующим действием практически всегда приводит к временной остановке кровотечения или по крайней мере к уменьшению его интенсивности. Это обстоятельство в ряде случаев позволяет применять инъекционные методы в качестве самостоятельных либо в комбинации с другими методами эндоскопического гемостаза.
Показания к неотложным оперативным вмешательствам
Экстренная операция
Продолжающееся профузное гастродуоденальное кровотечение язвенной природы (с ранее верифицированным диагнозом язвенной болезни)
Невозможность остановки гастродуоденального кровотечения неоперативными методами, включая лечебную эндоскопию.
Рецидив кровотечения в стационаре (преимущественно при кровотечениях язвенной этиологии)
Срочная операция
Клинико-эндоскопические признаки большой угрозы рецидива кровотечения (преимущественно у больных с язвенными гастродуоденальными кровотечениями, после подготовки больного к операции в течение 12-24 ч).
Эндобилиарные вмешательства в диагностике и лечении опухолей гепатопанкреатодуоденальной зоны
Лечение больных с механической желтухой остается актуальной проблемой абдоминальной хирургии. Отмечается неуклонный рост числа больных с механической желтухой обусловленной опухолевой обструкцией внепеченочных желчных протоков. Большинство больных поступают в хирургические отделения уже с запущенными формами опухолевого процесса, что обусловлено поздней обращаемостью больных из-за не выраженности клинической симптоматики на ранних стадиях заболевания. Вследствие трудностей дифференциальной диагностики, зачастую больные переводятся в хирургическое отделение из инфекционных и терапевтических отделений с длительностью желтухи 2-3 недели.
Наибольшие возможности для осуществления радикальных операций имеются при опухолях БДС (большого дуоденального сосочка) и ампулярного отдела холедоха, при лечении опухолей других локализаций установлено, что даже отсутствие очевидных метастазов и других проявлений распространенного опухолевого процесса операция может носить эксплоративный характер (А.А.Соколов и соавт 2000г.) Возможность выполнения радикальных операций составляет не более 20 % (Lay 1987, В.Д Федоров 2003г) и совсем немного больных переживают 5 лет после вмешательства.
Таким образом, распространенность злокачественного процесса, пожилой возраст, наличие желтухи и холангита в большинстве случаев приводят к невозможности выполнения радикальных операций, а паллиативные вмешательства направленные на восстановление желчеоттока являются методом выбора. В настоящее время паллиативные вмешательства при механической желтухе разделяют на хирургические билиодигестивные анастомозы и эндопротезирование, причем чреспеченочный доступ для установки протезов считается более инвазивным чем эндоскопический (F.Prat, O.Chapat et.all 1998)
У инкурабельных больных с опухолевым поражением гепатикохоледоха, головки поджелудочной железы и периампулярной зоны одним из методов восстановления пассажа желчи является эндопротезирование - чрескожным чреспеченочным способом или ретроградно через эндоскоп. Эти вмешательства позволяют устранить желтуху, холангит, тем самым улучшить качество и продолжительностьт жизни (Резолюция IV конференции хирургов-гепатологов России и стран СНГ. Тула 1996г.) В настоящее время общепризнанной стала тенденция разрешать механическую желтуху малоинвазивным способом. При этом отмечается снижение послеоперационных осложнений и летальности, уменьшение продолжительности стационарного лечения . Наиболее эффективным и перспективным методом восстановления желчеоттока является транспапиллярное эндопротезирование гепатикохоледоха с использованием различных дуоденобилиарных стентов. (Ю.И. Галлингер 2000г.)
Классификация опухолей гепатопанкреатодуоденальной зоны.
До настоящего времени не существует единой классификации опухолевых поражений билиопанкреатодуоденальной зоны, которая позволила бы объективно подойти к выбору рационального метода декомпрессии.
Н.Н Блохин и соавт (1982г) раковые опухоли внепеченочных желчных протоков (ВПЖП) макроскопически разделяют на:
ворсинчато-папиллярные формы, располагающиеся в просвете протока
диффузно-инфильтрирующие проток в виде плотного тяжа, иногда мультицентрического типа, чаще в области ворот печени
полиповидные
опухоли в виде массивного конгломерата, прорастающие в соседние органы
Японские авторы (Todoroki T. еt al., 1980) макроскопически классифицируют рак ВПЖП в зависимости от характера роста в желчный проток на полиповидный, узелковый, скиррозно констриктирующий и диффузно инфильтрирующий.
При билиарных опухолевых обструкциях в области ворот печени большинство хирургов придерживается классификации Бисмута (Clin.Radiol.1997-3, 213-219)
I тип - блок только магистрального печеночного протока;
II тип - блок правого и левого печеночных протоков;
III тип - блок сегментарных билиарных ветвей одной из долей печени;
IV тип - блок сегментарных ветвей обеих долей.
Федоров В.Д. и соавт. (1999) предложил следующую гистологическую классификацию опухолей поджелудочной железы:
1. Эпителиальные опухоли
из ацинарных клеток (аденомы, ацинарно-клеточный рак);
из протокового эпителия: цистоаденомы, аденокарциномы, плоскоклеточный анапластический рак;
из эндокринных клеток («карционоиды»-опухоли нейроэндокринной системы);
смешанного строения;
неясного гистогенеза
2. Неэпителиальные опухоли.
3. Дисонтогенетические опухоли.
4. Опухоли из кроветворной и лимфоидной тканей.
5. Метастатические опухоли.
На современном этапе в качестве основной классификации для определения стадии рака поджелудочной железы принята Международная классификация по факторам ТNM:
Классификация UICC, 1997 г.
Стадия рака |
Т |
N |
М |
I |
T1-2 |
N0 |
M0 |
II |
Т3 |
N0 |
M0 |
III |
Т1-3 |
N1a |
M0 |
IVа |
T1-3 T4 |
N1b N0-1 |
M0 M0 |
IVb |
Т1-4 |
N0-1 |
M1 |
Tx - первичная опухоль недоступна оценке; Т0- нет признаков первичной опухоли; Т1 - опухоль в пределах поджелудочной железы, размеры которой не превышают 2 см в наибольшем измерении; Т2 - опухоль в пределах поджелудочной железы, размеры которой превышают 2 см в наибольшем измерении; Т3 - распространение опухоли на двенадцатиперстную кишку, желчный проток, парапанкреатические ткани (забрюшинную клетчатку, брыжейку тонкой и поперечно-ободочной кишок, малый и большой сальник и брюшину); Т4 - распространение опухоли на желудок, селезенку, толстую кишку, крупные сосуды (воротную вену, чревный ствол, верхнюю брыжеечную артерию, общую печеночную артерию, кроме селезеночных сосудов); Nx -регионарное метастазирование недоступно оценке; N0 - отсутствие метаста-зирования в регионарные лимфоузлы; N1 - наличие метастазирования в регионарные лимфоузлы; N1a - единичный метастаз в один регионарный лимфоузел; М1b - множественные метастазы в нескольких регионарных лимфоузлах; Мх - отдаленное метастазирование недоступно оценке; М0 -отсутствие отдаленного метастазирования; М1 - наличие отдаленного метастазирования.
Клиника и диагностика
Клинические проявления опухолей гепатопанкреатодуоденальной зоны проявляются только при развитии обструкции просвета желчных протоков, когда появляется стойкая нарастающая желтуха, кожный зуд и небольшие боли в правом подреберье. Если больного не оперировать, то в течение нескольких месяцев он погибает от холангита, септицемии и печеночной недостаточности, обусловленной билиарным циррозом печени. Все это происходит на фоне изнуряющего зуда кожи и бессонницы.
В комплексной диагностике рака гепатопанкреатодуоденальной зоны обращают внимание на биохимические показатели крови, свидетельствующие о холестазе. Эзофагогастродуоденоскопия позволяет оценить состояние желудка, двенадцатиперстной кишки и БДС, наличие оттока желчи. При этом у 30% больных раком головки поджелудочной железы отмечается сужение просвета двенадцатиперстной кишки, у 11,9% прорастание опухолью стенки двенадцатиперстной кишки, с развитием дуоденальной непроходимости у 5-10%) . (Кубышкин В.А., Вишневский В.А. 2003). Биопсия позволяет верифицировать диагноз рака БДС или прорастание опухоли поджелудочной железы. УЗИ, РКТ, МРТ брюшной полости выявляют внутрипеченочную гипертензию, а также могут указать на опухолевый генез гипертензии и определить степень распространенности опухолевого процесса. Наиболее информативными (90-98%) в плане определения локализации и степени выраженности обструкции желчных протоков являются рентгенологические методы с прямым контрастированием желчных протоков, антеградно (чрескожночреспеченая пункции), либо ретроградно чреспапиллярно. При чем во время ЭРХПГ (эндоскопической ретроградной холангиографии) возможен забор материала для цито- и гистологической верификации злокачественного процесса с определением степени дифференцировки. Эндоскопическое УЗИ позволяет диагностировать опухоли размерами менее 30мм, но не менее 5мм в диаметре. Отсутствие на пути УЗ луча помех, исходящих от выходного отдела желудка, двенадцатиперстной и\или толстой кишки, позволяет получить качественное изображение панкреатодуоденальной зоны. (Панцырев Ю.М., Орлов С.Ю. с соавт. 1999г). По данным Gress F.G. et al (1999) для эндоскопического УЗИ точность диагностики T стадии заболевания составляет 85%, N стадии 72%, а для КТ 30% и 55% соответственно. Благодаря корректной визуализации внутренней структуры кистозных опухолей эндоскопическое УЗИ позволяет дифференцировать характер исследуемых образований с точностью 92-96% (Kazumitsu Koito et al., 2001). По данным Tsuyoshi Furukawa et.al 1994 ультразвуковое внутрипротоковое исследование поджелудочной железы наиболее чувствительно в диагностике рака и составляет 100% (УЗИ-92,9%, КТ-64,3%, ЭРПГ 85,7%)
Лечение
Наиболее ответственный момент в определении тактики лечения опухолей ВПЖП это определение показаний к радикальной операции. Он должен основываться по совокупности данных современных высокоинформативных методов инструментального обследования, с обязательным выполнением УЗИ, КТ, МРТ, ЭРХПГ, лапароскопии. При этом даже наличие подозрений на распространенность опухолевого процесса, отдаленное метастазирование, высокий операционно-анестезилогический риск должны склонять хирурга к выполнению паллиативного вмешательства. Потому как зачастую несмотря на применение информативных методов дооперационной диагностики, при выполнении лапаротомии опухоль оказывается неоперабельной, либо в ближайшее время после операции больные погибают даже с использованием современных методов интенсивной терапии. Только у молодых пациентов с невыраженной сопутствующей патологией может быть оправдан риск этой тяжелой операции.
В случае отказа от радикальной операции очень важно для определения выбора способа паллиативного разрешения желтухи оценить функцию желчного пузыря, в плане возможности наложения холецистоэнтероанастомоза, как наименее технически сложного и травматичного. При этом наиболее достоверны данные УЗИ и ЭРХПГ. При выполнении дуоденоскопии возможно определить наличие дуоденальной непроходимости, обусловленной либо прорастанием опухоли, либо сдавлением опухолью просвета двенадцатиперстной кишки. В этой ситуации необходимо наложение гастроэнтероанастомоза.
Предлагается следующая лечебно-диагностическую программа при механической желтухе опухолевого генеза:
1. Верификация опухолевого генеза
механической желтухи и определение
стадии заболевания
2. Определение объема оперативного
вмешательства
3. Определение способа паллиативной
операции
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ЧРЕСПАПИЛЛЯРНОМУ ЭНДОБИЛИАРНОМУ ПРОТЕЗИРОВАНИЮ
Основной целью эндопротезирования является восстановление естественного желчеотделения.
Показаниями к эндопротезированию являются
обструкция желчных протоков неоперабельными опухолями (доброкачественными и злокачественными)
нарушения желчеоттока, обусловленное неоперабельной опухолью БДС, сдавлением или прорастанием желчных протоков опухолями окружающих органов, метастазами
Как первый этап для разрешения механической желтухи перед оперативным вмешательством эндоблиарное протезированием может использоваться при:
доброкачественных стриктурах желчных протоков (если возможно с предварительной балонной дилатацией)
холедохолитиазе, когда не удается добиться эндоскопического удаления камней желчных протоков.
Противопоказаниями к эндопротезированию являются :
- агональные и угрожающие жизни состояния (острый период инфаркта миокарда, ОНМК, пароксизмальные нарушения ритма, расслаивающаяся аневризма аорты, и т.д.)
- непереносимость контрастных препаратов.
Проблематичным выполнение эндопротезирования может быть в результате общих трудностей которые возникают при любых стандартных чреспапиллярных вмешательствах:
невозможность канюляции желчных протоков,
неадекватно выполненная ЭПСТ
крайняя степень стенозирования просвета желчного протока, когда невозможно провести инструменты выше области обструкции
Кроме того в условиях опухолевой билиарной обструкции возможны следующие проблемы:
невозможность провести эндоскопический инструментарий к области большого дуоденального сосочка за счет деформация, стенозирование просвета ДПК вследствии выраженного опухолевого процесса, либо после ранее выполненных операций
невозможность провести стент нужного диаметра из-за протяженности обструкции или при выраженной деформации просвета желчного протока в области обструкции
Осложнения эндобилиарного протезирования встречаются не более чем у 15% пациентов и могут коррелироваться малоинвазивными способами.
Непосредственно во время проведения вмешательства может возникнуть:
перфорация опухоли с развитием желчного перитонита
кровотечение из опухоли или области ЭПСТ
ретродуоденальная перфорация
В ближайшем послеоперационном периоде осложнения развиваются при неадекватном дренировании желчных протоков:
прогрессирование механической желтухи с развитием гнойного холангита
миграция стента в просвет ДПК, либо в холедох
В отдаленные сроки наиболее частыми осложнениями является
обтурация стента замазкообразными массами
прорастание опухолью с развитием механической желтухи
При чем, в последнее время, большинство специалистов не считают это осложнением, а рассматривают как естественное течение заболевания, требуюещее плановых промываний и замен стента.
ОБОРУДОВАНИЕ И ТЕХНИКА
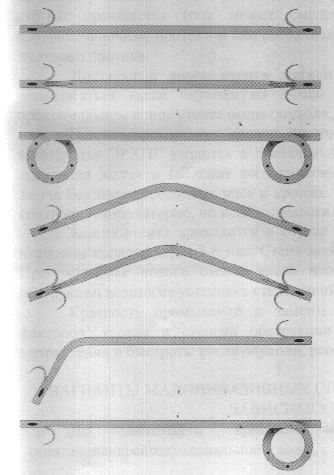
При выполнении эндобилиарного протезирования используются рентгеновский аппарат с графическим и скопическим режимами, ширококанальный дуоденоскоп и комплект для постановки стента, в который входят проводник и толкатель, В качестве проводника используется специальная металлическая струна диаметром 0,035 дюйма с гибким атравматичным кончиком. Современные струны из нитинола с полимерным и гидрофильным покрытием облегчают проведение вмешательства благодаря большей гибкости, кроме того они длительное время не деформируются. Пластиковые стенты имеют различный диаметр (1,2-4,0мм), длину (5-15мм), форму, число усиков-ограничителей и перфорационных отверстий. Наиболее распространены стенты фирм "OLYMPUS", Япония, "Wilson-Cook", США, "GIP" Германия.
После выполнения ЭРХГ и определения уровня и степени обструкции определяются показания к ЭПСТ, избирается вид стента, его длина и диаметр. Необходимость установки двух и более стентов может быть обусловлена высокой локализацией обструкции, с целью дренирования обоих долей печени, так и при неадекватном дренировании одним стентом наибольшего диаметра (имеющимся в наличии). В последнем случае желчеотток может улучшиться за счет дополнительного парадренажного подтекания желчи в ДПК.
Выше уровня обструкции проводится струна проводник, а затем копмлекс стент-толкатель.
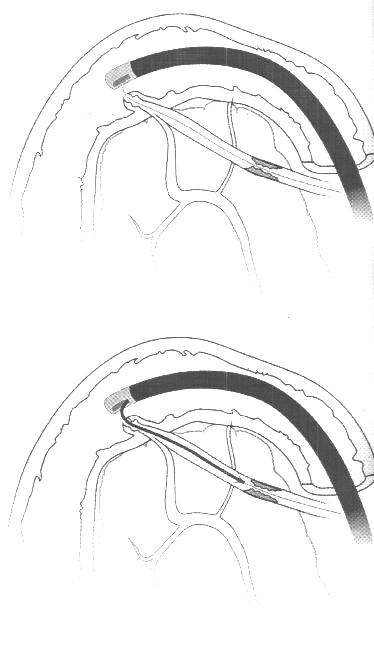
При проведении стента выше уровня обструкции необходимо последовательное сочетание поступательных движений стента при помощи "подъемника" дуоденоскопа и, так называемой "большой тяги". Не следует выдвигать стент из дистального конца биопсийного канала более чем на 2-2,5см, так как может произойти изгибание и деформация протеза, что затруднит его дальнейшее продвижение. При преодолении области обструкции бывает полезным сочетание поступательных движений с вращательными движениями эндоскопа, когда стент как бы ввинчивается в суженную часть протока. В процессе установки стента необходим постояннный рентгенологический контроль за расположением струны проводника (она может смещатся как ниже уровня обструкции,так и глубоко во внутрипеченочные протоки и там сворачиваться) и за соответствием траектории движения стента с осью желчного протока.
Дистальный конец стента должен выступать в ДПК не более 1-1,5см, а проксимальный располагаться выше опухоли на 2-3см, при этом усики органичители должны располагаться в проксимальном конце стента выше опухоли, а в кишке непосредственно вблизи устья холедоха.
Техника промывания желных протоков после установки стента достаточно проста: стандартный катетер для ЭРХПГ вводится в дистальный конец стента на всю его длину и проводится поочередно аспирация желчи и введение физиологического раствора в объеме 20-30 мл до поступления светлой желчи без замазкообразных масс и крошек. Эта манипуляция может проводится без ренгенологического контроля и амбулаторно, по необходимости раз в 1- 2мес.
Замена стента проводится в случае его полной обтурации замазкоообразными массами, либо в плановом порядке через 3-6 мес. Стент захватывается полипэктомической петлей и извлекается наружу. При установке нового стента вновь необходимо выполнение ЭРХГ и в случае распространения обструкции возможна установка стента иной формы и длины.
Кратность промываний и замены стента достаточно индивидуальны и зависят от многих факторов: уровня и степени обструкции, выраженности расширения протоков выше обструкции, направления и быстроты роста опухоли, реологических свойств желчи, длины и качества стента.
ВАРИАНТЫ МАЛОИНВАЗИВНЫХ СПОСОБОВ ДЕКОМПРЕССИИ БИЛИАРНОЙ СИСТЕМЫ В ЗАВИСИМОСТИ ОТ УРОВНЯ ОБСТРУКЦИИ.
До настоящего времени не существует единой классификации опухолей гепатикопанкреатодуоденальной зоны, которая позволила бы объективно подойти к выбору рационального метода декмопрессии желчных протоков. Предлагается классификация, основанная на определении уровня билиарной обструкции по данным холангиографии с обязательной оценкой фунционального состояния желчного пузыря (УЗИ, холангиография) и определения наличия дуоденальной обструкции.
I тип Опухоль БДС, ампулярного отдела холедоха или общего желчного протока
а) с функционирующим желчным пузырем без дуоденальной обструкции
б) с функционирующим желчным пузырем с дуоденальной обструкцией
с) с отключенным желчным пузырем
II тип Обструкция на уровне общего печеночного протока
III тип Обструкция на уровне слияния желчных протоков
а) с сохранением проходимости обоих долевых протоков
б) с сохранением проходимости одного долевого протока
с) с полной билатеральной обструкцией
При обструкции по типу Iа
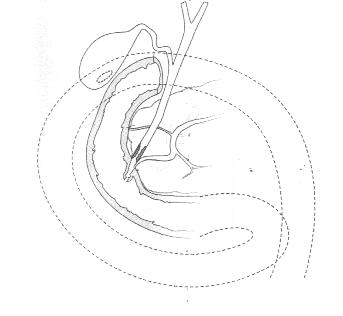
возможны два способа эндоскопической декомпрессии: транспапиллярный и лапароскопический. Выбор способа декомпрессии определяется на основании вышеизложенной лечебно-диагностической программы.
1. Эндоскопический способ заключается в проведении максимально возможной безопасной ЭПСТ с рассечением опухолевых тканей, затем устанавливается стент.
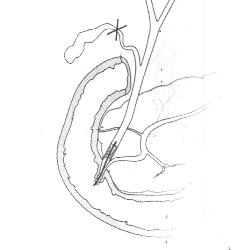 Выбор
длины стента основан на данных ЭРХГ, с
расчетом, что проксимальный конец стента
будет раполагаться на 2-3 см выше
проксимальной границы опухоли. В среднем
длина стента от 4 до 5см, с предпочительным
диаметром 12 френч. Если стенозирования
просвета желчного протока не слишком
выраженное для предотвращения миграции
стента в кишку возможен выбор стента
типа "свиной хвостик".
Выбор
длины стента основан на данных ЭРХГ, с
расчетом, что проксимальный конец стента
будет раполагаться на 2-3 см выше
проксимальной границы опухоли. В среднем
длина стента от 4 до 5см, с предпочительным
диаметром 12 френч. Если стенозирования
просвета желчного протока не слишком
выраженное для предотвращения миграции
стента в кишку возможен выбор стента
типа "свиной хвостик".
2.Лапароскопический
способ предпочтительней у больных с
предполагаемой продолжительностью
жизни свыше 6 месяцев (нет асцита,
канцероматоза, отдаленных метастазов,
кахексии). Срок 6 месяцев выбран с учетом
(в случае выбора транспапиллярного
протезирования ) вероятности более
одной замены стента в связи с его
обтурацией. Наиболее отработан метод
лапароскопического наложения
холецистоэнтероанастомоза.
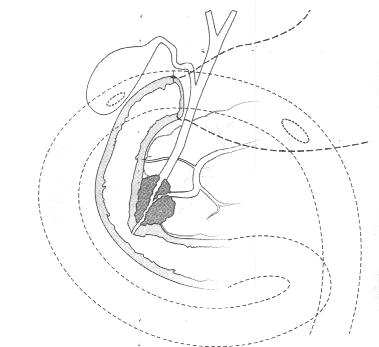
При обструкции по типу Iб лапароскопическим способом накладывается холецистоэнтероанастомоз и гастроэнтероанастомоз
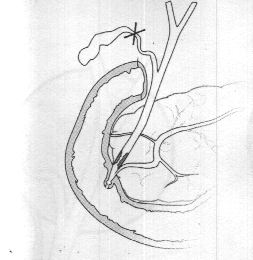
При обструкции по типу Iс:
выполняется билиодуоденальное протезирование РИСУНОК 8
При обструкции по типу II
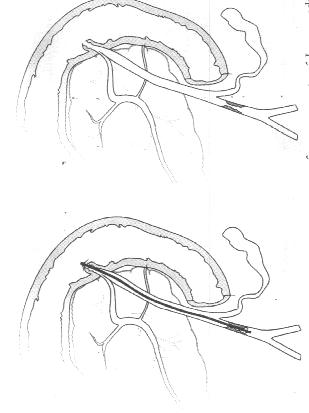
из эндоскопических способов возможно только билиодуоденальное протезирование, при этом проксимальный конец стента устанавливается до уровня слияния печеночных протоков, Длина стента обычно от 9 до 12см
При обструкции по III типу
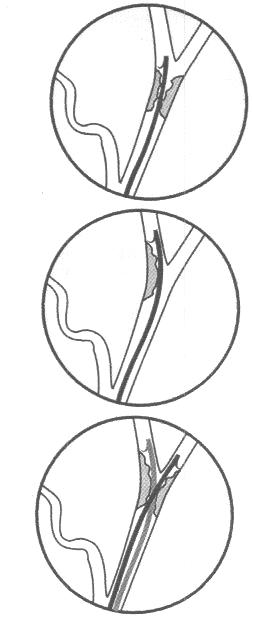
При обструкции по типу IIIа: используется метод билиодуоденального протезирования, при этом проксимальный конец стента устанавливается на уровне слияния протоков, либо в один из долевых протоков не более чем на 1-2см
При обструкции по типу III б: стент устанавливается выше обструкции в долевой проток, длина стента обычно более 12 см.
При обструкции по типу IIIс: установка двух стентов в правый и левый печеночные протоки, длина стентов более 12 см, обычно используются более тонкие стенты от 7 до 10 френч.
Когда эндоскопические способы невозможны из малоинвазивных вмешательств наиболее предпочтительными являются методы чрескожного чреспеченочного дренирования желчных протоков. При безуспешных попытках разрешить механическую желтуху малоинвазивным способом выполняются лапаротомные вмешательства, которые в будующем должны остаться лишь как метод резерва.
Таким образом в лечении больных с опухолевой обструкцией желчных путей следует выбрать следующую тактику: больные с высоким риском подвергаются срочному (в течение 24 часов) введению эндопротеза. Больные с умеренным риском холестаза (билирубин до 200мкмоль\л) и потенциально курабельным, после РКТ выполняется ЭРПХГ и лапароскопия для определения стадии процесса. При наличии нерезектабельных опухолей накладывается лапароскопический обходной анастомоз. Обходной анастомоз с желчным пузырем накладывается при отсутствии камней в желчном пузыре и уровне впадения пузырного протока на 2 см выше опухоли. При высокой вероятности обструкции опухолью 12-перстной кишки лапароскопически дополнительно формируют гастроэнтероанастомоз. Лапароскопическое вмешательство сочетает в себе минимальную инвазивность доступа и возможность создания широкого анастомоза, его следует выполнять у больных с низким операционным риском и прогнозом достаточно длинной жизни (свыше 6 мес). Введение эндопротеза следует выполнять у больных с прогнозируемой небольшой продолжительностью жизни (до 6 мес).
Проблема послеоперационных осложнений в абдоминальной хирургии
Ранние осложнения послеоперационного периода встречаются у 6-10% оперированных больных, а при операциях большого объема и травматичности достигает 30%. Лечение этих осложнений подчас является исключительно трудной задачей, а экономические затраты при этом огромны. Однако главное состоит в том, что при возникновении осложнений резко снижается качество оперативного лечения и нередко возникает опасность для жизни больного.
Послеоперационным осложнением следует считать патологическое состояние, нехарактерное для нормального течения послеоперационного периода и обусловленное:
невозможной или неадекватной, в силу различных причин, коррекцией глубоких метаболических расстройств, обусловленных основным заболеванием (ОЖКК из стрессовых язв, эвентрации);
острым нарушением функции жизненно важных систем организма (ОССН, ОППН, ОДН, тромбоэмболии) вследствие чрезмерной агрессии оперативного вмешательства (срыв реакции адаптации) или сопутствующей тяжелой патологии указанных систем;
плохим качеством технического исполнения оперативного вмешательства и анестезиологического пособия.
Характеристика и основные причины послеоперационных осложнений в хирургии органов брюшной полости.
Целесообразно выделить:
Осложнения со стороны органов и систем.
Острые расстройства гомеостаза, обусловленные нарушением водно-электролитного обмена, АРВС, эндокринной регуляции.
Абдоминальные осложнения.
Раневые осложнения.
Для послеоперационных осложнений в целом характерно:
Склонность к прогрессии.
Возможность рецидивирования (например, эвентрации рецидивируют в 12-20% случаев, послеоперационная ОКН – в 12-16% случаев (О.Б. Милонов и соавт., 1990)).
Развитие других послеоперационных осложнений.
Часто возникает необходимость в повторных оперативных вмешательствах (76% оперированных с развившимися абдоминальными и раневыми осложнениями в раннем послеоперационном периоде).
Факторы риска развития послеоперационных осложнений.
Объем и травматичность оперативного вмешательства:
малые объем и травматичность
могут быть выполнены в пределах часа;
не отличаются травматичностью оперативного доступа и оперативной техники;
частота п./о осложнений невелика – в пределах 1-2%.
операции среднего объема и травматичности
длительность 2-3 часа;
отработана классическая техника выполнения данных вмешательств;
частота п./о осложнений – после резекции желудка – 26,5%, после операций на желчных путях – 3,8-11,3%, после грыжесечений по поводу обширных грыж – 10-14,9%.
большого объема и травматичности
разнообразие оперативных приемов, сложность и непредсказуемость топографо-анатомической ситуации;
высокая частота п./о осложнений – 40-60%.
Наличие инфекции (H.C. Polk, 1978; и др.):
«чистые» - инфекционные осложнения у 1,5-2% больных;
«условно-чистые» – 4,4-10%;
«загрязненные» – 15-20%;
«грязные» – до 41,8%.
Длительность пребывания больного в стационаре до операции.
При нахождении в стационаре до операции в течение 1 дня осложнения возникают у 1,2% больных, при увеличении пребывания до 1 недели – у 2%, свыше 2 недель – у 3,4% (Cruse R., Food R, 1980 – 62 939 операций).
Характер шовного материла.
Запущенность хирургической патологии (до 30% больных).
Примитивный багаж накопленных знаний у хирурга.
Особенности фаз послеоперационного периода.
В течение «биологической реакции защиты» (реакции индивидуальной адаптации (Selye, 1950; Ф.З. Меерсон); системной постагрессивной реакции (СПАР) – Teodorescu‑Exarcu, 1974) в ответ на экзогенную (травма, оперативное вмешательство и т. д.) или эндогенную (перфорация полого органа, острый панкреатит, перитонит, холестатический эндотоксикоз и др.) агрессию можно выделить четыре фазы:
Фаза срочной адаптации (Ф.З. Меерсон) [адренергически-кортикоидная (Moore, 1953); фаза тревоги (Г. Селье, 1935); катаболическая; эрготропная реактивная (Thedering, Bowing); нейтрофильная защитная фаза (Schilling)] – 1-3-й день после средней травмы или операции при не осложненном послеоперационном периоде;
Фаза формирования долговременной (устойчивой) адаптации (Ф.З. Меерсон) [кортикоидная фаза обратного развития (Moore, 1953); моноцитарная переходная фаза (Schilling)] – 4‑6‑й день после средней травмы или операции без осложнений;
Фаза долговременной (устойчивой) адаптации (Ф.З. Меерсон) [фаза спонтанного анаболизма (Moore, 1953); трофотропная (Hoff); фаза нормализации (Thedering, Bowing); фаза выздоровления (Siedek)] – 7-10 день после средних оперативных вмешательств без осложнений;
Фаза накопления жира (Moore, 1953) – от нескольких недель до нескольких месяцев.
Продолжительность отдельных фаз определяется тяжестью операции, травмы или заболевания, развитием осложнений, возрастом и исходным состоянием реактивности больного.
В течении I-ой фазы адаптационной реакции можно выделить несколько последовательных стадий и видов неспецифической устойчивости (В.Д. Линденбратен, 1982):
Стадия компенсации – период, в течение, которого за счет напряжения функции систем утилизации и транспорта кислорода (сердечно-сосудистая, дыхательная, эритрон), буферных систем крови, органов детоксикации (печень, почки, макрофагальная система) и ряда других процессов обеспечивается сохранение гомеостаза (рО2, рСО2 крови, активная реакция внутренней среды, параметры гидроионного обмена и др.), несмотря на воздействие отклоняющих факторов (эндогенной интоксикации, например, при перитоните или панкреонекрозе; гипоксии, например, при кровопотере или травме груди и т.д.). Способность сохранять основные параметры внутренней среды организма на физиологическом уровне на фоне продолжающейся агрессии получила название приспособляемость – отрезок АВ на рис. 1. Продолжительность данной стадии – от начала действия раздражителя до начала изменения основных показателей гомеостаза.
Приспособляемость зависит главным образом от реактивности организма, от качества работы его регуляторных (нейроэндокринной) систем.
Далее, представим себе, например, больного с продолжающимся язвенным желудочно-кишечным кровотечением. Снижение кислородной емкости крови продолжается, и организм уже не в состоянии поддерживать достаточный уровень тканевой перфузии за счет перенапряжения функции сердечно-сосудистой и других компенсаторных систем. Гомеостаз нарушается. Развивается стадия собственно болезни.
Стадия собственно болезни – имеет два качественно различных периода:
приспособительные процессы работают (одышка, тахикардия достигают максимума). Однако ОЦК продолжает снижаться, уровень гемической гипоксии нарастает, и приспособительные процессы не выдерживают. Происходит срыв: дыхание урежается, содержание кислорода в крови катастрофически падает. Это второй период-
срыва приспособительных и появления патологических реакций. Способность организма препятствовать срыву приспособительных механизмов, несмотря на действие отклоняющих факторов, - второй вид устойчивости – устойчивость приспособительных механизмов (УПМ) – отрезок ВС на рис.1. Время его действия - от начала изменения гомеостаза до срыва приспособительных механизмов.
Приспособляемость + устойчивость приспособительных механизмов обеспечивают активное сопротивление организма возмущающим воздействиям, являясь составляющими резистентности.
Резистентность – это именно активная сопротивляемость, продолжительность которой от начала действия раздражителя до срыва адаптационных процессов.
Но и после срыва приспособительных механизмов жизнеспособность организма может еще сохраняться определенное время, которое определяется характером агрессии. Это свойство называется выносливостью (отрезок СD на рис. 1) и является третьим видом неспецифической устойчивости. Его срок – от начала срыва приспособительных процессов до гибели организма.
В отличие от резистентности это пассивная устойчивость. От чего она зависит сказать трудно. Тем не менее, оценивать выносливость крайне важно при тяжелом эндотоксикозе, шоке, в условиях наркоза и раннего послеоперационного периода.
Приспособляемость. УПМ и выносливость – это базовые виды устойчивости. Каждый из них препятствует переходу патологического процесса в следующую, более тяжелую стадию. Специальные исследования показали, что закономерных соотношений между этими видами устойчивости нет. При изменении одного из базовых видов остальные могут не изменяться или изменяться незначительно. Так высокая приспособляемость может сочетаться как с высокой, так и с низкой устойчивостью приспособительных механизмов; низкая резистентность может сочетаться как с большой, так и с малой выносливостью и т. д.
В се
вместе они объединяются понятием
выживаемость
– синоним неспецифической устойчивости
(В.Д. Линденбратен, 1981).
се
вместе они объединяются понятием
выживаемость
– синоним неспецифической устойчивости
(В.Д. Линденбратен, 1981).
Таким образом, исход первой фазы адаптационного процесса будет определяться состоянием (возможностями) неспецифической устойчивости организма, а задача лечебных и тактических мероприятий в различные периоды этой фазы (срочной адаптации) заключается в поисках способов повышения неспецифической устойчивости организма и, тем самым, обеспечении наступления фазы долговременной адаптации
Ранняя диагностика послеоперационных осложнений.
Важнейшим моментов в оценке тревожных симптомов в п/о периоде является их появление на фоне полноценной, адекватной терапии:
отсутствие перистальтики на 3 сутки п/о периода на фоне интенсивной стимуляции моторики кишечника;
гастростаз (упорная тошнота, рвота, икота) не разрешающийся к 3-4 суткам п/о периода;
стойкая тахикардия, не смотря на адекватную инфузионную терапию и отсутствие явной сердечной и дыхательной патологии;
стойкая сухость языка и другие проявления дегидратации на фоне достаточной инфузии к 3-4 суткам;
коллапс и падение показателей красной крови в 1-3 сутки после операции;
гектическая лихорадка с ознобом, потливостью на 4-е сутки и позже;
анемия и токсические изменения крови к концу I фазы послеоперационного периода.
Причины послеоперационных лихорадок.
ЛИХОРАДКА, НАЧИНАЮЩАЯСЯ ВО ВРЕМЯ ОПЕРАТИВНОГО ВМЕШАТЕЛЬСТВА
1. Трансфузионная реакция, обычно во время трансфузии крови или ее компонентов, проявляется внезапным повышением температуры, ознобом во время операции. Терапия:
А. Немедленное прекращение трансфузии крови или ее компонентов
Б. Гидратация введением физиологического раствора
В. Осмотические диуретики
2. Интраоперационная септицемия, обусловленная внезапным прорывом абсцесса в серозную полость
3. Злокачественная гипертермия (причина смерти у 1/20000 больных во время проведения анестезии.
ЛИХОРАДКА, ВОЗНИКАЮЩАЯ В ТЕЧЕНИЕ ПРЕВЫХ 24 ЧАСОВ ПОСЛЕ ОПЕРАЦИИ
Ателектаз (невысокая температура, тахикардия, тахипноэ, влажные хрипы, ослабление дыхания, бронхиальное дыхание). Лечение: стимуляция кашля и глубокого дыхания; лечебная бронхоскопия
Клостридиальная инфекция в ране, раневая инфекция, вызываемая стрептококками группы А, аспирация инородных тел, например, зубных протезов.
ЛИХОРАДКА, ВОЗНИКАЮЩАЯ ЧЕРЕЗ 1-3 СУТОК ПОСЛЕ ОПЕРАЦИИ
Сепсис, обусловленный внутривенной катетеризацией (хирургическая лихорадка 3 дня) – удалить катетер, антибиотики в/в.
ЛИХОРАДКА ПОСЛЕ 3 ПОСЛЕОПЕРАЦИОННОГОДНЯ
Легкие
Мочевыводящие пути
Тромбофлебит
Операционная рана, внутрибрюшные и внутригрудные нагноения.
Госпитальная инфекция.
Назокомиальная (госпитальная) инфекция встречается в 5-10% случаев и имеет следующую структуру:
пневмония (чаще 2-4 день после операции) - 79% всех осложнений;
абдоминальная и уроинфекция - 15-20%;
раневая (чаще клинически проявляется на 4-6 день после операции) - 13%;
ангиогенная (наиболее часто вследствие катетеризации подключичной вены).
Особенно многочисленны инфекционные осложнения после абдоминальных операций (в среднем - 6%). Так развитие инфекции в ране после операций на желчевыводящих путях развиваются ~ у 9,3% больных, после операций на поджелудочной железе - у 16%, на толстой кишке ~ у 23,5% оперированных. Тенденции к снижению количества случаев госпитальной инфекции в хирургической клинике не отмечается.
Этиологическая структура: из более чем 400 видов бактерий, обитающих в организме человека, лишь около 15 играют существенную роль в этиологии нозокомиальных инфекционных осложнений (грамотрицательные кишечные бактерии, синегнойная палочка, стафилококки, энтерококки, некоторые анаэробы),
Источники - экзогенные (инвазивные лечебные мероприятия, воздух и т.д.) и эндогенные - нарушение колонизационной резистентности кишечной микрофлоры -> транслокация кишечных бактерий через кишечную стенку в портальную кровь.
В общей структуре летальности в хирургических стационарах около 42% смертельных исходов, так или иначе, связано с инфекцией [Шалимов С.А. и соавт., 1985; Girhake F., SchwickH., 1971].
В последние годы наблюдается увеличение частоты выделения условно-патогенных микроорганизмов, характеризующихся природной или приобретенной устойчивостью к большинству антибактериальных препаратов (так называемые "проблемные микроорганизмы").
Анализ данных о влиянии микробного фактора на тяжесть и исход гнойно-септических осложнений (ГСО) у больных, перенесших критические состояния, позволил выделить наиболее неблагоприятные в прогностическом отношении критерии:
— выделение культур "проблемных микроорганизмов" (Pseudomonasaei-uginosa, Proteus spp., Enterobacter spp.);
— полимикробный рост бактерий;
— наличие бактериемии, бактериурии;
— обсемененность раны микроорганизмам 107 — 109 колониеобразующих единиц на 1 г. ткани».
Антибиотики используют в максимально допустимых общепринятых дозах.
На первом этапе, в период 1 — 6 сут, на оправдано назначение полусинтетических пенициллинов (ампиокс, карбенициллин) или цефалоспоринов первой генерации (цефазолин, цефалексин в комбинации с метронидазолом и диоксидином. Такое решение обусловлено преобладанием в 3 период грамположительных аэробов, возможно в ассоциации с анаэробами. Практически у всех пациентов в этот период имела место циркуляторная гипоксия, что делало назначение аминогликозидов эффективным.
На следующем этапе (7 — 14-е сутки) рекомендовано назначение цефалоспоринов третьей генерации (цефотаксим, цефтриаксон, цефтазидим, цефоперазон). Предпочтение этим препаратам отдавали из-за широкого спектра антимикробного действия, высокой эффективности низкой нефротоксичности, относительной индифферентности к иммунной системе, что особенно важно на данном этапе лечения.
В последнем периоде — 15 — 21 -е сутки — целесообразно назначение антибиотиков, оказывающих стимулирующее влияние на ОФСИ, что обеспечивает лучшее поступление антибактериального агента в очаг воспаления. Применяли клиндамицин, линкомицин, эритромицин, рифампицин в виде монотерапии или в комбинации с современными аминогликозидами в зависимости от чувствительности возбудителя и локализации гнойного очага. Такие препараты, как полимиксин, левомицетин, полусинтетические тетрациклины, были практически полностью исключены из применения на основании того, что они угнетают ОФСИ.
В ряде наиболее тяжелых случаев хороший эффект был получен при использовании комбинированной антибактериальной терапии, которая позволяет повысить активность воздействия на микробные агенты и эффективность лечения при смешанных инфекциях, уменьшить вероятность развития резистентности возбудителей к антибиотикам, предупредить развитие суперинфекции, снизить дозу препаратов и их токсическое влияние.
При обнаружении у пациентов грибов рода Candida добавляли к терапии противогрибковые препараты (амфотерицин В, флюконазол, 5-флюорацитозин).
Следует указать, на необходимость назначения средств, восстанавливающих нормальный биосинтез в кишечнике (колибактерин, бификол, бактисубтил), учитывая частое наличие дисбактериоза у больных с ГСО.
КОМБИНАЦИИ
АНТИБАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ
1.
Цефалоспорины первой
- второй
генерации+аминогликозиды
2.
Рифампицин
+ фторхинолоны
3.
Цефалоспорины первой
— второй
генерации+фторхинолоны
1.
Цефалоспорины второй —третьей
генераиии+аминогликозиды
2.
Уреилопенициллины
+
аминогликоэиды
3.
Цефалоспорины второй
— третьей
генерации+фторхинолоны
4.
Фторхинолоны
+
аминогликозиды
5.Уреидопенициллины+фторхинолоны
Клиндамицин
+
аминогликозиды
Staphylococcus
spp.
Семейство
Enterobacteriaceae
Смешанные
инфекции (включая анаэробы)
Тромбоэмболия легочных артерий (тэла)
- по праву считается одним из тяжелейших и катастрофически протекающих острых сосудистых заболеваний, сопровождающихся высокой летальностью. С легочной эмболией неизбежно сталкиваются представители как хирургических, так и терапевтических специальностей, поскольку она может возникнуть в самых различных клинических ситуациях. По данным Американской медицинской ассоциации, ежегодно в Соединенных Штатах отмечается до 650 тыс. случаев ТЭЛА, 35/6 из которых заканчиваются смертью больного. Вместе с тем даже массивное эмболическое поражение легочных артерий прижизненно не диагностируется у 40-70% пациентов. Видимо, с этим связаны врачебные мифы, существование которых в паши дни не поддается рациональному объяснению. До сих пор бытует отношение к ТЭЛА как к фатальной неизбежности, предотвратить которую не представляется возможным. Полагают также, что она в большинстве случаев заканчивается молниеносной смертью больного. Подобное отношение ставит врача в позицию стороннего наблюдателя, от которого мало что зависит. Вместе с тем опыт, которым располагают авторы (обследование и лечение более 3000 больных с ТЭЛА, 580 из которых проведена тромболитическая терапия, 80 -эмболэктомия из легочных артерий), позволяет утверждать, что в настоящее время существуют реальные возможности предотвращения и лечения этого распространенного и опасного заболевания.
Этиология и патогенез
У подавляющего числа больных (более 90%) источником ТЭЛА является тромбоз в системе нижней полой вены (HIIB). Чаще всего он локализуется в глубоких венах нижних конечностей и магистральных венах таза. При бластоматозпом поражении почек возможен тромбоз почечных вен, распространяющийся на НПВ. Встречается и тромботическое поражение печеночных вен. Иногда к тромбоэмболии может приводить тромбоз правого предсердия, который развивается на фоне мерцательной аритмии и дилатационпой кардиомиопатии. Эмболизация легочного сосудистого русла возможна также при эндокардите трехстворчатого клапана и эн-докардиальной электрокардиостимуляции, осложненной тромбозом правых отделов сердца. Крайне редко легочной эмболией осложняется тромбоз в бассейне верхней полой вены. Наибольшему риску развития венозного тромбоза и, соответственно, ТЭЛА подвержены больные с онкологическими заболеваниями, травматическими повреждениями, недостаточностью кровообращения, ожирением, вынужденные по различным причинам длительно соблюдать постельный режим. ТЭЛА является настоящим "бичом" послеоперационного и послеродового периодов, становясь доминирующей причиной смерти, особенно заметной па фоне снижения общей летальности, зависящей от инфекционных и других осложнений.
Какой тромбоз чаще осложняется эмболией? Обычно ТЭЛА возникает при флотирующих (плавающих) тромбах, которые свободно располагаются в просвете сосуда и имеют единственную точку фиксации в дистальном своем отделе. Потоком крови такой тромб легко может быть смыт и принесен в малый круг кровообращения. Окклюзивное тромботическое поражение, при котором тромбы плотно спаяны со стенкой вены на значительном протяжении, не сопровождается развитием эмболии. Принципиально, тромбоз любой локализации может обусловить тромбоэмболию, между тем источником массивной ТЭЛА, под которой понимают эмболическое поражение легочного ствола и/или главных легочных артерий, в 65% случаев является тромбоз илио-кавального сегмента, в 35% - подколенно-бедренного.
Рис. 1. Патогенез легочной тромбоэмболии. Тромбоз в системе НПВ приводит к эмболизации сосудистого русла легких. В зависимости от калибра эмболизированного сосуда возможно развитие трех синдромов.
А - тромбоэмболия крупных ветвей легочной артерии. Возможно развитие внезапной смерти или острого легочного сердца. Острое легочное сердце проявляется: внезапной одышкой, цианозом, правожелудочковой недостаточностью, артериальной гипотонией. В тяжелых случаях шоком и остановкой кровообращения.
Б - Тромбоэмболия долевых и сегментарных артерий может привести к развитию инфаркта легкого. Синдром инфаркта легкого включает: плевральные боли, одышку, редко кровохарканье. Чаще инфаркт легкого наблюдается при левожелудочковой недостаточности из-за низкого коллатерального кровотока по бронхиальным артериям.
В - Множественная тромбоэмболия мелких ветвей легочной артерии, чаще рецидивирующая, может привести к развитию хронической легочной гипертензии, морфологическим субстратом которой является тромботическая артериопатия мелких ветвей легочной артерии. Синдром хронической легочной гипертензии проявляется: одышкой, набуханием шейных вен, гепатомегалией, асцитом, отеком ног.
Появление признаков острой сердечно-легочной недостаточности или инфарктной пневмонии у пациентов с тромботическим поражением глубоких вен нижних конечностей любой врач, не задумываясь, свяжет с ТЭЛА Проблема в том, что в половине случаев в момент развития эмболии венозный тромбоз протекает бессимптомно. Кроме того, симптоматика, похожая на ТЭЛА, может объясняться наличием других заболеваний. Вот почему необходимо применение инструментальных методов исследования. Наиболее доступными и широко распространенными из них являются электрокардиография и обзорная рентгенография грудной клетки.
Электрокардиография в большинстве случаев помогает заподозрить массивную ТЭЛА Возникновение признаков острого легочного сердца: синдром Me Ginn-White (S1Q3 T3), смещение переходной зоны (глубокий SV5-6 в сочетании с отрицательными TV1-4) обусловлено повышением уровня давления в малом круге кровообращения свыше 50,0 мм рт. ст. Трудности трактовки ЭКГ-изменений возникают у пациентов пожилого возраста с органическими поражениями коронарных артерий. Порой даже опытные кардиологи остро возникшие ЭКГ-симптомы, обусловленные ТЭЛА, связывают с проявлениями инфаркта задней стенки левого желудочка. Вместе с тем отсутствие ЭКГ-проявлений не исключает наличие ТЭЛА.
Рис. 2. ЭКГ при ТЭЛА. Синдром Mc Ginn-White: S1Q3T3
Обзорная рентгенография грудной клетки позволяет исключить другую, нежели эмболия, патологию легких, сходную с ней по симптоматике. Дилатация правых отделов сердца с расширением путей венозного притока, высокое стояние диафрагмы на стороне окклюзии и обеднение легочного сосудистого рисунка указывают на массивный характер эмболического поражения. К сожалению, почти у трети больных рентгенографические признаки эмболии вообще отсутствуют. "Классическая" треугольная тень легочного инфаркта выявляется крайне редко (менее 2%), гораздо чаще она обладает большим полиморфизмом. Более информативны ультразвуковые и радионуклидные методы исследования. Эхокардиография позволяет обнаружить возникновение острого легочного сердца, исключить патологию клапанного аппарата и миокарда левого желудочка. С ее помощью можно определить выраженность гипертензии малого круга кровообращения, оценить структурное и функциональное состояние правого желудочка, обнаружить тромбоэмболы в полостях сердца и в главных легочных артериях, визуализировать открытое овальное окно, которое может влиять на выраженность гемодинамических расстройств и являться причиной парадоксальной эмболии. Вместе с тем отрицательный результат эхокардиографии ни в коей мере не исключает диагноза легочной эмболии. Ультразвуковое ангиосканирование вен нижних конечностей дает возможность обнаружить источник эмболизации. При этом удается получить исчерпывающую информацию о локализации, протяженности и характере тромботической окклюзии, наличии или отсутствии угрозы повторной эмболии. Трудности возникают при визуализации илиокавального сегмента, которой может препятствовать кишечный газ. Перфузионное сканирование легких, выполняемое после внутривенного введения макросфер альбумина, меченных 997с, признается наиболее адекватным методом скрининга ТЭЛА. При стабильном состоянии пациента именно этот метод должен "идти впереди" остальных инструментальных исследований. Отсутствие нарушений легочного кровотока на сцинтиграммах, выполненных как минимум в двух проекциях (передней и задней) полностью исключает диагноз тромбоэмболии.
Лечение Целью лечения больного с ТЭЛА является предотвращение гибели пациента в острой стадии заболевания и развития хронического легочного сердца в отдаленном периоде. В задачи лечения входят: 1) нормализация гемодинамики; 2) восстановление проходимости легочных артерий; 3) предотвращение рецидива заболевания.
ДИАГНОСТИКА, ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ В РАННЕМ ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ4
Степени риска послеоперационных венозных тромбоэмболических осложнений
(по C.Samama и M.Samama, 1999, в модификации)
Риск |
Факторы риска, связанные с: |
|
|
операцией |
состоянием больного |
Низкий (IА) |
I. Неосложненные вмешательства продолжительностью до 45 мин (например, аппендэктомия, грыжесечение, роды, аборт, трансуретральная аденомэктомия и др.) |
A. Отсутствуют |
Умеренный (IВ, IС, IIА, IIВ) |
II. Большие вмешательства (например, холецистэктомия, резекция желудка или кишечника, осложненная аппендэктомия, кесарево сечение, ампутация матки, артериальная реконструкция, чреспузырная аденомэктомия, остеосинтез костей голени и др.) |
B. Возраст старше 40 лет Варикозные вены Прием эстрогенов Недостаточность кровообращения Постельный режим более 4 дней Инфекция Ожирение Послеродовый период (6 нед) |
Высокий (IIС, IIIА, IIIВ, IIIС) |
III. Расширенные вмешательства (например, гастрэктомия, панкреатэктомия, колэктомия, экстирпация матки, остеосинтез бедра, ампутация бедра, протезирование суставов и др.) |
C. Онкологические заболевания ТГВ и ТЭЛА в анамнезе Паралич нижних конечностей Тромбофилии |
Частота венозных тромбоэмболических осложнений у различных групп больных (по E.Salzman и J.Hirsh, 1982)
Степень риска |
Частота осложнений (по данным объективных тестов) |
||
|
Тромбоз вен голени |
Тромбоз проксимальных вен* |
Смертельная легочная эмболия |
Высокая |
40-80% |
10-30% |
1-5% |
Умеренная |
10-40% |
2-10% |
0,1-0,7% |
Низкая |
<10% |
<1% |
<0,01% |
* Илиокавальный и подколеннобедренный сегменты |
|||
Способы профилактики венозных тромбоэмболитических осложнений
Степень риска |
Способ профилактики |
Низкая |
|
Умеренная |
|
Высокая |
|
Особые случаи |
|
Опасность развития венозных тромбоэмболических осложнений может сохраняться после выписки больного из стационара при неустраненных предрасполагающих факторах. Послеоперационный ТГВ при онкозаболеваниях встречается у 66-67% пациентов, что более чем в 2 раза превышает аналогичный показатель в общей хирургии [10-13]. Высокий риск развития ТГВ характерен для больных урологического профиля. У пациентов, оперированных по поводу доброкачественной гиперплазии предстательной железы (ДГПЖ) и злокачественных новообразований мочеполовых органов, ТГВ регистрируется в 40-45% случаев. У 20% больных ДГПЖ в отдаленном послеоперационном периоде наблюдается хроническая венозная недостаточность нижних конечностей, связанная с перенесенным ТГВ.
Общая частота тромбоэмболических осложнений после гинекологических вмешательств такая же, как и в общей хирургии. ТЭЛА является ведущей причиной летальности после гинекологических операций по поводу рака.
ТГВ при беременности возникает в 5-6 раз чаще, чем у небеременных женщин аналогичного возраста, и его частота составляет 0,13-0,5 на 1000 беременных до родов и 0,61-1,5 на 1000, пациенток в послеродовом периоде. В послеродовом периоде венозные тромбоэмболические осложнения возникают еще чаще, особенно при оператив ном родоразрешении, когда их частота возрастает в 10-15 раз. ТЭЛА является наиболее частой причиной материнской смертности. Имеется повышенная опасность ТГВ у женщин, принимающих гормональные препараты, содержащие 50 мкг и более эстрогенов. Оральные контрацептивы с низкими дозами эстрогенов увеличивают опасность развития ТГВ на фоне тромбофилических состояний (например, лейденовской мутации фактора V). Врожденная предрасположенность к тромбозам (тромбофилия) является достаточно редким состоянием, но должна приниматься во внимание у больных, имевших тромботический эпизод в отсутствие провоцирующих факторов в возрасте до 40 лет, повторный ТГВ и соответствующий семейный анамнез. Частота врожденной тромбофилии у больных с ТГВ составляет приблизительно 8%. Кроме того, предрасположенность к ТГВ имеется при ряде приобретенных гематологических нарушений, таких как антифосфолипидный синдром и миелопролиферативные заболевания. Больные с тромбофилией имеют высокий риск ТГВ и ТЭЛА. Они должны получать надлежащую профилактику в соответствии с клинической ситуацией. В ряде случаев послеоперационные венозные тромбоэмболические осложнения непосредственно связаны с развитием ДВС-синдрома. Его профилактика требует проведения адекватной трансфузионной терапии в период хирургического вмешательства, а также выполнения лабораторных коагулологических тестов с целью раннего выявления и своевременного эффективного лечения.
Категории риска Известные клинические факторы позволяют классифицировать больных (табл. в начале) с выделением групп высокого, умеренного и низкого риска развития венозных тромбоэмболических осложнений. Степень риска тесно коррелирует с частотой развития венозного тромбоза и легочной эмболии. Подходы к профилактике Для предотвращения послеоперационного венозного тромбоза предложены различные физические (механические) и фармакологические средства. К первой группе относят разные способы ускорения венозного кровотока, что препятствует одному из важнейших факторов в генезе тромбообразования: застою крови в венах нижних конечностей. Венозный застой предотвращают ранняя активизация пациентов в послеоперационном периоде, эластическая компрессия нижних конечностей (предпочтительнее использование с этой целью специальных эластических гольфов и чулок, обеспечивающих максимальное давление на уровне лодыжек с постепенным его снижением в проксимальном направлении); прерывистая пневмокомпрессия ног с помощью специальных компрессора и манжет, разделенных на несколько камер, в которые попеременно подается воздух; “ножная педаль”, позволяющая добиваться пассивного сокращения икроножных мышц.
В числе общих мер, которые также могут сыграть профилактическую роль, следует упомянуть: обеспечение адекватной гидратации, использование нормоволемической гемодилюции (оптимальная величина Ht перед началом вмешательства - 27-29%), применение максимально щадящей техники оперативного вмешательства, лечение дыхательной и циркуляторной недостаточности.
Фармакологические средства, используемые с целью профилактики ТГВ, представлены:
- низкомолекулярными декстранами (реополиглюкин, реомакродекс);
- дезагрегантами (в основном аспирин); - обычным нефракционированным гепарином (НФГ);
- низкомолекулярными гепаринами (НМГ): эноксапарин, надропарин и др.; - непрямыми антикоагулянтами (варфарин и др.).
Определенное значение имеет метод анестезиологического пособия. Имея в виду послеоперационные тромбоэмболические осложнения, предпочтительнее использование регионарной (спинальной или эпидуральной) интраоперационной анестезии. Так, у пациентов с остеосинтезом бедра ее применение в 4 раза снижает опасность развития ТГВ по сравнению с интубационным эндотрахеальным наркозом с миорелаксантами. Эффективность указанных способов профилактики различна. Поэтому в клинических условиях должны быть рекомендованы такие мероприятия, действенность и безопасность которых доказаны. С другой стороны, способы профилактики следует выбирать, сообразуясь со степенью риска послеоперационных венозных тромбоэмболических осложнений (табл. 5). Кроме того, использование различных мер должно быть экономически оправдано. Больным с низким риском следует назначать малозатратные профилактические меры. Сокращение длительности постельного режима после различных хирургических вмешательств - один из действенных способов предотвращения венозного застоя. С этих позиций анестезиологическое обеспечение операций и характер самого вмешательства должны предусматривать возможность активизации пациента уже спустя несколько часов после его завершения. Необходимо шире использовать возможности амбулаторного выполнения многих операций в условиях хирургического стационара “одного дня”. У этой категории пациентов может быть целесообразно применение эластической компрессии нижних конечностей. У всех больных с умеренным риском необходимо профилактическое применение прямых антикоагулянтов. Традиционным является подкожное введение низких доз (5000 ЕД 2-3 раза в день) обычного НФГ. Между тем НФГ обладает рядом существенных недостатков: низкая биодоступность (не превышает 29% при подкожном введении), малопредсказуемый антикоагулянтный эффект, гепарининдуцированная тромбоцитопения. Гепарины, произведенные различными заводами, очень сильно различаются по своим фармакокинетическим параметрам, поэтому эффект от применения того или иного гепарина часто бывает непредсказуем. Кроме того, для достижения оптимального действия нефракционированного гепарина необходима внутривенная инфузия препарата с подбором доз под контролем активированное частичное тромбопластиновое время (АЧТВ), что значительно усложняет лечение и увеличивает его стоимость, снижает качество жизни пациента. В настоящее время в международной клинической практике предпочтение отдается НМГ, так как многочисленные исследования показали, что они оказывают хороший профилактический эффект, применять их удобнее, а число геморрагических осложнений ниже. При умеренном риске широко используют малые дозы НМГ: 20 мг (0,2 мл) эноксапарин натрия 1 раз в сутки под кожу живота, либо 2500 ME дальтепарин натрия 1 раз в сутки, либо 0,3 мл надропарин кальция 1 раз в сутки. Введение НМГ начинают до операции и продолжают в течение 7-10 дней до полной мобилизации больного. Ингибирующая активность в отношении Ха-фактора энокспарина продолжается в течение 24 ч после однократной инъекции, у дальтепарина и надропарина - 17 ч. Альтернативной рекомендацией у больных умеренного риска может быть перемежающаяся пневматическая компрессия, которую нужно начинать на операционном столе и продолжать постоянно до исчезновения необходимости постельного режима. В настоящее время появляется все больше доказательств того, что сочетание фармакологической профилактики и эластической компрессии еще больше снижает частоту венозного тромбоза у больных в этой группе риска. Эта комбинация особенно целесообразна у пациентов с варикозным расширением вен нижних конечностей . Всем больным с высоким риском в обязательном порядке должна проводиться профилактика. При этом дозировку7 антикоагулянтов следует увеличить. Рекомендуемые дозы НФГ - не менее 5000 ED 3 раза в сутки или дозы, подобранные под контролем АЧТВ, причем этот показатель должен повышаться в 1,5-2 раза. Бесконтрольное увеличение доз НФГ существенно увеличивает частоту геморрагических осложнений. Дозы НМГ также требуют увеличения. Эноксапарин вводят по 40 мг (0,4 мл) 1 раз в сутки, надропарин - 0,3 мл первые 3 дня, затем по 0,6 мл в сутки (при массе тела пациента более 70 кг), дальтепарин по 5000 ME 2 раза в сутки под кожу живота. При этом контроля АЧТВ не требуется. Профилактическое назначение антикоагулянтов у этой категории больных следует сочетать с механическими мерами ускорения венозного кровотока в нижних конечностях (например, перемежающейся пневмокомпрессией). Профилактику следует начинать до операции во всех группах риска, так как примерно в половине случаев ТГВ начинает формироваться уже на операционном столе. Первая доза НФГ должна быть введена за 2 ч до начала хирургического вмешательства. НМГ больным из группы умеренного риска также вводят за 2 ч до операции. При высоком риске развития тромбоза (например, у ортопедических больных) НМГ в более высокой дозе вводят за 12 ч до операции. В ургентной хирургии, а также в случаях опасности значительного интраоперационного кровотечения, гепаринотерапия может быть начата после завершения хирургического вмешательства, но не позже чем через 12 ч. В этом случае необходимо применять более высокие дозы НМГ. Во время операции в таких случаях целесообразно использование средств ускорения венозного кровотока. Применяются также низкомолекулярные декстраны, однако убедительных литературных данных, подтверждающих их эффективность для профилактики послеоперационных тромбозов, не имеется. Сочетание спинальной или эпидуральной анестезии с профилактическим назначением НМГ является, видимо, одним из наиболее эффективных способов предотвращения послеоперационных тромбоэмболических осложнений. Вместе с тем оно несет в себе определенную опасность развития спинальной гематомы. Вот почему в таких случаях необходимо соблюдать определенные правила: 1) спинальная пункция возможна только через 10-12 ч после начальной профилактической дозы НМГ; 2) необходимо удалить, если возможно, спинальный катетер перед началом введения антикоагулянтов; 3) если катетер остается на месте, его удаляют через 10-12 ч после последней дозы НМГ и за 2 ч до следующей; 4) следует отложить применение антикоагулянтов при травматичной спинальной/эпидуральной пункции; 5) необходимо соблюдать осторожность при применении нестероидных противовоспалительных средств на фоне использования НМГ и регионарной анестезии (рекомендации FDA США). Профилактически антикоагулянты после операции следует назначать в течение не менее 7-10 дней, их введение необходимо вплоть до полной мобилизации пациента. В ряде случаев (после остеосинтеза и ортопедических вмешательств), по данным литературы, риск развития тромбозов сохраняется до 35 дней. Следует обсудить вопрос о продлении профилактики в тех случаях, когда госпитализация удлиняется или сохраняется риск развития тромбоэмболических осложнений после выписки пациента из стационара. Профилактическое введение НФГ и НМГ отменяют без назначения непрямых антикоагулянтов.
Необходимость длительной (в течение нескольких месяцев) фармакологической профилактики может потребовать использования непрямых антикоагулянтов (варфарин, синкумар или фениллин). Их применение в ближайшем послеоперационном периоде не оправдано из-за недостаточной эффективности фиксированных малых доз и высокой частоты геморрагических осложнений при лечебной дозировке (MHO* - 2,0-2,5). В то же время подобный режим антикоагулянтной профилактики вполне осуществим в отдаленном послеоперационном периоде. Вопросы оптимальной продолжительности профилактического назначения антикоагулянтов при различных операциях (особенно после протезирования суставов, остеосинтеза и проведения послеоперационной химиотерапии при онкологических заболеваниях) требуют дальнейшего изучения, хотя зарубежными исследователями уже доказана клиническая эффективность продолжительного применения (до 30-35 дней) эноксапарина при артропластике тазобедренного сустава. Использование малых доз аспирина в качестве дезагреганта является эффективной мерой предотвращения артериального ретромбоза. В отношении ТГВ профилактический эффект его также зарегистрирован, однако он существенно уступает таковому при использовании антикоагулянтов и даже - эластической компрессии. В настоящее время проводят исследования новых классов антикоагулянтов: пентасахарида (который непосредственно связывается с AT1II), синтетических аналогов гирудина и других прямых ингибиторов тромбина (в том числе и препаратов энтерального приема). Их профилактическая эффективность и безопасность пока недостаточно изучены. Больные с высоким риском кровотечений как вследствие нарушений свертывания крови, так и из-за специфических хирургических процедур должны получать механические методы профилактики.
Экономические аспекты профилактики При разработке стратегии профилактики ТГВ и ТЭЛА важно учитывать экономические аспекты. При выборе различных способов профилактики должны обсуждаться их экономические преимущества. У больных умеренного и высокого риска стоимость диагностического скрининга ТГВ с использованием специальных инструментальных методов (исследование с меченым фибриногеном, компрессионное дуплексное сканирование или флебография) и последующего лечения уже развившихся тромбоэмболических осложнений настолько высока, что рекомендуемые в настоящем документе методы первичной профилактики являются экономически оправданными с позиций минимизации расходов на лечение. Экономическая эффективность рекомендуемых в настоящее время профилактических методов у больных низкого риска пока не доказана. Для получения доказательств необходимо накопление базы данных.
Лечение осложнений
ТГВ, развившийся в послеоперационном периоде в отсутствие профилактики либо несмотря на ее проведение, угрожает жизни пациентов массивной ТЭЛА. Эта опасность реальна при тромбах флотирующего характера в подколеннобедренном и в еще большей степени илиокавальном сегментах (так называемый эмболоопасный тромбоз). С другой стороны, протяженное поражение венозных магистралей в значительном проценте случаев чревато формированием тяжелой посттромбофлебитической болезни. Аналогичная ситуация складывается при необходимости проведения общехирургического вмешательства на фоне острого ТГВ. Поэтому при возникновении клинических признаков ТГВ следует применить объективные "диагностические методы: ультразвуковое ангиосканирование и/или флебографию.
Подтверждение диагноза ТГВ диктует необходимость принятия эффективных мер для: 1) прекращения прогрессирования тромбоза и его нарастания в проксимальном направлении, 2) профилактики ТЭЛА. Первая задача решается путем назначения лечебных доз антикоагулянтов. Их использование начинают с болюсного внутривенного введения НФГ (5000 ЕД) с последующим подбором дозы по данным лабораторных анализов (АЧТВ). Важно, чтобы терапевтический уровень достигался в пределах первых 24 ч. АЧТВ должно быть увеличено, по крайней мере, в 1.5-2,5 раза по сравнению с нормой. Оптимально использование подкожного введения НМГ в подобранной по массе тела пациента дозе. Лечение непрямыми антикоагулянтами целесообразно начинать через 5-7 дней гепаринотерапии. В обычных условиях лечение гепарином должно быть прекращено, когда MHO больного находится в пределах терапевтических границ (т.е. от 2 до 3), по крайней мере, 2 дня. Лечение оральными антикоагулянтами должно продолжаться не менее 3 мес с контролем MHO каждые 1014 дней у больных с первым эпизодом венозного тромбоза и отсутствием сохраняющихся факторов риска. Больных с повторным эпизодом венозного тромбоза надо лечить гепарином в том же терапевтическом режиме, как и больных с первым эпизодом ТГВ. однако оптимальная продолжительность лечения оральными антикоагулянтами должна быть не менее 6 мес. Подобранные дозы гепарина следует использовать в качестве лечения при особых клинических состояниях, таких как тромбоз, развившийся во время беременности, когда лечение оральными антикоагулянтами противопоказано. Женщины, у которых во время беременности развилась тромбоэмболия, должны получать терапевтические дозы гепарина (применение НМГ представляется предпочтительным). Гепаринотерапия должна продолжаться в течение всей беременности, независимо от того, находится пациентка в стационаре или дома. Преимуществом НМГ является возможность их амбулаторного применения. Антикоагулянтную терапию обычно продлевают, по крайней мере, на 4-6 нед после родов, хотя оптимальная длительность этого лечения еще не установлена. НМГ во время беременности следует назначать после тщательного взвешивания соотношения риск/польза.
Проведение тромболитической терапии ТГВ практически невозможно из-за крайне высокой опасности геморрагических осложнений в ближайшем послеоперационном периоде. Подобный риск может быть оправдан лишь в случаях угрожающей жизни больного массивной ТЭЛА. В специализированных ангиохирургических отделениях может быть выполнена тромбэктомия в случаях сегментарного тромбоза бедренных, подвздошных и нижней полой вен. Радикальный характер вмешательства на магистральных венах может устранить опасность массивной ТЭЛА и улучшить отдаленный прогноз венозного тромбоза. Вместе с тем тяжесть состояния больных, обусловленная характером и объемом первичного хирургического вмешательства и сопутствующими заболеваниями, позволяет прибегать к этой процедуре в весьма ограниченном числе случаев. Вот почему возникновение флотирующих тромбов в бедренных, подвздошных или нижней полой венах заставляет помимо антикоагулянтной терапии по приведенной выше схеме прибегать к парциальной окклюзии нижней полой вены. Методом выбора у послеоперационного контингента больных является имплантация кава-фильтра. При невозможности проведения этого вмешательства у пациентов, которым предстоит операция на брюшной полости, она может быть начата с пликации нижней полой вены механическим швом.
Вопросы, требующие дальнейшего изучения Утверждения и рекомендации, данные в настоящем консенсусе, основаны на данных международных многоцентровых исследований, которые с высокой степенью достоверности доказали необходимость применения тех или иных методов профилактики и лечения послеоперационных венозных тромбоэмболических осложнений. Однако на сегодняшний день некоторые вопросы остаются не вполне ясными и решенными.1. Уточнение дозы НМГ в тех случаях, когда в силу различных обстоятельств (высокий риск развития интра операционного кровотечения, экстренные операции) введение антикоагулянтов начинают после завершения оперативного вмешательства.2. Определение степени риска развития ТГВ/ТЭЛА при проведении инвазивных диагностических процедур и малых операций.3. Уточнение продолжительности профилактического применения антикоагулянтов в отдаленном послеоперационном периоде у больных с сохраняющимся высоким риском развития венозного тромбоза.4. Изучение вопроса об оптимальных продолжительности и методах лечения тромбозов, развившихся во время беременности, родов и в послеродовом периоде. Для ответа на эти вопросы необходимо проведение или завершение обширных международных исследований, результаты которых могут лечь в основу будущих рекомендаций.
Заключение
Проблему послеоперационных венозных тромбоэмболических осложнений следует считать одной из важнейших в современной клинической медицине наряду с онкологическими заболеваниями, СПИДом и атеросклерозом. Существует настоятельная необходимость широкого внедрения в клиническую практику эффективных мер их профилактики, описанных в настоящем документе. Это позволит уменьшить послеоперационную летальность, снизить частоту тяжелых форм хронической венозной недостаточности и получить ощутимый экономический эффект. Профилактика венозного тромбоза должна быть включена в стандарты Министерства здравоохранения Российской Федерации и в Региональные стандарты и внедрена в рутинную практику лечения всех без исключения больных хирургического профиля.
Актуальные вопросы диагностики и лечения сепсиса
Сепсис является наиболее частой причиной летальных исходов в отделениях реанимации и интенсивной терапии, в США он занимает 13-е место среди причин смерти и является самой распространенной причиной шока. Бактериальные инфекции наиболее часто становятся причиной септического шока. В год диагностируется 300–500 тыс. случаев сепсиса, при этом шок развивается примерно у 40% пациентов. Несмотря на возросшие возможности интенсивной терапии, летальность составляет от 16% у пациентов с сепсисом до 60% у пациентов с септическим шоком.
Этиология наиболее частых причин сепсиса: Escherichia coli (наиболее частый возбудитель), Klebsiella, Enterobacter, Proteus, Pseudomonas (часто связана с предшествующей антибактериальной терапией и ожогами; наиболее высокая летальность), Bacteroides fragilis (наиболее частый возбудитель анаэробных бактериемий), Staphylococcus aureus (некоторые штаммы способны продуцировать токсин синдрома токсического шока), Streptococcus pneumoniae. Сепсис новорожденных - E.coli, S.agalactiae (стрептококки группы B являются основной причиной неонатального сепсиса). Грибы и вирусы – (например, вирус иммунодефицита человека – ВИЧ) способны вызывать генерализованные поражения эндотелия капилляров, которые могут клинически проявляться состояниями, напоминающими септический шок, хотя и не являются таковыми.
Эпидемиология
Грамотрицательный септический шок: впервые описали в 1951 г., развивается примерно у половины пациентов с грамотрицательным сепсисом, летальность достигает 50%, является причиной 115 000 случаев летальных исходов в год в США.
Грамположительный септический шок: наиболее частые причины – пневмонии и использование сосудистых катетеров, развивается примерно у половины больных, летальность не превышает 20%.
Факторы, способствующие повышению заболеваемости сепсисом:
1. Агрессивная химиотерапия и лучевая терапия онкологических больных. 2. Возрастающее применение кортикостероидных и иммуносупрессивных препаратов у пациентов с небактериальными воспалительными заболеваниями и трансплантацией органов. 3. Динамика демографических показателей: увеличение продолжительности периода высокого риска возникновения сепсиса – выхаживание новорожденных с высокой степенью недоношенности, увеличение продолжительности жизни и численности пожилых лиц, онкологических больных и пациентов с тяжелыми соматическими заболеваниями, диабетом, гранулоцитопенией. 4. Развитие медицины, расширение использования инвазивных устройств: хирургических протезов, оборудования для дыхательной и ингаляционной терапии, внутрисосудистых и мочевых катетеров, парентерального питания. 5. Нерациональное применение антимикробных препаратов, создающее условия для размножения, колонизации и развития инфекции более агрессивными и резистентными к антибиотикам микроорганизмами.
Источники инфекции: 1. Ротоглотка и пищеварительный тракт. 2. Область операции или инвазивной манипуляции. 3. Контаминация патогенной флорой оборудования для дыхательной и ингаляционной терапии. 4. Внутривенное введение инфицированных жидкостей.
Наиболее частые области развития инфекции:
легкие,
брюшная полость,
мочевыделительная система.
Факторы риска развития сепсиса:
1. Нейтропения, онкологические заболевания, диспротеинемия, цирроз печени, диабет, инфекция ВИЧ, другие тяжелые хронические заболевания.
2. Операции или инвазивные процедуры, катетеризации сосудов и мочевого пузыря.
3. Применение иммуносупрессоров и антибиотиков широкого спектра действия.
4. Возраст: мужчины старше 40 лет, женщины в возрасте 20–45 лет.
5. Предрасполагающие состояния: роды, септические аборты, травмы, обширные ожоги, язвенные поражения желудочно-кишечного тракта.
Определения
Бактериемия – важнейший лабораторный критерий сепсиса – обычно развивается после инвазии лимфатической системы.
Транзиторная бактериемия – кратковременная бактериемия при проведении инвазивных (стоматологических, гинекологических и др.) процедур, катетеризации мочевого пузыря, при некоторых инфекциях (например, менингит, сальмонеллез).
Периодическая бактериемия – повторная инвазия, связанная с попаданием бактерией из области ограниченного гнойного очага или абсцесса. Постоянная бактериемия – постоянная инвазия микроорганизмов, попадающих в кровоток из неограниченного очага инфекции (эндокардит, инфицированная аневризма или область катетеризации).
Сепсис – генерализованное воспаление в ответ на периодическую или постоянную бактериемию.
Тяжелый сепсис – сепсис с развитием органной дисфункции или недостаточности. Септический шок – тяжелый сепсис с развитием артериальной гипотензии (артериальное давление – АД < 90 мм. рт.ст. или на 40 мм рт.ст. ниже обычного для данного пациента).
Внебольничный сепсис – сепсис, развившийся в течение до 48 ч пребывания пациента в стационаре.
Внутрибольничный сепсис – сепсис, развившийся после 48 ч пребывания пациента в стационаре при отсутствии признаков заболевания при поступлении.
Синдром полиорганной недостаточности («синдром срыва аутотолерантности») ставят если на протяжении 24 ч зарегистрирован хотя бы один показатель для каждой из перечисленных систем органов:
Сердечно-сосудистая система
ЧСС 54 мин-1
Среднее АД 49 мм рт. ст. или систоличское АД < 60 мм рт. ст.
Желудочная тахиаритмия или фибрилляция желудочков
РН крови 7,24 при раСО2 49 мм рт. ст.
Легкие
ЧД 5 мин-1 или > 49 мин-1
раСО2 49 мм рт. ст.
р(А-а)О2 350 мм рт. ст.
Необходимость в постоянном положительном давлении при самостоятельном дыхании или необходимость в ИВЛ
Почки
Диурез 479 мл/сут или 159 мл/8 ч
Мочевина плазмы 100 мг% (>36 ммоль/л)
Уровень креатинина сыворотки 3,5 мг% (>310 мкмоль/л)
Кровь
Лейкоциты 1000/мкл
Тромбоциты 20 000/мкл
Гематокрит 20%
Неврологический статус
Сумма баллов по шкале комы Глазго 6 ( в отсутствие седативной терапии)
Печень
Общий билирубин > 6 мг%
Протромбиновое Время на 4 с выше контрольного
С окращение:
р(А-а)О2 – альвеолярно-артериальная
разница парциального давления кислорода.
окращение:
р(А-а)О2 – альвеолярно-артериальная
разница парциального давления кислорода.
Микробные факторы патогенности:
Грамотрицательные бактерии: эндотоксин, формилпептид, экзотоксины, протеазы, нейраминидазы.
Грамположительные бактерии: экзотоксины, суперантигены (токсин синдрома токсического шока – TSST, стрептококковый пирогенный экзотоксин А - SpeA), энтеротоксины, гемолизины, пептидогликаны и липотейхоевая кислота.
Элементы клеточной стенки грибов.
Диагностика
Анамнез. Особое внимание необходимо обратить на:
1. Лихорадку, признаки наличия злокачественных процессов, недавнее применение инвазивных диагностических процедур.
2. Олигурию или анурию, связанную с гипотензией. 3. Одышку или гипервентиляцию без очевидной причины. 4. Кровотечение.
Объективный осмотр. Необходимо внимательно осмотреть пациента. Обратить внимание на состояние зубов и слизистой полости рта, признаки повреждения кожных покровов. У пациентов с нейтропенией и при подозрении на сепсис, связанный с патологией тазовых органов, необходимо провести ректальное и вагинальное исследование. Это обследование помогает выявлять абсцессы в области прямой кишки, воспалительные заболевания и абсцессы малого таза, простатит.
Лабораторные данные. Обязательными являются: исследование формулы крови, исследование мочи, системы свертывания, мочевины крови, креатинина, электролитов, печеночных тестов, уровня лактата, газов крови, электрокардиограммы и рентгенологическое исследование органов грудной клетки. Обязательно должны быть проведены посевы наиболее вероятно инфицированных биологических жидкостей (крови, мокроты, мочи и др.) или областей (ротоглотка, отделяемое раны или области операции), а также окраска по Граму гнойных экссудатов нормально стерильных жидкостей (ликвор, внутрисуставная жидкость, плевральный выпот). В течение суток проводят 2–3 посева крови. Объем крови, забираемой для исследования, очень важен, так как в крови взрослых пациентов интенсивность бактериемии может быть менее 1 бактерии в 1 мл (у детей может быть выше). При посеве производится забор 10–20 мл крови взрослых и 1–5 мл крови детей на специальные питательные среды. При повторяющихся подъемах температуры период наиболее интенсивной бактериемии бывает примерно за 30 мин до достижения максимума температуры. Применение антибиотиков может привести к невозможности выделения возбудителя из крови. В зависимости от состояния больного и диагностических задач желательно иметь возможность проведения рентгенологического и ультразвукового исследования органов брюшной полости, компьютерной и магнитно-резонансной томографии, эхокардиографии и люмбальной пункции.
Динамика лабораторных показателей. В начальной фазе сепсиса: лейкоцитоз со сдвигом формулы влево, тромбоцитопения, гипербилирубинемия и протеинурия. Могут наблюдаться лейкопения, токсическая зернистость нейтрофилов, вакуолизация цитоплазмы. Гипервентиляция приводит к дыхательному алкалозу. Гипоксемия может быть компенсирована ингаляцией кислорода. У больных диабетом может развиваться гипергликемия. Повышен уровень липидов сыворотки.
В фазе развернутых клинических признаков сепсиса: тромбоцитопения с удлинением тромбинового времени, снижение концентрации фибриногена, появление D-димеров – признаков ДВС синдрома. Азотемия, гипербилирубинемия и активность аминотрансфераз могут достигать более высокого уровня. При появлении слабости дыхательных мышц происходит накопление лактата в сыворотке. Метаболический ацидоз компенсируется респираторным алкалозом. Гипоксемия не устраняется даже ингаляцией 100% кислорода. Гипергликемия у диабетиков может трансформироваться в кетоацидоз и сопровождаться гипотензией.
Лечение
1. Стабилизация состояния пациента.
2. Эрадикация микроорганизмов из кровотока.
3. Проведение дополнительных мер по контролю очага инфекции.
Эрадикация микроорганизмов из кровотока. Теоретически применение некоторых антимикробных препаратов может быть опасным. В экспериментальных условиях показано, что взаимодействие некоторых антибиотиков с грамотрицательными бактериями может способствовать увеличению концентрации в крови ЛПС. Антибиотиками, которые в меньшей степени способны вызывать выделение ЛПС, являются: карбапенемы, цефтриаксон, цефепим, аминогликозиды и фторхинолоны.
Применение эмпирической антибактериальной терапии является обязательным. После посева крови обычно применяют антибиотики широкого спектра действия, так как результаты микробиологического исследования будут получены позже.
В качестве этиотропной терапии можно применять монотерапию карбапенемами или комбинированную терапию 2–3 антимикробными препаратами (цефалоспорины + аминогликозиды + препараты с антианаэробной активностью). Переход на монотерапию после комбинированной терапии возможен только после получения результатов микробиологического исследования.
При высокой вероятности грамположительного внебольничного сепсиса можно применять бета-лактамные антибиотики с антистафилококковой активностью (оксациллин, цефазолин), а при высокой вероятности внутрибольничного грамположительного сепсиса – гликолипидные (ванкомицин) антибиотики. При подозрении на анаэробную инфекцию применяют метронидазол или клиндамицин.
Дополнительные методы контроля очага инфекции. Удаление инородных тел. Адекватное дренирование гнойного экссудата. Радикальное удаление или санация очага инфекции, поврежденных или некротизированных тканей особенно важно при анаэробной инфекции.
Травма груди Классификация
А. Закрытая травма грудной клетки
Б. Проникающая травма грудной клетки
неотложные состояния, непосредственно угрожающие жизни пострадавшего
потенциально опасные для жизни – состояние больных позволяет в течение нескольких часов поставить точный диагноз и разработать необходимую тактику лечения (классификация Коллегии травматологов Американского общества хирургов)
Патогенез расстройств при травмах груди
Один из ведущих фактов в патофизиологии — повышение давления в малом круге кровообращения.
Основные причины патологической функции:
Внутригрудное кровоизлияние, сопровождающееся сдавлением легких, сосудов (легочных вен, полых вен, пр. желудочка). 1 литр излившейся крови снижает минутный объем сердца, нарушается внутрибронхиальная проходимость
Пневмоторакс — приводит к нарушению функции. Нередко воздух входит в межуточную ткань легкого (межуточные очаговые эмфиземы)
Нарушение целости грудного каркаса — мощный механизм для патологических реакций. При нарушении целостности стенки появляется парадоксальное движение. Парадоксальное дыхание может быть одно и двусторонним, нарушается вентиляция. Нет эффективности кашля. Особенно опасны передние переломы ребер, особенно билатеральные (в мирное время 80 % погибают). При вдохе грудина проваливается и сдавливает сосуды, сердце, легкие.
Нарушение бронхиального дренажа. Гемоаспирация, бронхиальный секрет — гиперсекреция.
Гипертензия в малом круге кровообращения ведет к гиперсекреции, нарушению дренажа, гипоксемии. Последняя ведет к гипертензии — замыкается порочный круг Курнара.
Нарушение дыхания при травме — травматопное, дыхание в патологических условиях.
К главным 4 факторам можно добавить второстепенные
Повреждение сердца и перикарда. Особенно при закрытых повреждениях из-за повреждения миокарда, развития субэпикардиальных гематом
Метеоризм
Травма диафрагмы — острая диафрагмальная грыжа
Нарушается выведение углекислоты — гиперкапния
К гипоксии и гиперкапнии, прежде всего, чувствительны
миокард — ослабляется насос, нарушается сердечный ритм
ЦНС — нарушается регуляция кровообращения. Гипоксемия вызывает эйфорию
Почки не функционируют при низком АД. Миоглобин закупоривает почечные канальцы, что приводит к почечной недостаточности.
Клинические признаки травмы груди
Цианоз – признак нарастающей гипоксемии, обусловленной дыхательной недостаточностью
Наличие или отсутствие самостоятельного дыхания, западение межреберий во время вдоха – дыхательная недостаточность, обструкция дыхательных путей; парадоксальное дыхание (окончатый перелом ребер с флотацией грудной стенки); односторонние дыхательные движения (разрыв бронха, пневмоторакс, односторонний гемоторакс), стридор – повреждение верхних дыхательных путей.
Подкожная эмфизема, особенно век и шеи, — признак повреждения легкого или главного бронха.
«Сосущая» рана грудной стенки.
Альтернирующий пульс, аритмии наблюдаются при ушибе сердца и дисфункции миокарда.
Гипотония – признак острой кровопотери, повреждения сердца.
Набухшие непульсирующие шейные вены – признак тампонады сердца.
Сравнительная аускультация легких, притупление перкуторного звука (гемоторакс, ателектаз), громкий тимпанический перкуторный звук – признак пневмоторакса.
Сердечные шумы – повреждение одного из клапанов сердца, разрыв сосочковых мышц или межжелудочковой перегородки; шум трения перикарда – в полости перикарда может находиться воздух.
Другие исследования:
Рентгенологическое — обзорная рентгенография грудной клетки (если состояние позволяет, лучше сделать снимки в передней и боковой проекциях).
Наиболее важные признаки травмы груди:
а. Частичное или полное затемнение легочного поля (скопление крови или другой жидкости)
б. Смещение средостения
в. Подкожная эмфизема, пневмомедиастинум
г. Переломы ребер (при переломах верхних ребер со смещением высока вероятность ранения крупного сосуда)
д. Расширение средостения (более 8 см в задней прямой проекции у лежащего на спине взрослого) — признак разрыва крупного сосуда
е. Отсутствие контура дуги аорты в прямой проекции, задней или передней (признак повреждения аорты)
ж. Отклонение назогастрального зонда вправо (признак повреждения аорты)
з. Увеличение тени сердца (гемоперикард или выпот в полость перикарда), выпрямление левой границы сердца
и. Газовые пузыри желудка и кишечника над диафрагмой (разрыв диафрагмы)
ЭКГ – особое внимание при тупой травме – сильном ударе в грудь. Нарушение ритма сердца, изменения сегмента ST и зубца Т, характерные для ишемии миокарда – признаки ушиба сердца.
Рентгенологическое исследование пищевода
Прицельная рентгенография ребер
Измерение газов артериальной крови
Аортография
Бронхоскопия
Торакоскопия
Лапароскопия
Угрожающие жизни состояния
Тампонада сердца
Тотальный гемоторакс
Напряженный пневмоторакс
Разрыв аорты
Окончатый перелом ребер
Разрыв диафрагмы
Принципы лечения травмы груди
В тактике лечения возможны 3 варианта: дренирование плевральной полости, операция, выжидательная консервативная терапия.
Показания к оперативному лечению при проникающих ранениях груди имеются в 95 % наблюдений. Они заключаются в первую очередь в торакоцентезе и закрытом дренировании плевральной полости, хирургической обработке ран груди, ушивании раны грудной стенки при открытом пневмотораксе. С накоплением опыта лечения раненных в грудь частота торакотомии уменьшается и составляет в ведущих лечебных учреждениях 10—15 %.
Показания к неотложной торакотомии:
Тампонада сердца или обоснованное подозрение на ранение сердца
Массивное продолжающееся внутриплевральное кровотечение
Показания к ранней торакотомии (1-2 суток после ранения):
Продолжающееся или возобновившееся кровотечение
Ранение крупных бронхов, пищевода, трахеи
Разрыв диафрагмы
Показания к отсроченной торакотомии (3-7 суток):
Стойкая негерметичность поврежденного легкого
Нагноение свернувшегося гемоторакса
Перспективным направлением в совершенствовании диагностики и лечения проникающих ранений груди является оперативная видеоторакоскопия, при помощи которой можно в кратчайшие сроки определить характер повреждений органов грудной полости, остановить кровотечение из сосудов грудной стенки и ран легкого, резецировать разрушенные ткани легкого, осуществить герметизацию легкого, удалить инородные тела, свернувшийся гемоторакс, провести санацию плевральной полости растворами антисептиков.
Отдельные виды травм Ранения сердца, перикарда
(А. А. Вишневский, М. И. Шрайбер, 1968)
слепые, сквозные, касательные
проникающие и непроникающие в полость сердца
Тампонада сердца – острая сердечная недостаточность, обусловленная скоплением крови или другой жидкости в полости перикарда.
Наиболее часто повреждаются желудочки сердца – в 75-% случаев (Вагнер Е. А., 1981)
Диагностика:
Триада БЕКА (падение АД, Увеличение ЦВД, глухость сердечных тонов)
Парадоксальный пульс – снижение систолического АД на вдохе более чем на 10 мм рт ст.
При ЭхоКГ — жидкость в полости перикарда, диастолическое спадение правого желудочка
При рентгенографии – увеличение тени сердца
Лечение:
Инфузионная терапия
Экстренная пункция перикарда проводится только при угрозе остановки кровообращения, если немедленно начать операцию невозможно.
Хирургическое вмешательство: стернотомия или левосторонняя переднебоковая торакотомия в 4-5 межреберье. После широкого вскрытия перикарда кровоточащую рану сердца прикрывают пальцем. Раны сердца ушиваются узловыми шелковыми или капроновыми швами, проведенными с помощью круглой иглы, стараясь не захватить коронарные артерии. Шов должен захватывать всю толщу стенки сердца, но не проникать в полость сердца. Необходим тщательный осмотр задней стенки сердца, т. к. возможно сквозное ранение. Перикард ушивается редкими швами, плевральная полость дренируется.
Гемоторакс
При остром (любой степени) гемотораксе необходимо:
дренирование плевральной полости (с целью эвакуации и наблюдения за интенсивностью кровотечения)
Дренирование плевральных полостей при гемотораксе имеет диагностическое и лечебное значение. Пункция плевры проводится по верхнему краю ребра в синусах, где определяется кровь. Для определения продолжающегося кровотечения проводится проба Ловеруа-Грегуара – пунктат помещается на чашку Петри, где при продолжающемся кровотечении наблюдается свертывание крови, а при остановившемся свертывание не наблюдается. Об инфицировании гемоторакса свидетельствует проба Эфендиева. После центрифугирования в пробирке слой плазмы увеличивается до 2/3. При добавлении в пробирку с кровью (пунктат) дистиллированной воды гемолитическая жидкость мутнеет при инфицировании и остается прозрачной при отсутствии инфицирования.
Торакотомия: 1) тотальный гемоторакс (более 1,5 л)
2) выделение по дренажам крови более 500 г за первый ч.
3) за каждый последующий час 150-200 г крови
4) увеличение количества крови по дренажам
При подостром (более 48 часов после травмы)



Более 1/3 легочного поля Менее 1/3 легочного поля

Пункция пункция (может и самостоятельно рассосаться в течение до 6 недель)

Дренирование
Для восполнения кровопотери всегда следует использовать аутокровь, которую собирают из плевральной полости через дренаж или во время торакотомии.
Повреждение аорты и крупных сосудов
При проникающем ранении аорта может быть повреждена в любом месте. При тупой травме груди обычно происходит разрыв дуги аорты под левой подключичной артерией на уровне артериальной связки
Большинство больных погибает на месте происшествия
Диагностика:
В анамнезе – тяжелая тупая травма груди, механизм которой – резкое торможение при ударе грудью о неподвижный предмет
При рентгенографии грудной клетки – расширение тени средостения более 8 см в прямой проекции
Отсутствие контура аорты
Отклонение назогастрального зонда вправо
Переломы верхних ребер со смещением, жидкость в плевральной полости, перелом позвоночника
Лечение
Левосторонняя заднебоковая торакотомия, пластика аорты протезом или ушивание раны
Повреждение пищевода Обнажение шейного и грудного отделов пищевода.
Шейный отдел. Разрез производят по внутреннему краю левой кивательной мышцы. Сосудисто-нервный пучок отводят латерально. Для улучшения доступа перевязывают нижнюю щитовидную артерию и щитовидную железу отводят крючком медиально. Левую лопаточно-подъязычную мышцу отводят или пересекают. Выделяют пищевод. Рану пищевода ушивают двухрядным швом или накладывают шейную эзофагостому. В запущенных случаях ограничиваются вскрытием абсцесса и его дренированием. Во всех случаях дренируют околопищеводную клетчатку.
Грудной отдел пищевода. Для дренирования медиастинального абсцесса, расположенного на уровне 11-111 грудных позвонков, можно использовать шейную медиастинотомию по В. И. Разумовскому. Если повреждение пищевода или медиастинальный гнойник находится в средней трети пищевода, применяют заднюю внеплевральную медиастинотомию по И. И. Насилову (1888). Техника операции состоит в следующем. Соответственно положению гнойника или перфорации пищевода проводят разрез длиной 15-20 см по наружному краю длинных мышц спины вдоль позвоночника. Мышцы отводят к позвоночнику, резецируют 2-3 ребра, перевязывают межреберные артерии, тупо отслаивают медиастинальную плевру, входят в гнойник или выделяют поврежденный сегмент пищевода. Отверстие пищевода ушивают, гнойник дренируют. Накладывают гастростому. При вовлечении в гнойный процесс плевры доступ к грудному отделу пищевода целесообразно осуществить через соответствующую плевральную полость с дренированием последней. Доступ к нижней трети пищевода в зависимости от целей осуществляют через левосторонний торакотомный разрез в 7-8 межреберье (операции планового характера) или через брюшную полость (операции по А. Г. Савиных или задняя медиастинотомия по Б. С. Розанову). При медиастинитах в нижней трети пищевода вскрывают брюшную полость, производят сагиттальную внеплевральную диафрагмотомию и дренируют заднее средостение через брюшную полость и переднюю брюшную стенку.
Во всех случаях перфорации пищевода и при медиастинитах накладывают гастростому или осуществляют зондовое питание, исключая сглатывание слюны
Пневмоторакс
Различают закрытый, открытый и клапанный (напряженный). Пневмоторакс может быть малым, средним, большим в зависимости от степени спадения легкого.
Диагностика особых трудностей не вызывает. Первыми лечебными мероприятиями могут быть закрытие открытого пневмоторакса окклюзионой повязкой. При напряженном пневмотораксе осуществляется перевод его в открытый или дренирование плевральной полости трубочным дренажем, наружный конец которого помещается в сосуд с жидкостью (на конце трубки резиновый палец от перчатки, исполняющий роль клапана).
Лечение следует начинать с закрытия раневого канала.
Дренирование, если:
средний и большой пневмоторакс (воздух занимает более 1/3 легочного поля)
напряженный пневмоторакс
нарастающий пневмоторакс
Торакотомия, если:
Выделяется большое количество воздуха по дренажу, независимо от того, расправляется легкое или нет
Переломы ребер
Наиболее опасны окончатые переломы ребер – множественные двойные или двусторонние переломы ребер с образованием «реберного клапана»
Синдром флотирующей грудной клетки – грудная стенка или как минимум одна ее половина оказываются в нестабильном состоянии. Пораженные участки двигаются парадоксально – внутрь на вдохе, поскольку в эту фазу внутриплевральное давление становится ниже атмосферного, и кнаружи на вдохе, т. к. внутриплевральное давление превышает атмосферное.
Коррекцию дыхательной недостаточности проводят с помощью ИВЛ, обезболивания, кислородотерапией.
При одиночных переломах ребер выполняют межреберную новокаиновую блокаду мест переломов — в межреберья ниже и выше зоны перелома по нижнему краю ребра и непосредственно в гематому. Адекватное обезболивание ненаркотическими анальгетиками. При недостаточном обезболивании выполняют паравертебральную блокаду. Дыхательная гимнастика, отхаркивающие препараты, иммобилизация грудной клетки не показана. При явлениях ателектаза – санационная бронхоскопия. При переломах ребер по двум линиям и при окончатых переломах возможно возникновение тяжелой дыхательной и сердечно-сосудистой недостаточности, при этом необходимо решать вопрос о переводе пострадавшего на ИВЛ с ПДКВ (в т. ч. с целью внутренней пневматической стабилизации перелома до операции). В этой группе больных показано наложение трахеостомы на 2-3 сутки ИВЛ, регулярные санационные бронхоскопии. Нестабильные переломы ребер фиксируются оперативно в экстренном порядке после выведения больного из шока. Накладывают наружную шинирующую пластину с подшиванием ее к флотирующему фрагменту, скелетное вытяжение или при выраженном смещении отломков ребер выполняют их остеосинтез. Все операции проводят экстраплеврально.
При окончатых переломах под нестабильным фрагментом часто локализуется ушиб легкого. У больных с тупой травмой груди и переломами 8-9 ребер всегда необходимо помнить о возможности травмы селезенки и диафрагмы.
Повреждение паренхимы легкого
Часто возникает при:
переломах ребер
проникающих ранениях груди
осложнениях сердечно- легочной реанимации
При показаниях к торакотомии поврежденный участок легкого прошивают хромированным кетгутом, пропиленовой нитью, капроном.
Резекция более 1 сегмента требуется крайне редко
Разрывы и ранения трахеи и бронхов Проявления:
пневмомедиастинум
пневмоторакс
выделение большого количества воздуха по дренажам
ателектаз
локализация — киль трахеи при тупой травме груди, граница гортани и трахеи при ударе в шею
уточнение диагноза при бронхоскопии
Лечение:
Шов бронха
Резекции бронхов с наложением межбронхиального анастомоза
Резекция пораженной доли или пневмонэктомия
ПОКАЗАНИЯ К ТРАХЕОСТОМИИ при травме груди:
Парадоксальное дыхание
Напряженный пневмоторакс
Нарушение дренажной функции бронхов
Дыхательная недостаточность, вызванная любой другой причиной
Хилоторакс
Скопление лимфы в плевральной полости встречается при проникающих ранениях средостения – отделение молочно- белой жидкости по дренажам.
В большей части случаев дефекты грудного лимфатического протока закрываются самостоятельно.
Лечение:
Правило: «ничего внутрь», в/в инфузии незаменимых аминокислот.
Если истечение лимфы продолжается более 10-14 сут., то – торакотомия на стороне хилоторакса либо только правосторонний доступ и перевязка протока непосредственно над диафрагмой.
Разрыв диафрагмы
При тупой травме обычно возникают обширные разрывы диафрагмы с выпадением органов брюшной полости в грудную. Проникающие ранения груди и живота тоже могут сопровождаться повреждением диафрагмы, которое может остаться нераспознанным и много лет спустя проявляется ущемленной диафрагмальной грыжей.
Лечение:
Для восстановления целости диафрагмы необходимо хирургическое лечение. Сразу после травмы предпочтительна ЛАПАРОТОМИЯ (за исключением больных с тяжелыми сопутствующими повреждениями грудной клетки)
Длительно существующий дефект диафрагмы обычно ушивают со стороны грудной полости.
ТРАВМАТИЧЕСКАЯ АСФИКСИЯ
Возникает при сильном одномоментном или длительном сдавлении грудной клетки. Лицо, шея и верхняя половина грудной клетки имеет синюшную окраску. В остром периоде отмечается неврологическая симптоматика – потеря сознания, психические нарушения, эпилептические припадки.
Сочетанные ранения груди и живота
При ранениях холодным оружием следует различать торакоабдоминальные, абдоминоторакальные и одновременные ранения груди и живота. При огнестрельных ранениях такая дифференцировка не имеет принципиального значения. Встречаются у 10-20 % больных, поступивших с проникающими ранениями груди. (Е. А. Вагнер и др.,1992). Торакоабдоминальное ранение следует предположить, если рана находится на уровне сосков или ниже. Повреждение диафрагмы и органов брюшной полости возможно и при более высоком расположении входного отверстия, если рана нанесена длинным предметом, а также при огнестрельных ранениях из-за непредсказуемости движения пули
Клиническая картина включает в себя симптомы повреждения груди, живота и признаки острой кровопотери.
Наиболее важные клинические признаки- симптомы повреждения живота при локализации наружной раны на грудной стенке:
выпадение сальника через рану груди
истечение содержимого ЖКТ через рану груди
рвота кофейной гущей
Задача: не только распознать сочетанные ранения груди и живота, но и установить хотя бы примерный объем повреждений в груди и животе, чтобы выбрать оптимальный хирургический доступ, решить вопрос о последовательности вмешательства на органах груди и живота
Дополнительные диагностические приемы:
учет направления раневого канала
комплекс диагностических исследований
ревизия наружных ран
лапароцентез
торакоскопия и лапароскопия
Лечение:
В определении хирургической тактики приоритетной является оценка состояния плевральных полостей. Как и при изолированных ранениях груди, показаниями к неотложной торакотомии является продолжающееся массивное внутриплевральное кровотечение, повреждение сердца, трахеи и крупных бронхов, после чего решается вопрос о лапаротомии. Вопрос о возможности чресплеврального устранения повреждений органов живота путем диафрагмотомии требует дополнительного изучения. При отсутствии показаний к торакотомии вмешательство должно быть ограничено дренированием плевральной полости с последующей лапаротомией. В зависимости от того, в какой из полостей — плевральной или брюшной повреждения носят более опасный, не терпящий отлагательства, характер, выбирается наиболее приемлемый характер вмешательства
торакотомия с трансдиафрагмальной лапаротомией
лапаротомия
раздельные торакотомия и лапаротомия
тораколапаротомия одним доступом
Послеоперационный период
Принципы:
Поддержание на соответствующем уровне легочной вентиляции – предупреждение коллапса оставшихся частей легкого, обтурации бронхиального дерева, уменьшение болевого синдрома, профилактика пневмонии
Своевременное восполнение кровопотери
Сохранение адекватного уровня гемодинамики
Компенсация функции печени и почек
Торакотомия должна быть закончена дренированием полости плевры 2-мя дренажами – для оттока экссудата и удаления воздуха – для предупреждения коллапса легкого. Лишь пневмонэктомию заканчивают дренированием плевральной полости одной дренажной трубкой – через 8-9 межреберье по задней подмышечной линии для оттока экссудата.
ПОВРЕЖДЕНИЯ ЖИВОТА
Причины: 1. Непосредственно прямой удар.
2. Сдавление между предметами.
3. Падение с высоты.
4. Дорожно-транспортные аварии.
5. Удар колющими и режущими предметами.
6. Огнестрельные и минно-взрывные ранения.
Классификация.
Выделяют: изолированную, множественную, сочетанную и комбинированную травму живота.
Кроме того, травма живота делится на две большие группы: открытую и закрытую.
Открытые повреждения живота бывают двух видов: непроникающие и проникающие. Критерием служит повреждение париетального листка брюшины.
По этиологии раны делятся: колотые, резанные, рубленные, рваные, ушибленные, огнестрельные.
Непроникающие раны делятся на 2 группы:
1. Ранение тканей брюшной стенки.
2. Ранение внебрюшинно расположенных органов.
Проникающие раны бывают 2 видов:
1. Без повреждения внутренних органов.
2. С повреждением внутренних органов.
Закрытая травма также живота делится на 2 большие группы:
1. Без повреждения внутренних органов.
2. С повреждением внутренних органов.
Все травмы живота с повреждением внутренних органов бывают нескольких видов:
1. Повреждение органов брюшной полости.
2. Повреждения органов забрюшинного пространства.
3. Повреждение органов брюшной полости и забрюшинного пространства.
По виду поврежденного органа:
1. Повреждение полого органа.
2. Повреждение паренхиматозного органа.
3. Повреждение полого и паренхиматозного органов.
4. Повреждение крупных сосудов.
Клиника и диагностика.
Клиника повреждений брюшной полости зависит от характера травмы и локализации повреждения. Она различна при повреждении полых и паренхиматозных органов. При повреждении полых органов на первый план выступает клиника перитонита. При повреждении паренхиматозных органов клиника внутреннего кровотечения. При одновременном повреждении этих органов, клиника наслаивается одна на другую.
Алгоритм диагностики включает в себя:
1. Выяснение обстоятельств травмы.2. Жалобы пострадавшего. 3. Осмотр. 4. Пальпация.5. Перкуссия.6. Аускультация.7. Лабораторная диагностика.8. Рентгенологическая диагностика.9. Инструментальные методы обследования.10. Дополнительные методы обследования.
Выяснение обстоятельств травмы имеет большое значение в постановке правильного диагноза. Необходимо выяснить механизм травмы и время, прошедшее с момента повреждения. Если пострадавший находится без сознания, то обстоятельства травмы выясняют у сопровождающих или работников скорой помощи.
Жалобы.
1. Основная жалоба — боль в животе. Она бывает разной интенсивности, локализации и иррадиации.
При разрыве полого органа боль бывает очень сильная, распространяется по всему животу. При гемоперитонеуме — боль менее интенсивная, отдаёт в плечо, лопатку.
2. Сухость во рту чаще всего встречается при повреждении полого органа, но может быть и при повреждении паренхиматозного.
3. Рвота.
4. Вздутие живота. Может быть, при перитоните и при скоплении крови в брюшной полости.
5. Задержка газов. Является характерным признаком пареза желудочно-кишечного тракта.
6. Затрудненное мочеиспускание встречается при повреждении мочевыводящих путей. Может быть рефлекторным при любых повреждениях.
Осмотр. 1. Оцениваем сознание больного. Чаще всего пострадавшие с изолированными повреждениями живота находятся в ясном сознании. Если сознание у больного отсутствует, нужно думать о сочетании повреждения живота и головы. Выясняем другие причины отсутствия сознания.
2. Положение пострадавшего. Скопление большого количества жидкости в брюшной полости вызывает т. н. симптом "Ваньки-встаньки". Пострадавший не может находиться в положении лёжа на спине и пытается встать или сесть. Этот симптом характерен для разрыва паренхиматозного органа и мочевого пузыря. При перитоните больной находится в вынужденном положении, лёжа на боку с приведёнными к животу ногами.
3. Наличие признаков анемии: бледность кожных покровов и слизистых, холодный пот, частое и поверхностное дыхание, снижение артериального давления, тахикардия со слабым наполнением пульса. Определяем шоковый индекс Алговера-Бурри: отношение частоты пульса к значению систолического артериального давления. Величина индекса больше 1 говорит о шоке II-III.
4. Осмотр языка. Сухой язык-возможный признак перитонита.
5. Осмотр живота. Отсутствие дыхательных экскурсий брюшной стенки позволяет думать о повреждении органов брюшной полости. Вздутие живота встречается как при перитоните, так и при повреждениях паренхиматозных органов. Асимметрия брюшной стенки встречается при гематомах брюшной полости и забрюшинного пространства, ограниченных скоплениях жидкости в брюшной полости, инфильтратах. Абсцессах, кишечной непроходимости. Затем выявляем местные признаки повреждения: гематомы, ссадины, раны. При осмотре раны определяем её вид, состояние, размеры, наличие наружного кровотечения, наличие эвентерации органа. Выявляем присутствие в ране инородных тел.
6. Наличие гематурии характерно для повреждения почек и мочевыводящих путей.
7. Выявить наличие у пострадавшего непроизвольного мочеиспускания и дефекации. Непроизвольная дефекация-признак геморрагического шока. Анальные сфинктеры полностью расслаблены при давлении ниже 60. Это прогностически неблагоприятный признак.
Пальпация. При пальпации живота определяем, имеется или отсутствует напряжение мышц передней брюшной стенки. Напряжение мышц — признак разрыва полого органа. Определяем симптом Щёткина-Блюмберга, характерный для перитонита. При пальпации живота определяем локальную болезненность. У некоторых больных производится ректальное исследование. Болезненность и пастозность кармана Дугласа, определение инфильтрата — характерны для перитонита. При пальпации поясничной области выявляем наличие болезненности, урогематомы.
Перкуссия.1. Притупление перкуторного звука в отлогих отделах живота является признаком скопления жидкости в брюшной полости. 2. Болезненность при перкуссии (симптом Менделя) — признак повреждения полого органа. 3. Исчезновение печёночной тупости характерно для разрыва полого органа. 4. Изменение перкуторных данных при перемене положения тела (симптом Джойса) свидетельствует о наличие свободной жидкости в брюшной полости. 5. Болезненность при перкуссии поясничной области (симптом Пастернацкого) — признак повреждения почки.
6. Симптом Куленкампфа: несоответствие между резкой болезненностью при пальпации в эпигастральной области и незначительным напряжением мышц.
Аускультация. Выслушиваем перистальтику кишечника. Отсутствие перистальтических шумов свидетельствует о перитоните.
Лабораторная диагностика. 1. Общий анализ крови. 2. Общий анализ мочи. 3. Биохимический анализ крови. Повышение амилазы крови говорит нам о повреждении поджелудочной железы. Повышение уровня трансаминаз-признак повреждения печени. Данные биохимического анализа позволят нам судить о наличии или отсутствии печёночной, почечной недостаточности.4. Коагулограмма.5. Кислотно-щелочное состояние.
Рентгенологическая диагностика. Производится обзорная рентгенография (скопия) брюшной полости. При этом можно выявитьпризнаки: 1. Наличие свободного газа в брюшной полости — признак повреждения полого органа. 2. Наличие жидкости в брюшной полости- признак разрыва паренхиматозного органа или мочевого пузыря. 3. Раздутые петли тонкой и толстой кишки- признак пареза желудочно-кишечного тракта.4. Высокое расположение купола диафрагмы.5. Признаки повреждения диафрагмы.6. Повреждения костей таза и грудной клетки. Для диагностики повреждения некоторых органов проводятся специальные рентгенологические исследования (урография, цистография и др.).
Электрокардиография.
Ультразвуковое исследование. УЗИ брюшной полости позволяет выявить: 1. Свободную жидкость в брюшной полости. 2. Подкапсульные гематомы и разрывы паренхиматозных органов. 3. Выявление забрюшинных гематом. Особенно ценным данный метод является для диагностики повреждения почек. Метод прост и может быть выполнен при любом состоянии пострадавшего, затрачивая небольшое количество времени.
Инструментальные методы. 1. Лапароцентез с шарящим катетером.(за рубежом носит название "диагностический перитонеальный лаваж") Самый простой и распространённый метод диагностики повреждений органов брюшной полости. Занимает немного времени и применим, не зависимо от тяжести состояния пострадавшего. При лапароцентезе выявляется наличие крови или патологической жидкости в брюшной полости. Катетер может быть оставлен в брюшной полости для динамического наблюдения. Лапароцентез противопоказан при спаечном процессе в брюшной полости, после ранее перенесенных операций. Интерпретация результатов лапароцентеза при переломах костей таза должна быть очень осторожной. При переломе костей таза очень часто повреждается париетальная брюшина, и гематома прорывается в брюшную полость. Это может привести к напрасной лапаротомии.
Лапароскопия. Метод более точен. Используется при отрицательных или сомнительных результатах лапароцентеза, для диагностики повреждений забрюшинно расположенных органов. Противопоказания: 1. Спаечный процесс в брюшной полости. 2. Острая дыхательная недостаточность. 3. Крайне тяжёлое состояние пострадавшего, с неустойчивой гемодинамикой.
Дополнительные методы исследования: 1. Эндоскопические методы.
2. Компьютерная томография.
3. Магниторезонансная томография
При проникающем характере раны выполняется лапаротомия.
Первичная хирургическая обработка при поступлении не проводится в следующих случаях:
1. При эвентерация органа брюшной полости.2. Выделение из раны брюшной стенки желудочного, кишечного содержимого, желчи.3При точечных колотых ранах. 4. При инфицированных ранах.
В первых двух случаях пострадавшие сразу направляются в операционную для выполнения лапаротомии.
В последних двух случаях тактика следующая: если с момента травмы прошло более суток и, отсутствуют признаки перитонита и клиника повреждения органов брюшной полости-больной госпитализируется для динамического наблюдения. Если имеется клиника перитонита или внутрибрюшного кровотечения производится лапаротомия.
Повреждения брюшной стенки.
К ним относятся: ушибы, гематомы, разрывы мышц, раны брюшной стенки.
Ушибы брюшной стенки.
Причина ушиба — прямой удар в живот, падение о твёрдый предмет.
Клиника: основная жалоба — боль в месте ушиба. Боль чётко локальная. Состояние пострадавшего удовлетворительное. При осмотре положение обычное. Иногда видна гематома брюшной стенки в месте удара. При пальпации определяется болезненность в месте ушиба. Напряжение мышц отсутствует.
Диагностика: 1. Осмотр.2. Общий анализ крови и мочи.3. Обзорная рентгенография (скопия) грудной клетки.
Главная задача хирурга при ушибах брюшной стенки — исключить повреждения внутренних органов. При подозрении на повреждение органов производится лапароцентез или лапароскопия. При исключении повреждения органов больной может быть отпущен на амбулаторное лечение. При неуверенности в диагнозе и после лапароцентеза больной госпитализируется для динамического наблюдения.
Лечение:1. Холод на место ушиба в первые 12 часов.2. Физиотерапия при гематомах брюшной стенки. 3. Анальгетики можно назначить при полном исключении повреждения органов.
Гематомы брюшной стенки.
Клиника такая же, как и при ушибах брюшной стенки. Гематома может быть разных размеров
Это может быть небольшое кровоизлияние или громадная организовавшаяся гематома.
При небольших гематомах тактика такая же, как и при ушибах.
При больших организовавшихся гематомах производится её пункция, удаление крови и сгустков и дренирование полости. Если имеется свернувшаяся гематома — производится небольшой разрез над местом флюктуации, удаляются все сгустки и дренируется полость гематомы. В последующем проводится рассасывающая терапия.
Повреждение полых органов.
Классификация повреждений полых органов (по Г. Ф. Николаеву и О. Н. Сурвилло):
1. Контузия стенки полого органа.
а. Со стороны слизистой оболочки — подслизистая гематома.
б. Со стороны серозной оболочки-субсерозная гематома.
2. Поверхностные разрывы и раны стенки полого органа.
а. Со стороны серозной оболочки.
б. Со стороны слизистой оболочки.
3. Дырчатые дефекты стенки полого органа.(с выпадением или без выпадения слизистой оболочки)
4. Поперечные разрывы полого органа.
а. Неполные
б. Полные (анатомический перерыв)
5. Продольные разрывы.
6. Отрывы органа от брыжейки.
7. Размозжение стенки полого органа.
8. Обнажение органа от покрывающей брюшины.
Повреждение желудка
Причина: чаще всего желудок повреждается при открытой травме живота. Закрытые повреждения желудка крайне редки, благодаря его анатомическому положению, защищенному рёберными дугами.
Механизм закрытых повреждений желудка:1. Сильный прямой удар в эпигастральную область. 2. Сдавление между предметами. 3. Падение с высоты.
Повреждению желудка способствуют следующие факторы: 1. Выраженная степень наполнения желудка.2. Патологическое изменение стенки желудка, (опухоль, язва и др.).
Классификация
Открытых повреждений желудка:
1. Повреждения серозно-мышечной оболочки желудка.
2. Рана, проникающая в просвет желудка.
3. Сквозное ранение желудка.
4. Ранение связочного аппарата желудка
Закрытые повреждения желудка:
1. Ушиб и гематомы стенки желудка.
2. Неполный разрыв стенки желудка.
3. Полный разрыв стенки желудка.
4. Отрыв желудка от кардии или привратника
5. Отрыв желудка от связок.
Клиника
При ушибах и поверхностных повреждения стенки желудка клиническая картина стертая: боль в месте травмы, умеренное напряжение мышц передней брюшной стенки, рвота с примесью крови.
При неполных разрывах стенки желудка различают три периода развития процесса (по С. Г. Горшкову): 1. Шока.2. Мнимого благополучия.3. Перитонита.
Диагностика. При закрытых повреждениях основывается на: 1. клиника.2. Обзорная рентгеноскопия (графия) брюшной полости. При полных разрывах определяется газ под куполом диафрагмы. 3. Лапароцентез. 4. Лапароскопия. 5. Фиброгастроскопия.
Открытые повреждения желудка чаще всего выявляются во время лапаротомии. Показанием к операции является проникающий характер раны. Реже, диагноз ранения желудка можно поставить при выделении из раны желудочного содержимого.
Лечение. Перед началом операции устанавливается назогастральный зонд. Оперативный доступ срединная лапаротомия. Ревизию начинаем с передней стенки желудка. Тщательно осматриваем малую и большую кривизны. Обязательна ревизия всех гематом. Особенно тщательно необходимо ревизовать гематомы малой и большой кривизны, вплоть до скелетирования стенки желудка в месте гематомы. При ранении передней стенки желудка обязательно осматривается задняя стенка. Для этого вскрывается сальниковая сумка через желудочно-ободочную связку.
Все раны и разрывы стенки желудка после экономного иссечения ушиваются двухрядными швами. При этом следует перевязывать или прошивать кровоточащие сосуды стенки желудка. Не прошитый сосуд может вызвать в послеоперационном периоде профузное кровотечение. При огнестрельных ранах желудка производится более широкое иссечение краев с ушиванием двухрядными швами. К швам подводится прядь сальника. При размозжении стенки желудка производится резекция в пределах здоровых тканей. Операция завершается дренированием поддифрагмальных пространств (чаще левого). При перитоните — дренируются поддиафрагмальные пространства и малый таз. Декомпрессия желудка осуществляется через назогастральный зонд.
Послеоперационный период. Проводится инфузионная антибактериальная терапия, анальгетики. Кормить 1а столом начинаем с 4 суток. С 7 суток –1 стол.
Повреждения двенадцатиперстной кишки
Механизм повреждения: ранение в эпигастральной области, сильный прямой удар в живот, сдавление между предметами. Предрасполагающим фактором является перенаполнение ДПК содержимым.
Классификация:
I. Открытые повреждения ДПК. Они делятся в зависимости от величины раны: а) до 1\2 диаметра кишки б) более 1\2 диаметра кишки в) полное поперечное пересечение кишки.
В зависимости от глубины раны ДПК делятся: а) повреждение серозно-мышечной оболочки б) рана всех слоёв кишки, проникающая в просвет.
II. Закрытые повреждения ДПК (классификация Романенко Е, А, 1978г.),
1. Ушиб стенки кишки без нарушения целостности серозной и слизистой оболочек, забрюшинная гематома.
2. Ушиб стенки с изолированной гематомой в подслизистом слое и забрюшинном пространстве.
3. Разрыв серозной и мышечной оболочек с сохранением слизистой оболочки, забрюшинная гематома.
4. Полный разрыв стенки ДПК, забрюшинная гематома.
5. Отрыв ДПК.
6 Разрыв ДПК с повреждением других органов.
Диагностика
1. Клиника 2. Лабораторная диагностика. 3. Рентгенологическая диагностика. Выявляется газ под куполом диафрагмы при внутрибрюшинных разрывах. При внебрюшинных разрывах имеется забрюшинная гематома с эмфиземой. Для подтверждения диагноза проводится пневмодуоденография или контрастное исследование. 4. Лапароскопия: выявляется забрюшинная гематома в проекции ДПК с зеленоватой окраской, стеариновые бляшки на брюшине. 5. Фиброгастродуоденоскопия.
Лечение
Доступ: срединная лапаротомия Чаще всего повреждения ДПК выявляется во время операции. Признаки, указывающие на повреждения ДПК: характер выпота грязно-зелёного цвета, забрюшинная гематома в проекции ДПК, студенистый отек тканей и пропитывание их желто-зелёной жидкостью, забрюшинная эмфизема, некроз забрюшинной клетчатки.
Для осмотра ДПК производят её мобилизацию по Кохеру. Производится осмотр всех отделов ДПК, особенно её задней стенки. Следует осторожно выполнять мобилизацию нижне-горизонтального отдела ДПК, так как этот отдел плохо кровоснабжается. При грубом выделении этого отдела может наступить нарушение питания с несостоятельностью швов (при ушивании разрыва этого отдела)
Оперативная тактика зависит: от размеров раны кишки, срока с момента травмы, сопутствующих повреждений поджелудочной железы.
Рассмотрим отдельно тактику при повреждении различных отделов 12перстной кишки.
Повреждения внутрибрюшинной части 12перстной кишки, (верхнегоризонтальная ветвь (D1)):
Вне зависимости от срока давности повреждения все раны этого отдела кишки после экономного иссечения, ушиваются двухрядными швами. Декомпрессия кишки осуществляется через назогастральный зонд. В конце операции устанавливаются дренажи в малый таз и подпечёночное пространство.
При обширном разрушении этого отдела кишки, выраженном воспалительном процессе выполняется резекция поражённой части кишки. Дистальный конец заглушается наглухо. Накладывается гастроэнтероанастомоз на короткой петле или по Ру.
Повреждения забрюшинной части 12перстной кишки, (нисходящий, нижнегоризонтальный, восходящий отделы (D2-D4)):
I. Свежие раны и разрывы кишки размером до половины диаметра кишки, (до 12 часов)
1. Рана кишки после экономного иссечения, ушивается.
2. Для декомпрессии в 12перстную кишку вводится назогастральный зонд.
3. Через контрапертурный разрез дренируется забрюшинная клетчатка.
4. Дренируется брюшная полость: малый таз и правое поддиафрагмальное пространство.
П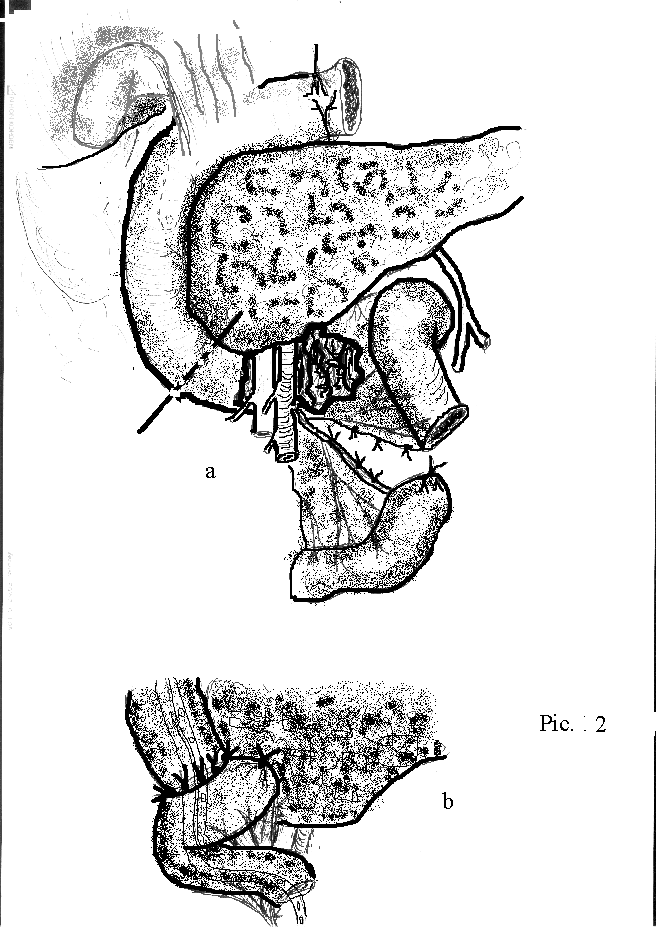 ри
повреждении на уровне D3-D4
при невозможности ушить разрыв
производится резекция указанных отделов
с формированием дуодено-еюноанастомоза
(рис.).
ри
повреждении на уровне D3-D4
при невозможности ушить разрыв
производится резекция указанных отделов
с формированием дуодено-еюноанастомоза
(рис.).
II. Свежие раны и разрывы более половины диаметра кишки (до 12часов).
1. Ушивание раны, после экономного иссечения, двухрядными швами или производится дуодено-дуоденоанастомоз.
2.12 перстная кишка выключается из пассажа пищи, (способы выключения описаны ниже)
3. Дренируется брюшная полость и забрюшинная клетчатка.
III. Раны и разрывы 12 перстной кишки со сроком давности более 12 часов.
1. После экономного иссечения рана ушивается однорядным швом. При полном пересечении кишки накладывается дуодено-дуоденоанастомоз.
2. Дренирование забрюшинной клетчатки: через контрапертурный разрез вводится сигарный дренаж.
3. Дренирование брюшной полости.
5. Декомпрессия duodenum назогастродуоденальным зондом.
При огнестрельных ранениях 12 перстной кишки рана более широко иссекается, ушивается однорядным (лучше узловым) швом или накладывается анастомоз.
При размозжении 12-перстной кишки и невозможности ее ушивания производится: кишка отсекается от желудка с ушиванием обоих концов. Накладывается гастроэнтероанастомоз. В рану 12-перстной кишки вшивается дренажная трубка для постоянной аспирации дуоденального содержимого (дуоденостома). Тщательно дренируется брюшная полость и забрюшинная клетчатка.
Повреждения тонкой кишки
Клиника. Зависит от характера повреждения, давности травмы, сочетанием с повреждениями других органов.
При полном разрыве тонкой кишки развивается клиника перитонита: сильные боли в животе, тошнота, рвота, напряжение мышц брюшной стенки, симптомы раздражения брюшины, тахикардия, сухой язык, признаки интоксикации. При одновременном повреждении брыжейки кишки на эту клинику наслаиваются признаки внутреннего кровотечения и гемоперитонеума.
При ранениях тонкой кишки клиника — менее яркая. В первые часы с момента травмы на фоне раны брюшной стенки отмечаются боли в месте ранения, умеренное напряжение мышц. При наличии повреждения брыжейки развивается картина гемоперитонеума и внутреннего кровотечения. Через 8-10 часов развивается клиника перитонита.
Диагностика. При открытых повреждениях показанием к операции служит проникающий характер раны. Наличие повреждения тонкой кишки выявляется только во время операции. До операции диагноз ранения тонкой кишки можно поставить только в 2 случаях: при наличие раны эвентерированной кишки, при отхождении через рану брюшной стенки кишечного содержимого.
При закрытых повреждениях диагностика включает в себя:1. Клинику.2Лабораторные данные.3. Рентгенодиагностика. Определяется наличие свободного газа в брюшной полости.4. Лапароцентез с шарящим катетером. При повреждении тонкой кишки по катетеру выделится кровь, мутный выпот или кишечное содержимое.5. Лапароскопия.
Лечение. Доступ — среднесрединная лапаротомия.
Особенности ревизии тонкой кишки:1. Ревизия начинается от связки Трейца. Последовательно осматриваются все петли тонкой кишки. Осмотренные петли сразу же погружаются в брюшную полость.
2. Обнаруженные повреждения кишки обёртывают марлевой салфеткой и оставляют до окончания ревизии.
3. Особенно тщательно следует осмотреть брыжеечный край кишки, где под гематомой может быть скрыта рана.
4. Большие субсерозные гематомы нужно вскрыть и осмотреть в этом месте стенку кишки.
5. При наличие кровотечения из поврежденной брыжейки тонкой кишки, следует вначале остановить кровотечение и уже, затем продолжить ревизию.
Оперативная тактика. Все раны и разрывы тонкой кишки, независимо от времени, прошедшего с момента травмы и наличия перитонита, после экономного иссечения краёв, ушиваются. На рану кишки накладываются узловые швы атравматичными иглами в поперечном направлении. После рассечения и ревизии субсерозной гематомы на стенку кишки накладываются серо-серозные швы. Подобным образом ушиваются раны серозно-мышечной оболочки.
Показания к резекции тонкой кишки:
1. Наличие множественных ран, расположенных близко друг от друга на ограниченном участке кишки.
2. Обширные разрывы и размозжения кишки.
3. Отрыв кишки от брыжейки с нарушением кишечного кровоснабжения.
4. Повреждения брыжейки тонкой кишки на большом протяжении (более 6-7 см.). После резекции участка кишки накладывается межкишечный анастомоз конец в конец или бок в бок. При перитоните наиболее безопаснее сформировать анастомоз бок в бок.
Повреждения ободочной кишки
Чаще всего встречаются открытые повреждения ободочной кишки. Закрытые повреждения встречаются реже. Разрыву толстой кишки способствует переполнение её каловыми массами и газом. Чаще при закрытых повреждениях повреждается брыжейка толстой кишки.
Классификация: общая для всех полых органов. (Смотри выше). Кроме этого все травмы ободочной кишки делятся на 3 группы:1. Повреждения внутрибрюшинных отелов ободочной кишки.2. Повреждения внебрюшинных отделов. 3. Повреждение внутрибрюшинных и внебрюшинных отделов.
Диагностика.1. Клиника.2. Обзорная рентгенография (скопия) брюшной полости: выявляется газ под куполом диафрагмы. 3. Лапароцентез: получаем кровь или кишечное содержимое с колибациллярным запахом. 4. Лапароскопия.5. Колоноскопия.6. Ирригоскопия.7. Первичная хирургическая обработка раны.
Большие трудности составляет диагностика повреждений внебрюшинных отделов ободочной кишки, возникающих при ранениях поясничной и боковых областей живота. При п. х. о. очень трудно выявить не только рану задней стенки ободочной кишки, но и проследить весь ход раневого канала.
Диагностика ранений внебрюшинного отдела ободочной кишки. При глубоких ранах поясничной области первичная хирургическая обработка проводится под наркозом, с широким рассечением раны и ревизией забрюшинного пространства. При невозможности проследить весь ход раневого канала производится лапароцентез с шарящим катетером. Если имеется сквозное ранение стенки кишки получаем кровь. При лапароскопии можно осмотреть участок ободочной кишки в проекции раны и выявить место повреждения. Самым простым и точным методом является вульнерография: при повреждении стенки ободочной кишки она контрастируется. Ирригоскопия: опредялется затёк бария в забрюшинной клетчатке и выделение бария через рану брюшной стенки. При осмотре диагноз можно поставить только при выделении газов и каловых масс из раны брюшной стенки.
Оперативная тактика.
1. Все свежие раны ободочной кишки, после экономного иссечения, ушиваются однорядным швом. При ушивании любого отдела ободочной кишки следует адекватно оценить кровоснабжение этого сегмента кишки. При малейшем сомнении в нормальном кровоснабжении кишки, производится резекция изменённого участка. Особое внимание следует уделить ранам брыжеечного края кишки. Не следует широко мобилизовать стенку кишки вокруг раны. Необходимо выделить на брыжеечном крае участок достаточный для наложения однорядного шва. При ушивании раны следует не захватить в шов кровеносные сосуды брыжейки. Недостаточная мобилизация стенки приводит к сшиванию неоднородных тканей, что может привести к несостоятельности швов.
2. Раны толстой кишки со сроком давности более 12 часов с явлениями перитонита.
После иссечения раны ушиваются. Учитывая наличие перитонита и высокую вероятность несостоятельности швов, следует обезопасить больного от развития осложнений. Ушитый участок кишки по возможности экстраперитонизируется (помещается внебрюшинно). Через контрапертурный разрез в боковой области живота. к стенке кишки подводится трубчатый дренаж. Этот способ применим при травме нисходящей, восходящей и сигмовидной кишки. При ранах поперечно-ободочной кишки — ушитый участок выводится под кожу, с подведением к нему дренажа. При невозможности выполнить данный вид операции, ушитая рана ободочной кишки выводится на брюшную стенку. Если не удается вывести ушитую рану кишки на брюшную стенку, накладывается проксимальная колостома. Для декомпрессии толстой кишки может быть использован любой отдел толстой кишки, кроме слепой. Мы категорически выступаем против цекостомы. Вслелдствие анатомического расположения слепой кишки, цекостома не разгружает толстую кишку. Основная часть кишечного содержимого поступает в дистальные отделы, минуя цекостому. При необходимой мобилизации, любой отдел ободочной кишки может быть выведен на переднюю брюшную стенку. Хорошая разгрузка достигается при двуствольной колостоме (илеостоме) с полным разобщением кишки, или хорошей шпоре.
3. При повреждении толстой кишки с давностью несколько суток и клиникой разлитого перитонита.
В этой ситуации ушитая рана ободочной кишки выводится на переднюю брюшную стенку или накладывается проксимальная колостома. После санации. брюшная полость дренируется по правилам перитонита. При выполнении резекции ободочной кишки в этих условиях: оба конца выводятся на брюшную стенку в виде двуствольной колостомы, или выполняется операция типа Гартмана.
Показания к резекции ободочной кишки.
1. Огнестрельные раны ободочной кишки с выраженным разрушением стенки кишки.
2. Множественные дробовые раны на ограниченном участке кишки.
3. Повреждение брыжейки ободочной кишки с нарушением питания стенки кишки. 4. Отрыв кишки от брыжейки.
В отличии от тонкой кишки, дефект брыжейки толстой кишки более 4см. может вызвать нарушение питания кишечной стенки, с последующей гангреной кишки.
Повреждения прямой кишки.
Причинами повреждения прямой кишки являются: огнестрельные и ножевые раны промежности и ягодичных областей, перелом костей таза, ятрогенные повреждения, повреждения инородными телами.
Классификация.
Мы применяем видоизмененную классификацию А. М. Аминева (1965г.)
I. По характеру повреждения.
1. Открытые.2. Закрытые.
II. По этиологии: 1. Повреждения прямой кишки при ранениях промежности и ягодичной областей, брюшной стенки.
2. Повреждения прямой кишки, нанесенное острым твердым предметом — по типу "падения на кол"
3. Повреждения при медицинских манипуляциях (очистительные клизмы. ректороманоскопия, термометрия, удаление полипов.)
4. Повредения при переломах костей таза.
5. Повредения при операциях на соседних органах.
6Разрывы прямой кишки от воздействия сжатым воздухом.
7Разрыв прямой кишки при половых сношениях.
8. Повреждения прямой кишки инородными телами.
9. Спонтанные разрывы прямой кишки.
10. Разрывы прямой кишки во время родов.
III. По отношению к брюшине.
1. Внутрибрюшинные. а) простые. б) с повреждением соседних органов. 2. Внебрюшинные. а) простые. б) с повреждением окружающих органов. в) с повреждением сфинктерного аппарата.
IV. По глубине повреждения.
1. Повреждения слизистой оболочки прямой кишки с подслизистой гематомой. 2. Повреждение всех слоев прямой кишки.
Клиника.
Зависит от локализации повреждения. При повреждении внутрибрюшного отдела прямой кишки быстро развивается клиника перитонита. При полных внебрюшинных разрывах прямой кишки развивается клиника тазовой флегмоны. При повреждених прямой кишки, вследствие перелома костей таза, преобладает клиника травматического шока, которая затушевывает признаки разрыва кишки . Основные признаки повреждения прямой кишки:
1. Боль. Может локализоваться в низу живота, заднем проходе, промежности, крестце.
2. Ведущим признаком является выделение крови из заднего прохода. Кровотечения из прямой кишки всегда очень обильные, особенно при повреждениях внебрюшинного отдела.
3. Имеются постоянные позывы на дефекацию.
4. Выделение кала и газов из ран промежности и ягодичной области.
5. При повреждении сфинктера- имеется недержание кала и газов
Диагностика.
1. Выяснение обстоятельств травмы.
2. Клиника.
3. Пальцевое исследование прямой кишки. Определяется рана или дефект стенки кишки, кровь в просвете кишки, инородные тела, величина тонуса сфинктера. Выявляются инфильтраты и нависания кармана Дугласа, болезненность брюшины.
4. Ректороманоскопия. Но при этом следует очень осторожно нагнетать воздух в просвет кишки.
5 Рентгеноскопия или графия брюшной полости, костей таза. Определяется газ под куполом диафрагмы. Контрастное исследование прямой кишки.
6 Лапароцентез.
7. Лапароскопия..
8. Первичная хирургическая обработка раны. По показаниям — вульнерография.
Лечение
1. Внутрибрюшные повреждения.
Все раны и разрывы прямой кишки ушиваются двухрядными швами. Обязательное условие-выключение прямой кишки из пассажа. Для этой цели накладывается двуствольная сигмостома с хорошей шпорой. Операция заканчивается дренированием брюшной полости.
При огнестрельных ранениях, размозжении стенки кишки — производится резекция кишки. Дистальный конец ушивается наглухо, а проксимальный выводится на брюшную стенку в виде одноствольной колостомы.(операция типа Гартмана).
2. Повреждения внебрюшинной части прямой кишки.
А. Повреждения с сроком давности не более суток.(без гнойных осложнений)
Производится ушивание раны прямой кишки. Ушивать рану прямой кишки удобнее со стороны её просвета. Операция производится под интубационным наркозом в положении для геморроидэктомии. С помощью ректального зеркала делается хорошая дивульсия ануса. При хорошем расслаблении можно ушить рану прямой кишки на расстоянии до 12см от края ануса.
Достаточно ушить рану однорядными узловыми швами через все слои. Этим достигается и гемостатический эффект, учитывая обильное кровотечение из ран прямой кишки.. Из просвета прямой кишки удаляется вся кровь.
Важный этап операции — дренирование тазовой клетчатки. Делается полуовальный разрез в перианальной области на стороне повреждения. Вскрывается ишиоректальная клетчатка и к поврежденной стенке подводится сигарный дренаж. При повреждении прямой кишки выше диафрагмы таза- тупо расслаивается m. levator ani, и дренируется тазово-прямокишечная клетчатка на стороне повреждения. При повреждении задней стенки кишки — рассекается прямокишечно-копчиковая связка и вскрывается позадипрямокишечное пространство.
Операция завершается формированием двуствольной сигмостомы из мини доступа.
Повреждения прямой кишки с давностью более 1 суток:
В этой ситуации развиваются гнойные осложнения в виде тазовых флегмон и парапроктитов.
а) выключается прямая кишка из пассажа- двуствольная сигмостома.
б) вскрываются и дренируются абсцессы и флегмоны параректальной клетчатки
в) по возможности ушивается стенка прямой кишки. Если стенку ушить не удается — операция заключается только в дренировании клетчатки. Из не ушитой раны кишки в последующем возникают тяжёлые эрозивные кровотечения. Поэтому желательно наложить хотя бы гемостатические швы.
Повреждения печени
Классификация (по В. С. Шапкину и Ж. А. Гриненко 1977г.)
А. Закрытые повреждения печени.
. По механизму травмы: непосредственный удар, падение с высоты, сдавление между двумя предметами, дорожная травма, разрывы при напряжении брюшного пресса, разрывы патологически измененной ткани печени, разрывы новорождённых.
По виду повреждения: 1. разрывы печени с повреждением капсулы (чрезкапсульные разрывы печени).2. субкапсулярные гематомы.3. центральные разрывы и гематомы печени. 4. повреждение внепеченочных желчных протоков и сосудов печени.
По степени повреждения: 1. Поверхностные трещины и разрывы глубиной до 2 см. 2. разрывы глубиной от 2-3 см до половины толщи органа.3. Разрывы более половины толщи органа и сквозные разрывы.4. Размозжение печени или расчленение на отдельные фрагменты.
По локализации повреждения: указывается доля и сегмент печени.
По характеру повреждения желчных внутрипеченочных протоков и сосудов.
Б. Открытые повреждения печени.(ранения печени)
Колото-резанные.
Огнестрельные пулевые, дробовые, осколочные
В. Сочетание тупой травмы с ранениями печени.
Диагностика
1. Выяснение обстоятельств травмы. 2. Клиника.3. Лабораторная диагностика: снижение гемоглобина и эритроцитов крови, повышение лейкоцитоза, повышение билирубина, трансаминаз.4. УЗИ брюшной полости: выявляется свободная жидкость в отлогих местах и непосредственно повреждение печени. 5. Лапароцентез с шарящим катетером: получаем кровь или желчь из брюшной полости. 6. Компьютерная томография печени: определяет характер повреждения, глубину раны печени, повреждения внутрипечёночных желчных протоков и сосудов.
7. Лапароскопия.8. Холангиография.: выявляет повреждение желчных протоков. 9. Немая зона радиоактивности на сканограмме при разрывах и гематомах печени.10 Ангиография.
Этапы хирургического лечения:
1. Адекватный доступ.2. Оптимальная экспозиция.3. Полный гемостаз.4. Удаление нежизнеспособных тканей.5. Устранение желчеистечения.6. Адекватное дренирование.
Доступы: операция производится у большей части больных из срединного доступа. Производится верхнесрединная лапаротомия с обходом пупка слева.
При повреждении дорсальных отделов правой доли печени, массивном разрушении правой доли, повреждении полой и печеночных вен, прибегают к торакофренолапаротомии (разрез Куино и Петровского — Почечуева.)
Оперативная тактика
1. При небольших, некровоточащих ранах печени глубиной до 1-2 см., поверхностных трещинах. надрывах — обработка и ушивание не производится. Из брюшной полости удаляется жидкая кровь, сгустки. На рану печени укладывается гемостатическая губка или прядь сальника. Сальник фиксируется к диафрагме, связкам печени, париетальной брюшине. В подпеченочное пространство вводится силиконовая дренажная трубка диаметром 1-1,5см.
2. Неглубокие раны и разрывы печени, не проецирующиеся на сегментарные желчные ходы и сосуды и без повреждения их.
Производится ушивание ран блоковидными, П-образными, 8-образными швами.. При необходимости ушивание раны дополняется пластикой сальником Швы накладываются из не рассасывающегося материала на круглой игле. Шов печени необходимо накладывать таким образом, чтобы он захватывал всю глубину раны, не оставляя свободного пространства. Если рану печени полностью ушить не удается, на дно укладывают прядь сальника. Если рана расположена рядом с круглой или серповидной связкой, связки мобилизуют и покрывают ими рану.
3. Глубокие раны и разрывы печени без повреждения магистральных сосудов и желчных протоков.
Основная задача хирурга при ушивании глубоких ран печени не прошить долевые или сегментарные сосуды и желчные протоки. В этом случае рану ушивают не на всю глубину. Самый простой способ тампонировать раневой канал прядью сальника и сблизить рану печени поверхностными швами глубиной до 3-4см. Если это не удаётся то к дну раны подводят дренажную трубку. Дренаж удаляют на 5-6 сутки при отсутствии поступления желчи.
4. Глубокие раны и разрывы печени с повреждением сегментарных сосудов и желчных протоков с целью временной остановки кровотечения и обнаружения повреждённых сосудов в глубине раны, производят пережатие печёночно-двенадцатиперстной связки. Время пережатия связки не более 20 минут. Если сдавление связки не приводит к остановке кровотечения, — это означает, что повреждены печеночные вены или позадипечёночный отдел нижней полой вены. С целью выявления поврежденных желчных протоков, пунктируют гепатохоледох и вводят в него метиленовый синий. Для доступа к дну раны необходимо её расширить. Паренхима печени разъединяется по ходу портальных щелей. Из раны удаляют сгустки крови, нежизнеспособные ткани , инородные тела. При выявлении повреждения кровеносных сосудов и желчных протоков производится их перевязка. После достижения гемостаза и ликвидации желчеистечения производится ушивание раны печени. НА дно раны укладывается сальник и производится сближение краев швами (гепатизация) Такая рана может быть ушита на дренаже. Рана печени может оставаться открытой, но с обязательным подведением к ней дренажа. При полноценной обработке раны и хорошем гемостазе не следует опасаться открытой раны печени.
При разрывах с повреждением ткани печени, огнестрельных ранения производится резекция — обработка печени по Шапкину. При этом удаляются все нежизнеспособные участки печени и инородные тела. Удаление частично отелившегося фрагмента печени начинается из глубины разрыва. Мостик тканей, соединяющий его с органом ликвидируем тупо, выделяя и перевязывая кровеносные сосуды и желчные протоки. Образовавшаяся рана закрывается по вышеперечисленным правилам. При сомнении в жизнеспособности поврежденного участка печени, следует его удалить.
5. Повреждение труднодоступных отделов печени.(задняя и дорсальная часть правой доли).
Если разрыв локализуется на диафрагмальной поверхности с переходом на заднюю, но не доходит до нижнего края выполняется верхняя гепатопексия по Киари-Алферову. Печень придавливают к диафрагме. Узловыми швами подшивают передний край печени к париетальной брюшине на всём протяжении, начиная от круглой и серповидной связки до правой треугольной связки. Цель гепатопексии — создать замкнутое, изолированное поддиафрагмальное пространство. В это пространство подводится дренажная трубка и укладывается на задний скат печени.
При разрывах, расположенных на задненижней поверхности печени, задних сквозных разрывах выполняется нижняя гепатопексия по Шапкину. Принцип вмешательства сводится к тому, что рану или разрыв в дорсальной части нижней поверхности печени прикрывают листком париетальной брюшины, который подшивают к заднему краю печени. Раневая поверхность изолируется от всей брюшной полости. В изолированную полость, к ране вводится дренажная трубка.
6. Размозжение печени, разрывы, с образованием отдельных фрагментов, рвано-ушибленные раны с большой зоной повреждения, травма долевых и сегментарных сосудов показания к резекции печени. Чаще всего выполняются атипичные резекции печени. Объём резекции зависит от размеров повреждения. Это может быть удаление фрагментов печени, сегмента, нескольких сегментов., целой доли.
После удаления нежизнеспособных тканей раневую поверхность печени укрывают сальником. К месту резекции подводится сигарный дренаж и силиконовая трубка. Операция завешается холецистостомией или дренированием холедоха.
7. Повреждение патологически измененной ткани печени.(Повреждение печени у больных, страдающих гепатитом, циррозом печени)
Повреждения поджелудочной железы.
Механизм повреждения: 1. прямой сильный удар в эпигастральную область. 2. сдавление живота в переднезаднем направлении. 3. Падение с высоты. 4. Ранения колото резанные и огнестрельные.
Классификация (видоизменённая Ю. М. Лубенского)
По глубине и тяжести повреждения: 1. Ушиб поджелудочной железы. 2. Поверхностные раны и разрывы железы. 3. Глубокие раны и разрывы железы без повреждения панкреатического протока. 4. Глубокие раны и разрывы с повреждением панкреатического протока. 5Полный поперечный разрыв или полное пересечение железы с диастазом фрагментов.6. Размозжение железы.
По локализации: головка, перешеек, тело, хвост.
Американские хирурги используют 4 степени повреждений поджелудочной железы (классификация Booth F. V., Flint L. M. 1990г)
1. Ушиб железы.
2. Разрыв до 50 % диаметра железы, без повреждения панкреатического протока.
3. Повреждения панкреатического протока.
4. Обширные повреждения с размозжением ткани железы и повреждением панкреатического протока.
Лабораторная диагностика.
1. Общий анализ крови. Красная кровь не страдает, имеется лейкоцитоз со сдвигом формулы влево.
2 Повышается диастаза мочи.
3. Повышается количество амилазы крови.
УЗИ брюшной полости.
Определяются изменения в ткани поджелудочной железы, гематома забрюшинной клетчатки, выпот в брюшной полости.
Лапароцентез с шарящим катетером
Даже в первые часы с момента травмы получаем геморрагический выпот или кровь. При оставлении пролонгированного катетера — выделяется геморрагический выпот. При анализе этого выпота определяется высокое содержание амилазы.
Лапароскопия.
Виден выпот в брюшной полости, забрюшинная гематома, очаги жирового некроза на сальнике, париетальной брюшине. Выполняется оментобурсоскопия: производится осмотр железы, места травмы, выявляется характер повреждения.
Компьютерная томография.
Один из самых точных методов в диагностике повреждений поджелудочной железы. Определяется характер и степень повреждения железы, под капсульные разрывы, повреждения других органов.
Лечение
При наличие картины перитонита проводится предоперационная подготовка в течение 2 часов.
Обезболивание: эндотрахеальный наркоз.
Доступ: срединная лапаротомия.
При ревизии брюшной полости выявляется геморрагический выпот или кровь со сгустками. Если операция начата через 6-8 часов с момента травмы, то обнаруживаются очаги стеатонекроза. Это патогномоничный признак повреждения поджелудочной железы. Часто выявляется гематома в брыжейке поперечно-ободочной кишки, желудочно-ободочной связке, малом сальнике.
Для осмотра поджелудочной железы рассекается желудочно-ободочная связка и вскрывается сальниковая сумка. Осматривается поджелудочная железа и выявляется место повреждения.
Главная задача хирурга при повреждении поджелудочной железы: 1. Остановить кровотечение из ткани железы. 2. Адекватно дренировать сальниковую сумку, брюшную полость, забрюшинную клетчатку.
Оперативная тактика определяется характером повреждения железы, состоянием больного.
Повреждения головки поджелудочной железы
Это самые тяжелые из всех повреждений железы. Тактика должна быть индивидуальна.
1. Тщательный гемостаз места повреждения железы с перевязкой и прошиванием сосудов.
2. Дренирование сальниковой сумки через бурсооментостому.
3. Дренирование забрюшинной клетчатки через контрапертурный разрез в провой боковой области живота.
4. Холецистостома или дренаж холедоха.
5. Дренирование брюшной полости.
Травма головки поджелудочной железы с одновременным повреждением 12 перстной кишки, холедоха:
1. Достижение гемостаза: прошиваются кровоточащие участки железы.
2. Ушивание или резекция 12 перстной кишки, с отключением её из пассажа пищи.
3. Дренирование холедоха или ушивание раны холедоха на дренаже.
4. Дренирование забрюшинной клетчатки.
5. Дренирование сальниковой сумки, через бурсооментостому.
6. Дренирование брюшной полости.
7. Энтенральное питание через назоинтестинальный зонд.
Огнестрельные раны поджелудочной железы.
Тактика определяется степенью разрушения поджелудочной железы.
А. При сквозных, небольших ранах:
1. гемостаз раны железы: прошивание и перевязка кровоточащих сосудов.
2 Удаление мертвых тканей, инородных тел и оторванных фрагментов железы.
3. Бурсооментостома с дренированием сальниковой сумки.
4 Дренирование забрюшинной клетчатки.
5 Холецистостома. или дренаж холедоха.
6. дренирование брюшной полости.
Б. Размозжение железы и разрывы её на отдельные фрагменты.
1. резекция участка поджелудочной железы.
2. Бурсооментостома с дренированием сальниковой сумки.
3. Дренирование забрюшинной клетчатки.
4. Дренирвание брюшной полости.
Повреждения селезенки
Причина: прямой удар в область левого подреберья, реберной дуги, уровня 8-12 рёбер слева, падение с высоты, сдавление между предметами. Реже раны в левом подреберье.
Предрасполагающие факторы: патологические процессы в селезенке, спленомегалия, полнокровие органа в момент травмы. В последнее время особенно много повреждений селезенки у наркоманов, вследствие выраженной спленомегалии.
Классификация. (С. И Банайтис и И. А. Криворотов)
А. Открытые повреждения селезенки.
Б. Закрытые повреждения.
Ушиб селезенки без повреждения капсулы и без образования подкапсульной гематомы.
Ушиб селезенки без повреждения капсулы, с наличием подкапсульной гематомы, выступающей на поверхность органа.
Ушибы и сотрясения селезенки с центральной гематомой и повреждении паренхимы без повреждения капсулы.
Разрыв капсулы с одиночной поверхностной трещиной паренхимы.
Единичные и множественные глубокие разрывы селезенки.
Размозжение селезенки и отрыв её от сосудистой ножки.
Кроме того различают: 1. Одномоментные разрывы селезенки. 2. Двухмоментный разрыв селезенки. Вначале образуется подкапсульная гематома. В дальнейшем при напряжении гематома разрывает капсулу и возникает кровотечение в брюшную полость. 3. Ложный двухмоментный разрыв. Одновременно разрывается капсула и паренхима селезенки. Разрыв прикрывается сгустком крови. В дальнейшем, при повышении артериального давления, сгусток крови отходит и возникает кровотечение. Интервал между моментами может быть от нескольких часов, до нескольких суток.
Диагностика.
Клиника повреждений селезенки складывается из болевого и геморрагического синдромов, выраженность которых зависит от характера травмы.
Диагностика.
При открытых повреждениях — показанием к операции является проникающий характер ранения. При закрытой травме диагностика включает в себя:
1. Выяснение обстоятельств травмы.
2. Наличие переломов 7-11 рёбер слева.
3. Клиника.
4Лабораторная диагностика: общий анализ крови (анемия и лейкоцитоз), мочи, биохимия.
5. УЗИ брюшной полости:: выявляется наличие свободной жидкости в брюшной полости, подкапсульные гематомы, разрывы паренхимы органа.
6. Лапароцентез с шарящим катетером: обнаружение крови или патологической жидкости.
7. Компьютерная томография: позволяет выявить прямые и косвенные признаки повреждения селезенки (гематомы, разрывы и размозжения органа, гемоперитонеум).
8. Ультрасонография.
Главная задача хирурга — распознать синдром внутрибрюшинного кровотечения. Топическая диагностика имеет менее важное значение.
Лечение.
Доступ - срединная лапаротомия
Собираем кровь на реинфузию. После этого приступаем к ревизии органов брюшной полости. Характерным признаком повреждения селезенки является наличие большого сгустка крови в левом поддиафрагмальном пространстве.
Для проведения полноценной ревизии селезенки ассистент оттягивает крючком брюшную стенку влево Хирург аккуратно укладывает кисть руки за селезенку, после чего выводит орган кпереди и вправо. Поддиафрагмальное пространство освобождается от крови и сгустков и тампонируется салфеткой. Пальпаторно удается определить разрывы селезенки. Окончательная диагностика производится под контролем глаза хирурга. после удаления всех сгустков крови. Если селезенку невозможно вывести из-за спаечного процесса-производтся рассечение спаек и мобилизация селезенки с пересечением диафрагмально-ободочной и диафрагмально-селезеночной связок.
При массивном кровотечении из селезеночной артерии вначале необходимо пережать ворота селезенки, а уже затем производить ревизию.
Виды операций при травме селезенки.
1. Тампонирование разрывов капсулы.
2. Ушивание раны селезенки.
3. Резекция селезенки.
4. Спленэктомия с экстраперитонеальной аутоспленотрансплантацией.
Тампонирование показано при разрывах капсулы и поверхностных дефектах паренхимы селезенки, при остановившемся к моменту операции кровотечению (если удаление сгустков не привело к возобновлению кровотечения.) Используется марелево-перчаточный тампон.
Травма почек


Алгоритм принятия решения при повреждении почки
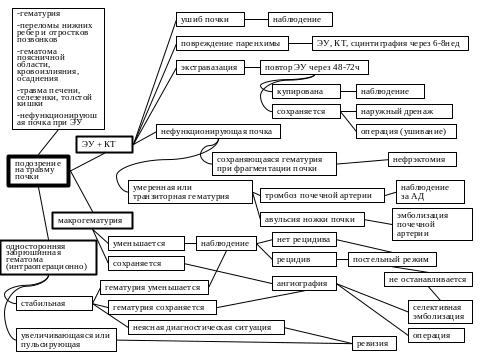
Рекомендуемая литература
Вагнер Е. А. Грудобрюшные ранения. М.: 1992.
Вагнер Е. А. Хирургия повреждений груди. М1981.
Диагностика и лечение ранений, ред. Шапошников Ю. Г. М.- 1984.
Козлов И. З., Горшков С. З., Волков В. С. Повреждения живота. — М.: Медицина, 1988. — 224 с.
Колесов А. П., Бисенков Л. Н. Хирургическое лечение огнестрельных повреждений груди. -Л., 1986.
Цыбырне К. А., Мильков Б. О., Кулачек Ф. Г. Неотложная торакальная хирургия. Кишинев, 1989
Инфузионная терапия и парентеральное питание в хирургии инфузионная терапия
Инфузионной терапией называется лечебный метод, заключающийся в парентеральном введении в организм больного необходимых компонентов жизнедеятельности, распределенных в водной фазе.
Целью, достигаемой применением инфузионной терапии, является поддержание функций организма, определяющийся гидропонным обменом, в пределах, необходимых для переживания экстремальных ситуаций без крайнего напряжения компенсаторных механизмов.
Три основные задачи инфузионной терапии:
Обеспечение текущих потерь из внутриклеточного и интерстициального пространства.
Возмещение предстоящих потерь вне- и внутриклеточной жидкости.
Возмещение предшествующих потерь ( возмещение и поддержание объема и состава жидкостных секторов организма).
Текущая суточная потребность в норме:
500 мл 10% декстрозы +20 ммоль хлорида калия за 12 часов и 1000 мл 5% Декстрозы + 20 ммоль хлорида калия за 12 последующих часов в 0,45 или 0,9% солевом растворе.
Абсолютная минимальная потребность в жидкости: 500 мл минимальный суточный диурез + 600 мл контролируемых потерь - 300 мл эндогенной продукции воды = около 800 мл/сут.
Абсолютная минимальная потребность: НАТРИЯ - 75 ммоль, КАЛИЯ - 40 моль. ГЛЮКОЗЫ - 100 г (для предотвращения кетоацидоза и белкового катаболизма).
Расчет необходимого количества консервированной крови:
ЦНb (г) = 0,07(0,065) х Масса(кг) х Нb (г/л)
0,07 для мужчин; 0,065 – для женщин.
Кровь (мл) = (600(400) – ЦНb) х 10
600 – если нет уверенности в том что кровотечение остановлено;
400 – после остановки кровотечения (операция, перевязка сосуда).
Эр масса (мл) = (600(400) – ЦНb) х 5;
5% NaHCO3 (ml) = Кровь (мл)/2.
Реополиглюкин (мл)= Кровь (мл)/5.
Возмещение объема циркулирющего альбумина (ОЦА):
Плазма (мл) = (200 – 0,05 х Масса,кг х Общ.белок плазмы,г/л) х 16;
10% альбумин, (мл) = (200 – 0,05 х Масса,кг х Общ.белок плазмы,г/л) х 10.
Гипокальциемия – ПРИЧИНА - гипопаратиреоз, часто послеоперационный.
Респираторный алкалоз – ПРИЧИНА - печеночная недостаточность, грамотрицательный сепсис.
Респираторный ацидоз – ПРЧИНА - фармакологический - остаточное действие анестетиков, клинические проявления: тремор пальцев рук, головная боль с отеком зрительного нерва, понижение чувствительности и кома.
Дополнительные показания к инфузионной терапии:
- Изменение свойств крови :улучшение реологии и микроциркуляции (нормоволемическая гемодилюция, антиагреганты – реополиглюкин, пентоксифиллин); прокоагулянтная терапия (аминокапроновая кислота);
- Дезинтоксикационная терапия (гемодез, форсированный диурез, гиперволемическая гемодилюция, электрохимическая детоксикация крови);
- Обеспечение длительного и равномерного введения медикментозных репаратов (например, лечение сердечной недостаточности с введением рибоксина, аспаркама и т.д.);
- Парентеральное питание.
Особенности водноэлектролитного обмена, которые необходимо учитывать при проведении инфузионной терапии у лиц пожилого и старчекого возраста:
Хроническая гиповолемия, усиливающаяся в период иммобилизации(целесообразно вводить 500 мл объемзамещащего раствора (декстрана) каждые 3 дня при длительной иммобилизации).
Легкая физиологическая гипонатриемия (125-130 ммоль/л).
Максимальная концентрационная функция почек ограничена, что требует увеличения ежедневного потребления воды на 500 мл чтобы вывести выпадающие соли при недостаточной концентрационной способности.
При необходимости в большой инфузионной терапии:
- снижение общего периферического сопротивленя (новокаин, дроперидол, ганглиоблокаторы)
- снижение нагрузки на миокард (диуретики, обзидан или изоптин)
- объем инфузии 30-15 мл/кг
- скорость инфузии 60-30 кап/мин
- предпочтительны внутрипортальный и внутриартериальный пути инфузии.
Парентеральное питание
В 1960г Dudrick обосновал положение о полном парентеральном питании, которое широко использовалось по многих областях медицины и прежде всего в хирургии Без преувеличения можно сказать, что парентеральное питание (ПП) позволило сохранить жизнь миллионам людей, оказавшихся в ситуациях, при которых нарушено естественное питание через рот. Под ПП понимают введение питательных веществ внутривенным путем, минуя процесс пищеварения в ЖК'Г Так как питательные вещества попадают непосредственно в кровь, то для ПП используют легко усваиваемые элементов пищевых продуктов в определенных количествах и соотношениях. Особенно трудную проблему представляет питательная поддержка больных, находящихся в тяжелом стрессовом состоянии при наличии нарушений питания.
Основной принцип, заложенный в основу ПП, заключается в обеспечении организма энергией и белком, что позволяет противостоять таким факторам агрессии, как инфекция, ожоги, травма и хирургическое вмешательство.
В настоящее время выделяют полное и частичное ПП.
При полном питании в организм человека внутривенно вводятся все ингредиенты, обеспечивающие жизнедеятельность:
-пластические материалы,
-средства энергетического обеспечения,
-вода,
-электролиты,
-микроэлементы.
-витамины,
-стимуляторы усвоения средств ПП
При частичном ограничиваются восполнением отдельных ингредиентов. Нередко в клинической практике ПП комбинируют с зондовым питанием.
Как полное так и частичное ПП является ответственной процедурой, безопасность и эффективное™ которой в значительной мере зависят от подготовки и компетентности персонала.
Суточная потеря азота у взрослых в различных ситуациях
Ситуация |
Потеря азота |
|
|
г/сутки |
% |
Норма |
11 |
100 |
Малое хирургическое вмешательство |
12-14 |
110-125 |
Тяжелое состояние |
14-17 |
125-155 |
Множественная травма |
15-25 |
135-230 |
Повреждения головы |
20-30 |
180-270 |
Сепсис |
20-30 |
180-270 |
Тяжелые ожоги |
30-40 |
270-360 |
Потеря а юта приводит к уменьшению массы тела, т.к.
1 г азота=6.25 г белка (аминокислот)=25 г мышечной ткани
Недостаточность калорий и белка у больного перед плановой операцией увеличивает операционную смертность на 5% и количество осложнений на 25%.
Таблица 1. Степени тяжести недостаточности питания
Параметры |
Степень недостаточности питания |
||
Легкая (I) |
Средняя (II) |
Тяжелая (III) |
|
Альбумин плазмы, г/л |
35-30 |
30-25 |
< 25 |
Трансферин плазмы, г/л |
2-1,8 |
1,8-1,6 |
< 1,6 |
Антропометрия, % к норме |
90-80 |
80-70 |
< 70 |
Число лимфоцитов в крови в 1 мм3 |
1,8-1,5 |
1,5-0,9 |
< 0,9 |
Холинэстераза плазмы, мкмоль/л.ч. |
180-160 |
160-120 |
< 120 |
Энергетический баланс.
Энергетический баланс определяется полученной и затраченной энергией. Если полученная пациетом энергия равна затраченной, говорят о нулевом балансе. Отрицательный баланс возникает в том случае, если затраченная энергия больше полученной.
Потребность в пищевых веществах и энергии у больных в состоянии различной степени недостаточности питания в условиях парентерального питания (Wretlind, 1972)
Питательные вещества |
Потребность на 1 кг массы тела при различной степени недостаточности питания |
||
легкая |
среднетяжелая |
тяжелая |
|
Вода, мл |
40 |
50 |
85-100 |
Энергия, ккал |
30 |
35-40 |
50-60 |
Усвояемый белок (аминокислоты), г |
0,75 |
1,5-2 |
3-3,5 |
Жир (жировые эмульсии), г |
2 |
3 |
3-4 |
Глюкоза, г |
1-1,4 |
2-3 |
3-4 |
Натрий, ммоль |
1-1,4 |
2-3 |
3-4 |
Калий, ммоль |
0,7-0,9 |
2 |
3-4 |
Кальций, ммоль |
0,11 |
0,15 |
0,2 |
Методы определения потребности в энергии
Расчет по уравнению Харриса-Бенедикта – уравнение Харриса-Бенедикта позволяет быстро определить энергозатрату покоя (ЭЗП) или основной обмен (ккал/сут):
Мужчины |
ЭЗП=66,5+13,75 х масса(кг) +5,0 х рост(см) – 6,8 х возраст (годы) |
Женщины |
ЭЗП=66,5+9,6 х масса(кг) +1,8 х рост(см) – 4,7 х возраст (годы) |
Величина ЭЗП, определенная таким образом, составляет в среднем 25 ккал/сут.
Далее определяют фактор физической активности больного (ФФА), фактор метаболической активности (ФМА), основанный на клиническом статусе, и температурный фактор (ТФ).
Фактор физической активности - ФФА |
Фактор метаболической активности (ФМА) |
Температурный фактор (ТФ) |
1.1 – постельный режим 1.2 – полупостельный 1.3 – ходячий больной |
1.0-1.1 – избирательная хиурргия 1.1-1.3 – мноесттвенные переломы 1.2-1.6 – тяжелая инфекция (сепсис) 1.5-2.1 – обширная ожогавая травма |
1.1 – 38о С 1.2 – 39 град С 1.3 – 40 град С 1.4 - 41 гард С |
Суточная потребность в энергии конкретного больного (ПЭ) = ЭЗП х ФФА х ФМА х ТФ
1 грамм глюкозы ~ 4 ккал
1 грамм жира ~ 9 ккал
1000 мл 10% жировой эмульсии ~ 1010 ккал
1000 мл 20% жировой эмульсии ~ 2020 ккал
1000 мл 20% глюкозы ~ 800 ккал
1000 мл 30% глюкозы ~ 1200 ккал
1000 мл 40% глюкозы ~ 1600 ккал
100 мл 96% этилового спирта ~ 700 ккал (вводить в 5% концентрации на кристаллоидах с учетом противопоказаний (взаимодействие с метрагилом, печеночная недостаточность и др.).
Альвезин содержит 600 ккал (за счет многоатомного спирта), 40 г/л аминокислот; требует еще 800 ккал для полного усвоения содержащихся в нем аминокислот (~ 1000 мл 20% глюкозы).
Переливание 500 мл крови дает всего лишь 90 ккал и 18 г усвояемого белка.
250 мл нативной плазмы содержит ~12 г альбумина.
Показания к парентеральному питанию
Правило «7 дней или 7% потеря массы» - ПП показано если больной не мог есть 7 дней или при ежедневном взвешивании в стационаре потерял 7% своей массы.
Перед хирургическим вмешательством больным с нарушением функции ЖКТ, со злокачественными заболеваниями, особенно ЖКТ.
После операции во всех случаях когда требуется выключение естественного питания в течение 4-5 дней.
Сепсис, тяжелые механические травмы, ожоги (более 40% площади тела).
Артериопатии
Термин артериопатии объединяет группу заболеваний артериальной стенки, сопровождающихся развитием острой или хронической периферической циркуляторной гипоксии (артериальной недостаточности).
Причины артериопатий:
1. Поражения артериальной стенки
Атеросклероз
Аутоиммунная ангиопатия
Группа узелкового полиартериита (болезнь Кавасаки, синдром Когана, синдром Бехчета)
Группа гиперчувствительных ангиитов (смешанная криоглобулинемия, злокачественный артериит, артериит коллагеновых болезней: узелковый периартериит, дерматомиозит, системная склеродермия)
Группа гигантоклеточного артериита (артериит Такаяси, темпоральный артериит)
Эндокринная ангиопатия
Сахарный диабет
Облитерирующий эндартериит (обпитерирующий тромбангиит, болезнь Бюргера)
Сосудистые гипотонии (врожденные, приобретенные)
Врожденные дефекты артериальной стенки
Псевдоксантома эластичная
Синдром Эгерс-Данлоса
Синдром большой артерии
Синдром Марфана
Кистозная болезнь адвентиции
Кистозная болезнь медии
2. Поражения стенки сосуда вследствие травмы
Острая и тупая травма с тромбозом артерии
Ятрогенные повреждения (катетеризация сердца и сосудов, артериография)
Хронический травматический артериит
Хронический пострадиационный артериит
Аллергический синдром
3. Поражения стенки сосуда вследствие сдавления
Врожденные (фибромускулярная дисплазия)
Приобретенные - Нейроваскулярные синдромы сдавления верхних конечностей (передней лестничной мышцы, шейного ребра, костоклавикулярный, малой грудной мышцы, гиперабдукционный, "плечо-кисть")
4. Поражения вследствие внутрисосудистого фактора, метаболических нарушений
Дислипидемия
Гиперкоагуляция
Холодовая агглютинация
Истинная полицитемия
Азотемическая артериопатия
Гемодиализный шунт
Синдром гипервязкости
Миелопролиферативные расстройства
Миелома
Макроглобулинемия
Криоглобулинемия
Неоплазия
Доброкачественная моноклональная гаммопатия
Гомоцистеинемия
5. Поражения и дисфункция капилляров (ангиоригоз или трофоангионевроз)
Акроцианоз
Эритроцианоз
Акропарестезии
Ливедо
Эритромелалгия
Ишемический синдром Марторелла
Локальный гипертензивный синдром артерий нижних конечностей
Холодовой эритроцианоз (ознобления, или пернионы, холодовой нейроваскулит, траншейная стопа)
Болезнь Рейно
Болезнь Рейля
Вибрационная болезнь
Для обозначения хронической артериальной недостаточности сосудов конечностей используется множество терминов: «хроническая артериальная периферическая недостаточность (ХАПН)» – наиболее удачный, "васкулопатия", "ангиопатия", "артериопатия", "артериит", "ангиит", "вазоспазм", "ангиоригоз", "трофоангионевроз" и т.д.
Клиническая картина артериопатий характеризуется развитием ишемического синдрома. В его течении можно выделить две стадии:
функциональную (спастическую),
облитерирующую (органическую).
При спастической стадии заболевания больной ощущает онемение, зуд, парестезии, зябкость, беспричинную усталость и тяжесть в конечностях. Как правило, эти жалобы имеют преходящий характер, и пациенты к врачу не обращаются.
В стадии облитерации клинические симптомы стабилизируются. При ХАПН в этой стадии имеются типичные трофические поражения кожи (язвы) и ее придатков (исчезновение волосяных фолликулов, изменения ногтей). Пульсация на периферических артериях снижена или отсутствует. Выделяют 4 степени нарушений кровообращения при ХАПН в стадии облитерации:
I - функциональная компенсация;
II - декомпенсация при физической нагрузке (появление перемежающейся хромоты при ХАПН нижних конечностей);
III - декомпенсация покоя (появление болей в покое);
IV - деструктивная (некротическая, гангренозная).
Течение артериопатий бывает острым (злокачественным), подострым (чередующиеся обострения и ремиссии), хроническим (постепенно прогрессирующим).
Лечение
В основе лечения больных с артериопатиями лежит дифференцированный подход, учитывающий тяжесть артериальной недостаточности.
Большинство пациентов с этой патологией обращается за медицинской помощью при развитии функциональной компенсации на стадии органических изменений (облитерации).
На этой стадии лечение практически всех артериопатий (исключение - ХАПН магистральных сосудов, вызываемая атеросклерозом, аорто-артериитом, синдромом сдавления) - консервативное. Терапия заболевания при этой степени облитерации включает в себя основной этап - амбулаторный, и эпизодический - стационарный, а также санаторно-курортный. В комплекс медикаментозной терапии на амбулаторном этапе входят: сосудорасширяющие препараты, витамины группы В (В1, В6), никотиновая кислота, седативные препараты, транквилизаторы.
Из сосудорасширяющих препаратов используются:
ганглиоблокаторы (мидокалм, бупатол);
препараты, действующие на гладкую мускулатуру артерий (но-шпа, галидор, папаверин, вазодилан, баметол сульфат);
препараты, действующие на периферические холинореактивные системы (падутин, андекалин, ангиотрофин, депо-каллекреин , прискол, вазоластин).
Среди физиотерапевтических методов лечения ХАПН при начальных проявлениях стадии облитерации эффективны диатермия, диадинамические токи. Санаторно-курортное лечение может включать в себя бальнеотерапию (радоновые, сероводородные, нарзанные, хвойно-жемчужно-кислородные ванны), а также грязевые аппликации.
При II степени развития стадии облитерации в ходе медикаментозной терапии к вышеперечисленным лекарственным средствам добавляются
противовоспалительные, улучшающие трофику препараты (АТФ, фосфаден, солкосерил или актовегин, эскузан, индометацин, преднизолон);
антиоксиданты (витамин Е, пробукол);
средства, обладающие многокомпонентным действием (вазапростан, аспирин (100-300 мг), пентоксифиллин (трентал), вессел дуэ ф);
Энзимы (вобэнзим, флогензим);
многокомпонентные препараты (танакан, тиклопидин, ингибиторы синтеза холензим, секвестранты желчных кислот, ингибиторы ГМГ КоА редуктазы, фибраты, антагонисты кальция, препараты чеснока).
Профилактику инфекционных осложнений проводят назначением антибиотиков. Для внутривенных инфузий применяют реополиглюкин. Кроме того, используют фотогемотерапию (УФО крови, лазеротерапия), гемосорбцию, плазмаферез.
При III степени развития стадии облитерации (декомпенсация покоя) обязательны назначения кортикостероидов, дезагрегантов (аспирин, курантил), антикоагулянтов прямого и непрямого действия (гепарин, фенилин, фраксипарин, клексан, вессел дуэ ф), анальгетиков. Из сосудорасширяющих препаратов нужно применять только те, которые воздействуют на гладкую мускулатуру (но-шпа, галидор, никошпан). Проводятся артериальные, эпидуральные блокады, блокады вертебральных симпатических ганглиев.
Лечение деструктивных изменений на стадии облитерации включает внутриартериальные инфузии, хирургические вмешательства, дезинтоксикационную и антибактериальную терапию (длительность антибиотикотерапии должна составлять в среднем 10 недель, из них 4 недели с парентеральным способом введения). При назначении антибиотиков широкого спектра действия учитывается характер микрофлоры (анаэробной). Применяют цефалоспорины II-III поколения (клиндамицин, имипенем).
Варикозная болезнь5 сеар-классификация (1995)
I. Клиническая классификация
Класс 0. Отсутствие симптомов болезни вен при осмотре и пальпации
Класс 1. Телеангиэктазии или ретикулярные вены
Класс 2. Варикозно-расширенные вены
Класс 3. Отек
Класс 4. Кожные изменения, обусловленные заболеванием вен (пигментация, венозная экзема, липодерматосклероз)
Класс 5. Кожные изменения, указанные выше, и зажившая язва
Класс 6. Кожные изменения, указанные выше, и активная язва
П. Этиологическая классификация
Врожденное заболевание (ЕС) Первичное (ЕР) с неизвестной причиной
Вторичное (ES) с известной причиной: посттромботическое, посттравматическое, другие.
III. Анатомическая классификация
Сегмент. Поверхностные вены (AS)
1 Телеангиэктазии/ретикулярные вены. Большая (длинная) подкожная вена (GSV):
2 выше колена, ниже колена
4 Малая (короткая) подкожная вена (LSV)
5 Немагистральная
Глубокие вены (AD)
6 Нижняя полая.
Подвздошные:
общая,
внутренняя,
наружная
10 Тазовые -- гонадные, широкой связки матки и пр.
Бедренная:
общая,
глубокая,
поверхностная
Подколенная
Вены голени — передняя и задняя большеберцовые, малоберцовая (все парные)
Мышечные икроножные, стопы и др. Перфорантные вены (АР):
бедра,
голени
IV. Патофизиологическая классификация
Рефлюкс (PR)
Обструкция (РО)
Рефлюкс + обструкция (PR,О)
V. Клиническая шкала (подсчет баллов)
Боль
= отсутствие;
= умеренная, не требующая приема обезболивающих средств;
2 = сильная, требующая приема обезболивающих средств
Отек
= отсутствие;
= незначительный /
умеренный;
2 = выраженный
«Венозная хромота»
= отсутствие;
= легкая / умеренная;
= сильная Пигментация
= отсутствие;
= локализованная;
= распространенная
Липодерматосклероз:
= отсутствие;
= локализованный;
= распространенный
Язва — размер (самой большой язвы)
= отсутствие;
= <2 см в диаметре;
= >2 см в диаметре.
Язва — длительность:
= отсутствие;
= <3мес.;
= >3 мес.
Язва — рецидивирование
= отсутствие;
= однократно;
= многократно Язва — количество
О = отсутствие; 1= единичная; 2 = множественные VI. Шкала снижения трудоспособности
= бессимптомное течение
= наличие симптомов заболевания, больной трудоспособен и обходится без поддерживающих средств
2 = больной может работать в течение 8 часов, только при использовании поддерживающих средств
3 = больной нетрудоспособен,
даже при использовании поддерживающих средств Клинический раздел классификации СЕАР основан на объективных проявлениях хронических заболеваний вен (стадии от 0 до 6), которые в случаях бессимптомного течения дополняются индексом «А» (например СЗ,А), а при наличии симптоматики -- «S» (например C6,S). В тяжелой стадии заболевания могут наблюдаться все или некоторые из симптомов, характерных для предыдущих стадий. В результате лечения клиническая картина может измениться, и тогда стадия заболевания должна быть пересмотрена.
Основу количественной оценки венозной дисфункции конечности составляют три отдельные шкалы: анатомическая (III), где перечислены анатомические сегменты, каждый из которых оценивается в 1 очко (балл); клиническая (V) и шкала снижения трудоспособности (VI). Патофизиологическая характеристика поражения основывается на данных ультразвукового исследования.
Совещание считает, что классификация СЕАР должна быть использована для оценки эффективности различных методов лечения хронических заболеваний вен. Между тем для повседневной практики она представляется слишком громоздкой.
Для клинического применения Совещание предлагает следующую классификацию варикозной болезни, которая учитывает как форму заболевания, так и степень хронической венозной недостаточности, обусловленную им. Это позволяет наглядно представить степень выраженности морфологических изменений венозного русла и последствий флебогемодинамических нарушений.
Формы варикозной болезни
Внутрикожный и сегментарный варикоз без патологического вено-венозного сброса
Сегментарный варикоз с рефлюксом по поверхностным и/или перфорантным венам
Распространенный варикоз с рефлюксом по поверхностным и перфорантным венам
Варикозное расширение при наличии рефлюкса по глубоким венам
Степени хронической венозной недостаточности
— отсутствует
— синдром «тяжелых ног»
— преходящий отек
— стойкий отек, гипер- или гипопигментация, липодерматосклероз, экзема
4— венозная трофическая язва
Кроме этого, в диагнозе необходимо учесть осложнения варикозной болезни - - кровотечения и тромбофлебит.
• Факторы риска ВБВНК
Наследственность и ее роль в развитии варикозной болезни не находят однозначного подтверждения.
Диагностика
Диагностика ВБВНК должна решить следующие задачи:
Подтвердить наличие патологии венозной системы нижних конечностей.
Выявить рефлюкс по подкожным и перфорантным венам.
Оценить состояние глубоких вен (проходимость и наличие рефлюкса).
Дифференцировать характер патологических изменений в венах (варикозная или посттромбофлебитическая болезни, артериовенозные свищи, врожденные аномалии).
Принципы хирургического лечения
Устранение патологического рефлюкса крови из глубоких вен в поверхностные
Ликвидация варикозно-расширенных поверхностных вен
Неизмененные сегменты большой и малой подкожных вен целесообразно сохранять
Флебосклерозирующее лечение
В качестве самостоятельного метода лечения флебосклерозирующую терапию следует применять при отсутствии патологического вено-венозного сброса в случаях:
Внутрикожного варикоза (телеангиэктазии, ретикулярные вены);
Сегментарного варикозного расширения притоков магистральных подкожных вен.
Дополнительными показаниями для применения флебосклерозирующего лечения могут быть:
Остановка или профилактика кровотечения из варикозной вены;
Облитерация варикозных вен в области трофической язвы с целью ее скорейшего закрытия. При этом венозная трофическая язва должна находиться в стадии грануляции или эпителизации.
Оптимальные концентрации флебосклерозирующих препаратов в зависимости от диаметра вены
Диаметр вены |
Тетрадецилсульфат натрия
Фибровейн Тромбовар |
Полидоканол (этоксисклерол) |
< 0,4 мм |
0,2% |
0,5% |
0,6-2 мм (ретикулярный варикоз) |
0,2-0,5% |
1-2% |
3-5 мм |
0,5-1% 1% |
2-3% |
>5мм |
3% 3% |
3-4% |
Методика флебосклеротерапии.
1. Склеротерапию целесообразно проводить в горизонтальном положении пациента, ато создает максимально комфортные условия для больного и врача, а также предупреждает возможные ваго-вазальные реакции (головокружение, тахикардию, гипотензию, потерю сознания и др.)- Дополнительным аргументом в пользу горизонтального положения пациента является постуральный дренаж, в результате которого знанение и давление в подкожных и внутрикожных венах. Все это создает благоприятные условия для надежной флебосклерооблитерации. В исключительных случаях (например, у тучных пациентов) допускается пункция вены в вертикальном положении больного. Введение же флебосклерозирующего препарата должно осуществляться в горизонтальной позиции.
2. Использование воздушного «блока» (метод Сигга — Орбаха), ре-комендованного для обескровливания венозного сегмента и обеспечения достаточной площади контакта флебосклерозирующего препарата с эндотелием вены является обязательным. С помощью мануальной компрессии перекрыть просвет вены выше и ниже точки инъекции (прием Фегана).
Введение флебосклерозирующего препарата следует проводить строго интравазально. Невозможность выполнения контролируемой интравазальной инъекции является противопоказанием к склеротерапии.
После введения флебосклерозирующего агента необходима немедленная и адекватная эластическая компрессия.
Для наложения компрессионного бандажа после склеротерапии целесообразно использовать специальные латексные подушечки, эластичные бинты ограниченной растяжимости или медицинский компрессионный трикотаж II-III классов.
Для лечения телеангиэктазий и ретикулярных вен целесообразно применять технику микросклеротерапии с использованием низких концентраций флебосклерозирующего препарата фибро-вейн, 0,5% этоксисклерол), микроигл 30 g или микрокатетеров.
7 Не следует выполнять более 5 инъекций за одну процедуру. При этом количество флебосклерозирующего препарата, вводимого во время одной инъекции, не должно превышать 1 мл. То есть максимальная однократная доза для 3% тромбовара, фибро-вейна или этоксисклерола составляет 5 мл. В случае использования растворов флебосклерозирующих препаратов низких концентраций (0,2% фибро-вейн и 0,5% этоксисклерол) разрешается введение до 10 мл препарата.
Повторные лечебные процедуры целесообразно проводить не раньше чем через 2-3 недели. Этот срок необходим для стихания явлений воспаления в области инъекций.
Продолжительность непрерывной, круглосуточной эластической компрессии при лечении варикозных вен калибра 0,5 см и более должна составлять 10-14 суток. Для внутрикожных (ретикулярных) вен и телеангиэктазий этот срок составляет 3-5суток.
Совещание считает, что альтернативные методы лечения телеангиэктазий, такие, как лазерокоагуляция, электрокоагуляция, озонотерапия, фотодермотерапия, менее радикальны и дают высокий процент рецидивов в ближайшем периоде после лечения.
В отношении возможных осложнений флебосклерозирующей терапии Совещание подчеркивает, что при правильно определенных показаниях и корректной технике лечения таких осложнений, как острый тромбофлебит, некроз кожи, тромбоз глубоких вен и тромбоэмболия легочной артерии, а также повреждения нервных и артериальных стволов быть не должно.
Абсолютными противопоказаниями к склеротерапии являются:
тяжелые системные заболевания,
тромбозы глубоких и тромбофлебиты поверхностных вен,
местная или общая инфекция,
лежачие или малоподвижные пациенты,
аллергические диатезы,
беременность и период лактации,
тромбофилические состояния,
ожирение,
невозможность контролируемой внутрисосудистой инъекции.
Консервативное лечение варикозной болезни вен нижних конечностей
Консервативная терапия необходима для подготовки больных с тяжелыми формами ХВН (3 и 4 степени по предложенной классификации) к оперативному лечению, а также в тех случаях, когда хирургическое вмешательство по тем или иным причинам невозможно или откладывается. Кроме этого, комплекс лечебных мероприятий целесообразно проводить для скорейшей реабилитации пациентов в послеоперационном периоде.
Таким образом, основными целями консервативных мероприятий при ВБВНК можно считать устранение ХВН, профилактику рецидивов заболевания, сохранение трудоспособности, а также повышение качества жизни пациентов.
В соответствии с поставленными целями необходимо решение следующих прикладных задач:
• устранение факторов риска (коррекция образа жизни, питания, рациональное трудоустройство и др.);
улучшение флебогемодинамики (эластическая компрессия, лечебная физкультура, постуральный дренаж и др.);
нормализация функции венозной стенки;
коррекция нарушений микроциркуллции, геморрсологни н лимфотока;
• купирование воспалительных реакций.
Программа консервативного лечения в зависимости от степени ХВН
Вне зависимости от наличия и выраженности ХВН все пациенты нуждаются в устранении факторов риска заболевания. Объем лечебных мероприятий зависит от степени ХВН.
0 степень
• Эластическая компрессия (профилактический или лечебный трикотаж I класса)
1 степень
Эластическая компрессия (лечебный трикотаж I-II класса)
Эпизодические курсы монофармакотерапии
2 степень
Эластическая компрессия (лечебный трикотаж II класса)
Повторные курсы монофармакотерапии
Физиотерапия и санаторно-курортное лечение
3 и 4 степени
• Эластическая компрессия (лечебный трикотаж II-III класса)
• Непрерывная комбинированная фармакотерапия
Местное лечение
Физиотерапия
• Компрессионное лечение
Эластическая компрессия должна быть обязательным компонентом любых лечебно-профилактических мероприятий при варикозной болезни.
Терапевтический эффект компрессионного лечения определяется следующими доказанными механизмами действия:
снижением патологической венозной «емкости» нижних конечностей;
улучшением функциональной способности недостаточного клапанного аппарата;
возрастанием резорбции тканевой жидкости в венозном колене капилляра и снижением ее фильтрации в артериальном;
увеличением фибринолитической активности крови.
Основным гемодинамическим результатом правильно подобранной программы компрессионного лечения является нормализация функции мышечно-венозной «помпы» нижних конечностей с улучшением гемореологии и микроциркуляции.
Эластическая компрессия, в зависимости от характера патологии и преследуемых целей, может быть назначена на ограниченный или длительный срок.
Эластическую компрессию на ограниченный промежуток времени (до 3-6 месяцев) назначают по следующим показаниям:
• хирургическое или инъекционное лечение варикозной болезни;
• профилактика варикозной болезни и ее осложнений во время беременности;
• предоперационная подготовка, направленная на улучшение трофики кожи, заживление язв или купирование явлений лимфатической недостаточности;
• профилактика варикотромбофлебита.
Показанием к длительной эластической компрессии (свыше 6 месяцев) при ВБВНК является невозможность (по тем или иным причинам) радикальной хирургической коррекции.
Для компрессионного лечения в различных клинических ситуациях используют эластичные бинты короткой (удлинение бинта не более 70% от исходной длины), средней (увеличение первоначальной длины при растяжении от 70 до 140%) и длинной (более 140%) растяжимости. При этом эластичные бинты длинной растяжимости целесообразно использовать лишь для профилактики кровотечении и гематом в ближайшем периоде после флебэктомии.
Наряду с эластичными бинтами Совещание рекомендует шире применять специальный медицинский компрессионный трикотаж (гольфы, чулки, колготы), сертифицированный МЗ РФ.
Медицинский трикотаж в зависимости от степени компрессии и предназначения разделяют на профилактический, создающий давление на уровне лодыжек не более 18 мм рт. ст., и лечебный, который в зависимости от компрессионного класса обеспечивает давление на уровне лодыжек от 18,5 до 60 мм рт. ст.
Величина давления, обеспечиваемая профилактическим трикотажем (до 18 мм рт. ст.), существенно ниже лечебного уровня компрессии. Вот почему для отличия лечебных изделий от профилактических последние имеют маркировку в денах. При выборе изделия врач должен четко представлять, что ДЕНье — это чисто техническая характеристика плотности изделия, зависящая от количества и качества эластичных волокон. Прямой корреляции между количеством ДЕНье и степенью компрессии нет. Единственным отличием профилактических изделий от обычных декоративных является физиологическое распределение давления.
В соответствии с этим основным показанием к применению профилактического трикотажа является предупреждение явлений венозной недостаточности в группах риска (во время беременности, при ведении малоподвижного образа жизни, длительных ортостатических нагрузках, вынужденном приеме гормональных препаратов, наличии наследственной предрасположенности к ВБВНК, значительных колебаниях массы тела и др.). В редких случаях, по согласованию с врачом, профилактический трикотаж на короткое время (2-3 часа) может заменять лечебный.
Лечебный компрессионный трикотаж необходимо подбирать с учетом характера патологии по индивидуальным размерам.
Регламент эластической компрессии определяется конкретными клиническими задачами. Так, после комбинированной флебэктомии в ближайшем послеоперационном периоде ее осуществляют бинтами длинной растяжимости, так как требуется надежный гемостаз. После активизации больного целесообразно перейти на бандаж средней степени растяжимости. После адаптации кожных швов, на 10-12 сутки, вместо бинтов могут быть применены медицинские чулки или колготы I или II компрессионных классов. Общая продолжительность эластической компрессии после флебэктомии при неосложненной варикозной болезни составляет 1,5-2 месяца.
Компрессию после пункционной склерооблитерации вен осуществляют хлопковыми бинтами средней степени растяжимости. При этом продолжительность постоянного ношения эластического бандажа (включая и ночной отдых) составляет 7-8 дней с момента последней инъекции.
При флебосклерозирующем лечении ретикулярного варикоза и телеангиэктазии длительность эластической компрессии не превышает 2-3 дней. В этой ситуации эластичные бинты могут быть успешно заменены медицинскими чулками или колготами II компрессионного класса. В последующем также следует рекомендовать ношение профилактического медицинского трикотажа.
Группы флеботропных препаратов
Химическое вещество |
Активный компонент
|
Торговое название в РФ
|
Альфа-бензопироны |
Кумарины |
В РФ не зарегистриро ваны |
Гама-бензопироны (флавоноиды) |
Диосмин Гесперидин Метилхалькон Флавоноевая кислота |
Детралекс Цикло-3-форт |
Производные рутина |
Рутиниды и гидроксирутозиды |
Анавенол, Венорутон, Рутин, Троксерутин, Троксевазин |
Пикногенолы |
Лейкоцианидол, Процианиды, Олигомеры |
Эндотелон |
Сапонины |
Эсцин, Рускозиды |
Анавенол, Аэсцин, Репарил, Эскузан |
Производные спорынтьи |
Дигидроэрготамин, Дигидроэргокристин, Дигидроэргокриптин |
Вазобрал |
Синтетические вещества |
Трибенозид, Гептаминол, Кальция добезилат |
Гливенол, Гинкор-форт, Доксиум |
Наряду с флеботропными лекарственными средствами при ВБВНК используют препараты других фармацевтических групп. Это могут быть:
нестероидные противовоспалительные средства (ибупрофен, диклофенак и др.) и антибиотики;
препараты для системной энзимотерапии (вобэнзим, флогэнзим);
• вазоактивные средства и дезагреганты (пентоксифиллин, аспирин, дипиридамол, производные никотиновой кислоты, ПГЕ1 и др.).
В комплексной терапии ВБВНК могут также применяться топические лекарственные средства (мази, гели). В зависимости от основного активного компонента их можно разделить на несколько групп, по содержанию: гепарина (эссавен-гель, лиотон1000-гель и др.), НПВС (диклофенак-гель, орувель-гель, фастум-гель и др.), кортикостероидов (целестодерм, флуцинар, фторокорт и др.) или флеботоников (венорутон-гель, гинкор-гель, цикло-3-мазь и др.). Необходимо подчеркнуть, что средства для местного лечения необходимо сочетать с эластической компрессией и системной фармакотерапией.
Методика компрессионной флебосклерозирующей терапии

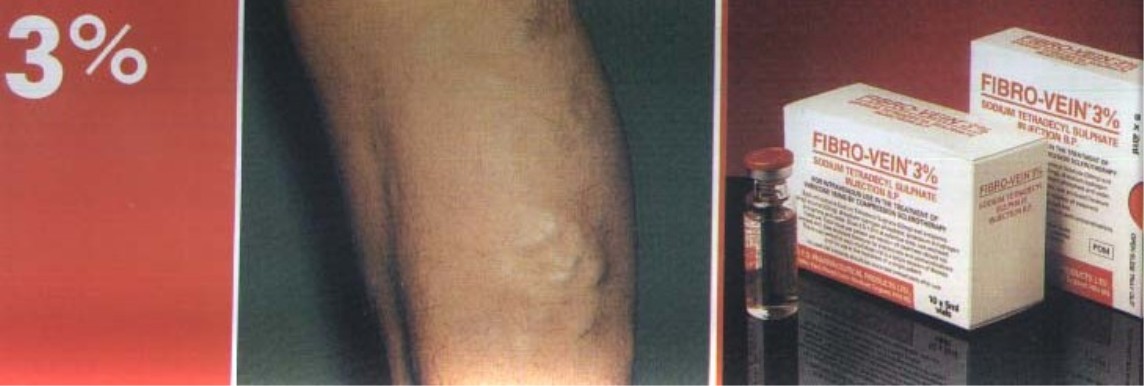
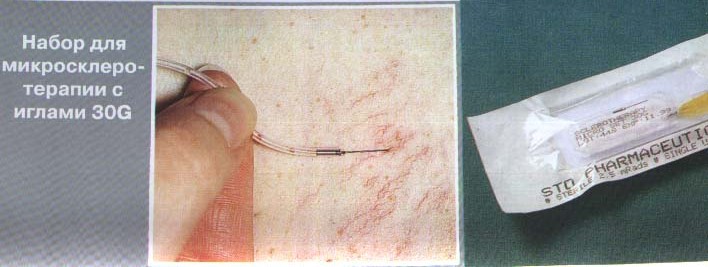
Острый варикотромбофлебит
Термином варикотромбофлебит обозначают наиболее распространенную форму тромбофлебита, при которой патологический процесс поражает варикозно расширенные поверхностные вены нижних конечностей. В подавляющем большинстве случаев он является осложнением варикозной болезни, реже возникает при постгромбофлебитическом синдроме. Варикозные вены представляют собой «благодатную почву» для развития тромбоза, так как изменения сосудистой стенки и замедление кровотока служат важнейшими причинами тромбообразования. При соответствующих изменениях адгезивно-агрегационных свойств форменных элементов крови и плазменного звена гемостаза (чему способствует венозный застой и турбулентный характер кровотока) в них возникают тромбы.
Поверхностное расположение варикозных вен обусловливает тот факт, что вторичное воспалительное поражение сосудистой стенки (флебит) и окружающих тканей (перифлебит), имеющиеся при любой локализации венозного тромбоза, является наиболее ярким клиническим проявлением данного заболевания. Вместе с тем, с точки зрения современной флебологии, нет принципиальных отличий патогенеза тромбофлебита и флеботромбоза.
Клинический опыт показывает, что при тромбофлебите на участке «свежего» недавно сформированного тромба обычно отсутствуют изменения стенок вены. С другой стороны, случаи флебита без тромбоза представляют собой казуистику. Вот почему большинство флебологов, понимая условность подобного деления, пользуются термином «тромбофлебит» при поражении подкожных и «флеботромбоз» - глубоких вен. Исключение составляют лишь крайне редкие в наши дни случаи гнойного расплавления тромботических масс, которое может возникнуть как в поверхностной, так и в глубокой венозных системах. Вообще же флебит, как правило, носит асептический характер, и роль инфекции ограничивается, по-видимому, вторичными изменениями гемокоагуляции. Об этом необходимо помнить при планировании лечебных мероприятий.
Варикотромбофлебит является самым распространенным острым сосудистым заболеванием, по поводу которого пациенты обращаются в поликлиники и госпитализируются в различные хирургические стационары. От того, насколько своевременно и правильно поставлен диагноз и назначено лечение, во многом зависит судьба больного.
Диагностика
Клиническая диагностика острого варикотромбофлебита в большинстве случаев не вызывает существенных затруднений. Превалируют достаточно яркие местные симптомы, общее самочувствие большинства больных остается удовлетворительным. При распространенном поражении может наблюдаться субфебрилитет. Пациентов беспокоят боли различной интенсивности в пораженной конечности. При осмотре отмечается полоса гиперемии в проекции пораженной варикозно расширенной вены. Пальпация выявляет в этой зоне болезненный тяж. Контуры и размеры пальпируемого инфильтрата не изменяются при переводе больного из вертикальной позиции в горизонтальную, в то время как нетромбированные венозные узлы имеют мягкую консистенцию и, опорожняясь от крови, полностью спадаются в положении «лежа». В случаях тромботического поражения конгломерата варикозных вен инфильтрат теряет линейный характер и приобретает неправильную форму, иногда достигая значительных размеров. Важно оценить наличие и характер отека пораженной конечности. При тромбофлебите поверхностных вен он носит сугубо местный (в зоне воспаления) характер. Выраженный распространенный отек и цианоз дистальных отделов конечности указывают на тромботическое поражение глубоких вен. Яркая гиперемия кожи над пораженным сосудом, характерная для первых дней заболевания, к 6—7-му дню обычно проходит, и кожа приобретает сначала синюшный, а затем коричневатый оттенок.
Следует подчеркнуть, что только описанные выше симптомы указывают на наличие тромбофлебита. До сих пор мы часто сталкиваемся с тем, что для некоторых врачей термин «тромбофлебит» вообще является синонимом варикозного расширения подкожных вен.
Особое внимание необходимо обращать на локализацию тромбофлебита.
Во-первых, необходимо определить, поражен ли ствол магистральной подкожной вены или тромбированы их притоки. В последнем случае уплотненный, болезненный тяж с гиперемией кожи над ним выявляется вне проекции большой или малой подкожных вен.
Во-вторых, нужно установить проксимальную границу распространения тромбоза в поверхностной венозной магистрали, поскольку именно это определяет тактику ведения больных.
Наиболее опасны так называемые восходящие формы варикотромбофлебита, когда по мере развития заболевания процесс распространяется из дистальных отделов конечности в проксимальном направлении. Восходящий тромбофлебит реально угрожает распространением тромбоза на глубокие вены и развитием эмболии легочных артерий. К сожалению, ценность физикального обследования для точного установления протяженности тромбоза невысока. У 30 % больных истинная его граница в поверхностных венах расположена на 15 - 20 см выше клинически определяемых признаков тромбофлебита, поэтому для правильного решения вопросов лечебной тактики необходимо применение инструментальных методов диагностики.
Мы вынуждены констатировать, что распространенной практикой является ориентация врачей на данные реовазогра-фии или ультразвуковой допплерографии. Первый способ не дает никакой информации не только о распространенности тромбоза поверхностных вен, но даже о его наличии. Допплерография, обладая несомненными достоинствами в диагностике хронической венозной патологии, не позволяет достоверно установить протяженность тромбоза в подкожной магистрали и наличие его (особенно неокклюзивных форм) в глубоких венах.
Наиболее точную диагностическую информацию предоставляет ультразвуковое дуплексное ангиосканирование с цветовым кодированием кровотока прежде всего благодаря возможности прямой визуализации сосудов. Это исследование позволяет оценить состояние стенок и просвета вен, наличие в них тромботических масс, характер тромба (окклюзивный, неокклюзивный) и даже ориентировочно судить о его «возрасте», т.е. степени организации.
Рентгеноконтрастная флебография имеет ограниченное значение в диагностике этого заболевания. Ее использование целесообразно лишь при распространении сафено-феморального тромбоза на подвздошные и нижнюю полую вены. В подобных ситуациях речь может пойти о прямых или непрямых эндовазальных) вмешательствах на нижней полой вене.
Роль лабораторной диагностики невелика. Клинический анализ крови выявляет умеренно выраженные признаки воспаления (небольшой лейкоцитоз, увеличение СОЭ, положительную реакцию на CRP). Исследование различных компонентов системы гемостаза не имеет самостоятельного диагностического значения. Между тем многие врачи почему-то считают высокий уровень индекса протромбина маркером венозного тромбоза. Если у пациента с варикозной болезнью этот показатель превышает 100%, то они выставляют диагноз острого тромбоза и направляют его в стационар даже при отсутствии каких-либо клинических признаков. Такой подход не выдерживает никакой критики, не может заменить физикального и инструментального обследования и должен быть оставлен в прошлом.
Сталкиваясь с больными варикотромбофлебитом, следует обязательно исключить его паранеопластнческий характер. Так, известно, что 1/3 больных раком тела поджелудочной железы первично обращаются к врачу с симптомами тромбофлебита. Поэтому по отношению к пациентам с острым тромбофлебитом очень важна онкологическая настороженность врача. Тогда при малейших сомнениях, помимо общеклинического обследования, должно быть проведено тщательное ультразвуковое исследование органов брюшной полости, забрюшинного пространства и малого таза, щитовидной железы, гастро- и колоноскопия, рентгеновское исследование грудной клетки.
Лечение
Лечебные мероприятия при остром варикотромбофлебите должны:
1) предотвратить распространение тромбоза на глубокие вены;
2) быстро купировать воспалительные явления в стенке вены и окружающих тканях;
3) исключить рецидив тромбоза варикозно расширенных вен.
Большинство пациентов с варикотромбофлебитом могут лечиться консервативно в амбулаторных условиях. Неотложная госпитализация в хирургические стационары (желательно в специализированные сосудистые или флебологические отделения) необходима при восходящих формах тромбофлебита стволов большой и малой подкожных вен, когда возникает угроза перехода тромбоза на глубокие вены. Такие больные должны быть оперированы в экстренном порядке после ультразвукового сканирования.
Оперативное лечение.
Оперативное лечение может носить паллиативный или радикальный характер. Целью паллиативных операций является предотвращение перехода тромбоза на глубокие вены через сафено-феморалыюе и сафено-по-плитеальное соустья. Для этого производят приустьевую перевязку подкожных магистралей. Чаще всего тромботический процесс поражает большую подкожную вену, поэтому наиболее известна операция Трояно-ва — Тренделенбурга - высокое лигирование v. saphena magna с обязательной перевязкой всех приустьевых притоков. В послеоперационном периоде больным проводят консервативное лечение, направленное на купирование тромботического и воспалительного процессов.
Радикальное хирургическое вмешательство возможно при варикозной болезни, оно предусматривает не только ликвидацию угрозы развития глубокого венозного тромбоза и легочной эмболии, но и удаление всех варикозно расширенных (тромбированных и нетромбированных) вен с обязательной перевязкой несостоятельных перфорантов.
Преимуществом такой операции является ускорение сроков медицинской реабилитации за счет радикального устранения патологического очага. Поэтому у соматически не отягощенных пациентов предпочтительнее выполнение радикальной комбинированной венэктомии. Такое вмешательство целесообразно выполнять в первые 2 нед. заболевания. В более поздние сроки плотный воспалительный инфильтрат в зоне варикотромбофлебита делает удаление пораженных вен весьма травматичным. Вот почему, если радикальная операция в силу каких-либо причин не могла быть выполнена в этот период времени, ее проведение следует отложить до полного купирования воспалительных явлений (на срок 4 — 6 мес).
Неотложное хирургическое вмешательство показано также больным с сафено-феморальным и сафеио-поплите-альным тромбозами, т.е. при переходе патологического процесса на глубокие вены. В этих случаях наряду с лиги-рованием магистральных поверхностных вен проводят тромбэктомию из бедренной или подколенной вен. Подобные вмешательства должны выполняться в специализированных отделениях сосудистой хирургии.
Свои особенности имеет оперативное вмешательство по поводу варикотромбофлебита при посттромбофлебити-ческой болезни. Поверхностные вены у этих пациентов нередко выполняют активную коллатеральную функцию. Поскольку в большинстве случаев тромб в подкожных венах подвергается реканализации, удаление этих дополнительных путей оттока крови из конечности нецелесообразно. Объем операции должен быть ограничен приустьевой перевязкой поверхностных магистральных вен. Существенным отличием такой операции от вмешательства при варикозной болезни является обязательное сохранение всех притоков вблизи соустья. Именно по ним происходит отток крови в контралатеральную конечность или в систему верхней полой вены при поражении подвздошных вен. Поэтому на устье подкожной вены пристеночно к глубокой накладывают лигатуру, не пересекая поверхностную магистраль и ее притоки. После реканализации тромба коллатеральный кровоток по подкожным венам возобновляется.
В случаях посттромботической окклюзии глубоких вен проводить оперативное вмешательство пациентам с варикотромбофлебитом нет необходимости вне чявисимости от его уровня. Окклюзия подвздошных и бедренных вен сама по себе является преградой на пути распространения тромбоза из большой подкожной вены в проксимальном направлении. Риск легочной эмболии при этом отсутствует, поэтому таким пациентам достаточно проведения консервативной терапии.
Консервативное лечение
Консервативное лечение варикотромбофлебита должно быть направлено на купирование воспалительного и локального тромботического процессов. Терапия должна быть комплексной и включать как лекарственные, так и немедикаментозные средства.
Режим, который предписывается больным, должен быть активным. Ошибкой следует признать назначение постельного режима, поскольку деятельность мышечно-венозной помпы голени обеспечивает интенсивный кровоток в глубоких венах, препятствуя развитию в них тромбоза. Мерой, направленной на коррекцию нарушений кровотока в поверхностных варикозно расширенных венах, должно быть проведение адекватной эластической компрессии. В первые дни заболевания, когда максимально выражены воспалительные явления и требуется активное местное лечение, целесообразно формировать бандаж с помощью эластических бинтов средней степени растяжимости. По мере стихания воспалительных явлений для компрессионного лечения может быть с успехом использован медицинский трикотаж - гольфы, чулки или колготы 2-3 компрессионного класса.
Простой, но действенной мерой является локальная гипотермия, тормозящая процессы воспаления в тканях и дающий хороший обезболивающий эффект.
Медикаментозная терапия варикотромбофлебита предполагает сочетанное использование лекарственных средств системного и локального применения. До сих пор нередко даже в столичных лечебных учреждениях весьма популярно назначение антибиотиков и мази Вишневского. Мы должны со всей определенностью сказать, что использование антибактериальных средств совершенно не оправдано в подавляющем большинстве случаев, поскольку, как уже было сказано выше, при тромбофлебите воспалительный процесс носит асептический характер. Кроме того, многие антибиотики способствуют развитию гиперкоагуляции и тем самым могут вести к прогрессированию тромбообразования. Что касается мази Вишневского (средства, хорошо стимулирующего развитие грануляций в ранах), по нашему мнению, при острых тромбофлебитах она вообще должна быть исключена из лечебного арсенала. Ее противовоспалительное действие недостаточно, а традиционное применение в виде компрессов создает «парниковый» эффект и часто приводит к прогрессированию тромбофлебита.
При варикотромбофлебите оправдано использование различных форм нескольких классов фармацевтических препаратов:
1) нестероидных противовоспалительных средств (ВПК);
производных рутина;
дезагрегантов;
полиэнзимных смесей для перорального применения;
флеботоников растительного происхождения и
антикоагулянтов.
Из группы НПВС наиболее эффективными при данной патологии являются диклофенак и кетопрофен, которые могут применяться в виде инъекционных, таблетированных и мазевых форм. Эти препараты оказывают не только мощное противовоспалительное, но и хорошее анальгезирующее действие. Гель кетопрофена наносят 2-3 раза в день в количестве 3—5 г (1 см мази, выдавленной из тюбика) непосредственно на пораженный участок конечности и легкими круговыми движениями пальцев рук втирают в кожу. Быстрый эффект дают внутримышечные инъекции НПВС, а также использование их в ректальных свечах. Эти способы применения указанных средств уменьшают частоту и выраженность гастроирритивных осложнений.
Эффективным средством лечения варикотромбофлебита являются производные рутина (рутознд, троксевазнн, троксерггин), представляющие собой универсальные протекторы венозной стенки и оказывающие выраженное противовоспалительное действие. При острых тромбофлебитах эффект применения этих препаратов проявляется, по нашему мнению, в большей степени, чем при хронической венозной недостаточности. Суточная доза различных троксерутинов обычно составляет 1200 мг. Существуют также мазевые формы указанных средств (троксевазиновая мазь, рутозид-гель), однако достаточно высокая вероятность кожных аллергических реакций при их применении обусловливает сдержанное к ним отношение.
В комплекс консервативных мероприятий целесообразно включать дезагрегантние средства- внутривенное введение реополиглюкина (400 мл) и трентала (10 мл). Вливания проводят капельно 1 раз в сутки в течение 3-5 дней. Перорально трентал назначают в суточной дозе 800-1200 мг. В профилактических целях могут быть использованы малые лозы аспирина.
Эффект системной энзимотерапии обусловлен способностью гидролитических ферментов угнетать процесс воспаления, оказывать противоотечное и иммуномодулирую-щее действие, удалять фиксированные в тканях иммунные комплексы и активизировать фибринолиз. Вобэнзим (смесь панкреатина, папаина, бромелаина, трипсина, химотрипсина, амилазы, липазы и рутина) принимают по 5-10 таблеток 3 раза в день; флогэнзим (смесь бромелаина, трипсина и рутозида) - по 2 таблетки 3 раза в день, запивая большим количеством воды. Достаточно быстрое купирование острых явлений тромбофлебита при отсутствии аллергических осложнений можно назвать уникальным свойством ферментных препаратов. Сдерживающим фактором для широкого применения системной энзимотерапии является необходимость приема большого числа таблеток в строго определенное время и ее достаточно высокая стоимость.
Показанием к применению флеботропных средств растительного происхождения (лиосмин, троксерупш, цикло-З-форт, эвдотелон) является хроническая венозная и лимфо-венозная недостаточность. Вместе с тем их можно использовать в ряде случаев острого варикотромбофлебита. Это бывает необходимо при тяжелых аллергических реакциях на обычно используемые средства. Мы имеем положительный опыт назначения в этих целях диосмин в начальной дозировке 3 г (как при остром геморрое) с последующим снижением дозы до 1 г в сутки. Назначение этой группы лекарственных средств может быть использовано для профилактики развития тромбофлебита при декомпенсированных формах варикозной и посттромбофлебитической болезней.
Особо следует остановиться на роли антикоагулянтов. Опыт показывает, что в большинстве случаев варикотромбофлебита нет никакой необходимости в их системном применении, тем более что основная масса больных проходит амбулаторное лечение. Это затрудняет адекватный контроль за системой гемостаза, в связи с чем возможно развитие тяжелых геморрагических осложнений. Вместе с тем в обычных клинических ситуациях вполне достаточно использование перечисленных выше препаратов. Пожалуй, единственной клинической ситуацией, когда оправдано длительное (иногда пожизненное) назначение антикоагулянтов, является упорное рецидивирование тромбофлебита у больных с патологией системы гемостаза.
Топические формы гепарина заслуженно являются самыми популярными средствами лечения острого тромбофлебита. Гепарин оказывает мощное антитромботическое и противовоспалительное действие и при местном применении не вызывает системных гемостазиологических ре-акций. Вместе с тем создать его эффективную концентрацию в тканях весьма сложно, и только в последние годы в этом направлении достигнут определенный прогресс. Новое поколение мазевых форм гепарина производится по технологии иммобилизации активного вещества на специальной гелевой матрице, что обеспечивает его хорошую абсорбцию. Еще одним отличием современных гелевых форм от традиционных мазей (гепариновая, гепатромбин) является высокое содержание гепарина.
Дозировка и частота применения гепаринсодержащих гелей аналогичны таковым при использовании топических противовоспалительных средств. В то же время хорошо зарекомендовало себя чередование этих препаратов, т.е. гелевые аппликации проводят 4 раза в день по схеме:
гепарин — НПВС — гепарин — НПВС.
Примерная схема использования консервативных лечебных мероприятий и их регламент при остром варико-тромбофлебите представлены в таблице.
-
Типовая схема консервативного лечения
варикотромбофлебита
Вид лечения
Регламент
Режим
Активный
Эластическая компрессия
Эластическое бинтование – 10-14 дней круглосуточно, затем - медицдинский копрессионный трикотаж в дневное время
Гипотермия
Местно 5-6 раз в день по 30-40 мин в течение 3 дней
Системные средства:
1. Диклофенак или кетопрофен по 3 мл в/м 2 раза в день (3 дня), затем пероральный прием этих средств.
2. Рутозид или троксерутин по 1 капсуле (300 мг) 4 раза в день (10-12 дней), либо вобэнзим по 10 таблеток 3 раза в день (14 дней).
Топические средства:
Кетопрофен-гель 2 раза в день + гепарин-гель 2 раза в день
При проведении консервативных мероприятий необходимо помнить о возможности прогрессирования тромбофлебита, несмотря на проводимое лечение. Поэтому в процессе терапии должен проводиться динамический контроль (клинический и ультрасонографический) за течением заболевания.
Профилактика
Основным принципом профилактики варикотромбофлебита является своевременное и адекватное лечение хронических заболеваний вен. Это включает в себя прежде всего оперативное лечение ранних (неосложненных) стадий варикозной болезни. Если пациент уже перенес тромбофлебит, то задача врача заключается в предотвращении его рецидива. Поэтому после стихания острых явлений лечебные мероприятия должны быть направлены на коррекцию хронической венозной недостаточности и подготовку больных варикозной болезнью, которым было проведено только консервативное лечение либо выполнена паллиативная операция, к радикальному плановому хирургическому вмешательству. В комплекс лечения, помимо эластической компрессии и флебопротекторов, целесообразно включать физиотерапевтические мероприятия - переменные магнитные поля, синусоидальные модулированные токи. Оперативное лечение проводят через 4-6 мес после перенесенного варикотромбофлебита. В эти сроки обычно полностью купируются явления воспаления в стенке вены и окружающих тканях, а большинство тромбированных поверхностных вен реканализуются.
При отказе пациента от операции или невозможности ее проведения (из-за преклонного возраста, тяжелых сопутствующих заболеваний, а также при посттромбофле-битической болезни) осуществляют диспансерное наблюдение и систематическое проведение курсов консервативного лечения хронической венозной недостаточности. Пациенты должны постоянно использовать компрессионный трикотаж или бинты и 2 - 3 раза в год проходить курсы лечения флеботониками, топическими средствами и физиопроцедурами. Определенное значение имеет диета. Больным следует ограничить потребление животных жиров, шире использовать в рационе растительные масла, употреблять в пищу больше овощей и ягод, богатых аскорбиновой кислотой и рутином.
Поспромбофлебитическая болезнь, осложняющаяся повторным варикотромбофлебитом, который может сочетаться с периодической активизацией тромботического процесса в глубоких венах, во многих случаях связана с тромбофилическими состояниями (врожденный дефицит антитромбина III, антифосфолипидный синдром, лейденовская мутация и пр.). Вот почему в таких случаях целесообразно длительное (иногда пожизненное) назначение непрямых антикоагулянтов.
Нельзя также забывать, что наличие варикозной и по-сттромбофлебитической болезней с ранее перенесенным варикотромбофлебитом является значительным фактором риска тромбоэмболических осложнений у пациентов при продолжительных операциях на органах брюшной полости, ортопедических вмешательствах, длительной гипокинезии, связанной с постельным режимом либо длительными авиаперелетами. В таких ситуациях в профилактических целях, помимо адекватной эластической компрессии нижних конечностей, следует назначать подкожное введение малых доз гепарина: обычного нефракционированного или низкомолекулярного (например, эноксапарина), который более эффективен. Эти меры существенно снижают частоту возникновения венозного тромбоза и легочной эмболии. В заключение считаем важным подчеркнуть необходимость широкой просветительской работы среди населения, направленной на осознание целесообразности своевременного лечения варикозной болезни, совместной лечебной работы врачей общей практики и хирургов, что позволит контролировать и во многих случаях предотвращать возникновение такого распространенного и опасного заболевания, каковым является варикотромбофлебит.
Хирургическая фармакология Фармакологическая характеристика соматостатина.
Соматостатин – полипептнд, который синтезируется клетками, локализованными преимущественно в слизистой желудка, двенадцатиперстной кишки, поджелудочной железы и тонкой кишки. Являясь "головным гормоном кишечника", он оказывает комплексное регуляторное влияние на функциональное состояние желудочно-кишечного тракта и поджелудочной железы. Так, СО ингибирует освобождение гастрина, секретина, панкреозимина, холецистокинина и вазоактнвного интестинального полипептида (ВИП). В этой связи он снижает экзокринную секрецию поджелудочной железы, соляной кислоты в желудке, моторику желудочно-кишечного тракта, блокирует всасывание воды, электролитов, нутритивных факторов в кишечнике. Впервые СО выделен в 1968 году из гипоталамуса крупного рогатого скота, а в 1973 году расшифрована структура и выполнен его синтез. В 1975 году соматостатин применен в клинической практике в комплексном лечении кровотечении язвенной этиологии, а начиная с 1980 года - при остром панкреатите и его осложнениях, кровотечениях из варикозно-расширенных вен пищевода и эндокринных опухолях желудочно-кишечного тракта.
Соматостатин ("Стиламни") синтетический циклический N -аминокислотный пептид, который но своей структуре и действию сходен с естественным гормоном соматостатипом, производится швейцарской фирмой "SERONO". Стиламин препятствует выделению гастрнна, пепсина, желудочного сока, подавляет секрецию глюкагона, гормона роста и инсулина, уменьшает эндо- и экзокринную секретно (ферментов и бикарбонатов ) поджелудочной железы, а также оказывает сильное антппролиферативное действие на клетки слизистой кишечника. СО имеет очень короткий период полувыведения (2-3 мин ) и вводится внутривенно непрерывно ннфузоматом.
Октреотида ацетат ("Сандостатнн") - синтетически циклический октапептид, являющийся производным естественного гормона СО, производится швейцарской фирмой " SANDOZ PHARMA LTD ". OK имеет ту же последовательность аминокислот, что и СО, обусловливающую его биоактивность. В отличие от СО, другая его химическая особенность позволяет уменьшить распад ОК, увеличивая период полувыведения до 90 мин. ОК плохо всасывается в желудочно-кишечном тракте, поэтому его вводят парентерально (подкожно и внутривенно ). При подкожном введении биодоступность ОК составляет 100%. В плазме крови 65% препарата связано с белками-липопротеинами.
Фармакодинамика соматостатина у человека ( по M.R. Lucey, T.Yamada (1989))
* Ингибирует нейро-эндокринную секрецию
- кишечных и панкреатических пептидов
* Ингибирует экзокринную секрецию
слюнных желез ( амилаза)
желудка ( пепсин, кислотный фактор )
поджелудочной железы (энзимы, бикарбонаты )
печени (пассаж желчи )
* Ингибирует кишечный транспорт
абсорбцию глюкозы, жирных и аминокислот
стимулирует секрецию в тонкой кишке
* Угнетает моторику
желудка ( поздняя фаза эвакуации )
желчного пузыря
снижает время транзита по тонкой кишке
* Стимулирует моторику
раннюю эвакуацию из желудка
миграцию двигательного комплекса
* Ингибирует гемодинамику
спланхнического бассейна
венозное давление в печени
давление в воротной вене
спланхнический кровоток
Антисекреторный эффект ОК и СО обусловлен снижением захвата ацинарными клетками поджелудочной железы аминокислот из плазмы. Этот механизм обусловливает уменьшение синтеза панкреатических ферментов, подавление активности ацинарных клеток и снижение аккумуляции в них ферментов [ 9,10,11]. Исследованиями у человека показано, что ОК и СО угнетают базалыгую и стимулированную панкреатическую секрецию, Ингибирует выделение секретина и холецистокинина. При этом в поджелудочной железе ОК воздействует на бета-клетки подобными соматостатину механизмами.
ОК по сравнению с СО обладает более низким клиренсом и улучшенной метаболической стабильностью в циркуляции и органах-мишенях, что характеризуется большей продолжительностью действия и, соответственно, увеличением степени терапевтического эффекта. Так, ОК обладает в организме длительным действием - время полувыведения препарата при внутривенном использовании составляет 45 мин при подкожном - ПО мин. По данным В.Ф.Саенко с соавт. (1995), действие ОК на поджелудочную железу обусловливает снижение гидросекреторной функции у 78.5%, повышение у 14.2% больных При этом активность ферментов поджелудочной железы снижается у 42.9%, повышается у 21.4% больных. Диспаикреатнзм (повышение активностилипазы, при снижении активности амилазы и трипсина) регистрируется у 35.7% больных. Наряду с этим 'чается нормализующий характер влияния ОК на вводный обмен: при сопутствующем заболевании сахарным диабетом наблюдается снижение уровня глюкозы крови, при инсулиноме - повышение этого показателя. ОК как и СО ингибирует секрецию соляной кислоты париетальными клетками желудка Предполагается, что ингибирующее действие К на островковые и ацинарные клетки поджелудочной железы обусловлено не только прямым, но и косвенным путем, через подавление секреции холецистокинина. Возможность полного подавления экзокрннной панкреатической секреции обеспечивается дозой более 0.625 мкг/кг массы больного.
Показано, что ОК снижает всасываемость из просвета тонкой кишки со 100% до 37,7+12,8%, снижает уровень в плазме глюкагона, холецистокинина, инсулина, глюкозы, гастрина. Однако под действием ОК ВИП не меняет своей концентрации.
Побочные эффекты препаратов незначительны. Среди последних описаны следующие. Со стороны желудочно-кишечного тракта возможны анорексия, тошнота, рвота, спастические боли в животе, метеоризм, диарея и стеаторея. Поэтому препарат рекумендуют назначать за 2 часа до приема пищи. Известны отдельные случаи развития острого гепатита без холестаза, а также гипербилирубинемии в сочетании с увеличением активности щелочной фосфатазы, гамма-глютамилтрансферазы и трансаминаз. По данным Di Francesco V. и соавт.(1996), этот феномен ОК может быть обусловлен повышением давления в сфинктере Оддн с возможным нарушением оттока панкреатического секрета и желчи. Так, при исследовании моторики сфинктера Одди после воздействия ОК у 83,3% больных развились длительные абдоминальные боли и уровень амилазы повысился в 3 раза по сравнению с нормой. В отличие от ОК, СО обладает релаксирующим действием на сфинктер Одди.
Простой и низкомолекулярный гепарин (нмг).
Мол. масса НМГ составляет 4000 — 6000 Д. НМГ был получен из стандартного гепарина методом деполимеризации. В клинической практике отмечено, что применение НМГ изменяет структуру фибринного сгустка и тормозит развитие продолженного проксимально расположенного тромба.
С целью профилактики тромбоза у пациента с массой тела 50 — 60 кг наиболее употребительно введение НМГ в дозе, содержащей 5000 — 7500 анти-Ха ед. за 2 - 4 ч до операции подкожно ("Fraxiparin" 0,Змл, " Enoxaparin" 50мг) и продолжение этого курса в течение 10 - 12 дней послеоперационного периода под контролем флебографии, методов ультразвуковой, допплеровской и радиоизотопной индикации.
На основе сопоставительного анализа в рандомизированных группах показано, что для пациентов старше 40 лет при абдоминальных операциях адекватная профилактическая доза НМГ должна составлять 3500 — 5000 анти-Ха ед. 1 раз в день в течение 5 — 10— 12 дней. Применение этих доз НМГ позволило снизить частоту геморрагических осложнений с 4,7 до 2,7%, а тромбозов с 13,1 до 6,8%.
Для ортопедических групп больных оптимальной является доза НМГ 3000 анти-Ха ед. 2 раза в день в течение 10 — 15 дней. Такой же клинический эффект был получен от применения НМГ в виде "Enoxaparin" в дозе 40 мг (4000 анти-Ха сд.) 1 раз в день.
Схема применения низкомолекулярного и обычного гепарина
Профилактические дозы |
Лечебные дозы |
НМГ 5000 – 7500 анти Ха ед.: I способ: 10 – l2 дней послеоперационного периода |
НМГ 175 – 200 анти-Ха ед. на I кг массы I раз в день подкожно+обычный гепарин 20000 – 30 000 ЕД в\в или подкожно |
II способ: НМГ+ обычный гепарин – НМГ 25000 анти-Ха ед.+ обычный гепарин 5000 ЕД 2 раза в день 10 – 12 – 15 дней послеоперационного периода подкожно |
В период 6 мес. После операции – НМГ 5000 – 7500 анти-Ха ед. подкожно или антикоагулянты per os |
Лечение рефлюксной болезни
1. Назначение повышающих тонус нижнего пищеводного сфинктера (НПС) и прокинетических средств:
Дофаминовые антагонисты (ЦЕРУКАЛ, РЕГЛАН, МЕТОКЛОПРАМИД) по 0,01 три раза в день за ½ ч до еды и на ночь.
В 15-30% случаев экстрапирамидныые нарушения (судороги, одурманивание и др).
Средства с периферическим антидофаминовым действием: ДОМПЕРИДОН, (МОТИЛИУМ) тб.0,01. Назначается также.
ЦИСАПРИДИН (ПРЕПУЛЬСИД) тб.0,01- увеличивает использование ацетилхолина из постганглионарных нервных окончаний солнечного сплетения. Имеет преимущества перед упомянутыми препаратами. Принимается трижды в день по 0,01.
СУЛЬПИРИД (ЭГЛОНИЛ) капс.0.05, тб.0,2, амп 5% 5мл, 2мл : по 0,2-0,4 дважды; 2 мл дважды в/м.
2. Снижение повреждающих свойств регургитата.
Блокаторы Н2-рецепторов гистамина (ЛЕЦЕДИЛ (фамотидин) 0,04-0,08 на 1-2 приема после еды и на ночь.
Селективные М1-холинолитики (ПИРЕНЗЕПИН (гастроцепин) по 1 табл 2-4 раза в день).
Блокаторы протоновой помпы обкладочных клеток (ОМЕПРАЗОЛ – по 40 мг однократно утром в течение 4-6 недель, затем поддерживающая доза в течение 2 лет 20 мг).
3. Защита слизистой пищевода.
СУКРАЛЬФАТ по 1 г трижды в день за ½ ч до еды и на ночь 4- 6 недель).
Гельсодержащие препараты (ФОСФАЛЮГЕЛЬ по 1-2 пак. После еды и на ночь; ремагель и др.).
Противовоспалительная терапия.
Кетонал (кетопрофен):
одна капсула (50 мг) утром и днем и две капсулы вечером
одна таблетка форте (100 мг) 3 раза в сутки во время еды
одна таблетка ретард 2 раза в сутки
1-2 свечи в сутки
1-2 внутримышечных инъекции в сутки
крем наносится 3-4 раза в сутки.
Лечение запоров функционального генеза
1. Свечи с глицерином или масляные клизмы (50-100 мл подсолнечного масла) на ночь.
2. Плавание, пешеходные или лыжные прогулки.
3. Психоанализ, библиотерапия, музыкотерапия.
4. Назначение пищевых волокон (порошок морской капусты, пшеничные отруби, гречневая и пшеничная крупа, пшеничный хлеб из муки грубого помола, сухие овощи и фрукты).
А. Пшеничные отруби сначала по 1-2 чайные ложки в день, запивая их крутым кипятком или кефиром. При отсутствии эффекта и метеоризма постепенно доводят их количество до 3-6 столовых ложек (30-60 г) за сутки и больше. Принимать за 3 ч до приема пищи. Одновременно необходим прием большого количества жидкости.
Б. Порошок морской капусты – то же самое, но количество не превышает 6-7 чайных ложек за сутки.
В случае метеоризма принимать овощные соки (капустный, морковный, свекольный), кислые фрукты, растительное масло, курага, бананы, изюм, тыква.
5. Сидячие ванны температуры 28-30 град с одновременным самомассажем живота по 3-5 мин через день.
6. Если отсутствует эффект в течение 3-4 мес то прибегнуть к легким слабительным, начиная с 1-2 ложек вазелинового масла в сутки курсами по 7-12 дней с перерывами между ними.
Если отсутствует эффект то применить сорбит, ксилит (100 мл 10-20% раствора в сутки) или минеральную воду со слабо послабляющим действием (моршинская Б или Б1, ижевская), соль «Барбара». Можно растительные слабительные (корень ревеня 1-2 табл. на ночь и др).
7. Пиридостигмин (местинон) – антихолинэстеразное средство –по 60 мг 1-4 раза в день.
8. При нефээективности лечения в течение 1,5-2 лет ставят вопрос об оперативном лечении (цекоректальный анастомоз или сочетание его с левосторонней гемиколэктомией).
1 Приводится из элктронного издания «Абдоминальная эндоскопическая хирургия». Т.4. Издательство Кордис & Медиа.- Под ред. акад Г.И. Воробьева
2 Отделение проктологии РОНЦ (дир. – акад АМН РФ Н.Н. Трапезников), Москва.
3 Идея Travers .- Senn N. Classic articlesin colonic and rectal surgery: Dis. Col. Rect.- 1985.- Vol. 28.- P. 135-140.
4 /media/consilium/00_04c/10.shtml :: Monday, 27-Nov-2000 21:37:49 MSK
5 Варикозная болезнь вен нижних конечностей. Стандарты диагностики и лечения. Москва 2000
