
- •Классификация электрохимических методов по признаку природы источника электрической энергии в системе
- •Электродный потенциал при протекании через него электрического тока . Поляризация электрода Поляризационные кривые.
- •Измерение эдс е химических источников тока. Измерение равновесных электродных потенциалов φ.
- •Кондуктометрический анализ, кондуктометрическая ячейка, постоянная кондуктометрической ячейки.
- •Обработка результатов измерений, полученных методом прямой потенциометрии, с целью определения концентрации анализируемого иона
- •Более простое и краткое изложение материала
- •Измерение электродных потенциалов
- •Электрохимические методы анализа
- •Потенциометрия
- •Потенциометрическое титрование
- •Кондуктометрия. Кондуктометрическое титрование
- •Кулонометрия. Кулонометрическое титрование
Вопросы и ответы к экзамену по ИМА (Часть 1. ЭХ). 12.12.12. Источники:
1. Аналитическая химия. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа: Учеб. для вузов/Ю.Я.Харитонов. - 4-е изд., стер.-М.: Высш. шк., 2008.
2. Инструментальные методы химического анализа/Г.Юинг.- М.: Мир, 1989.
3. Химия в действии. В 2-х ч. Ч.1/М. Фримантл.-М.: Мир, 1991.
4. Основы аналитической химии. В 2 кн. Кн. 2. Методы химического анализа: Учеб. для вузов/Ю.А.Золотов, Е.Н.Дорохова и др./Под ред. Ю.А.Золотова. – 3-е изд., перераб. И доп.- М.: Высш. шк., 2004.
Электрохимическая система (ячейка) – это сосуд с электропроводящим анализируемым раствором, в который погружены электроды.
Электрохимические процессы – такие процессы в электрохимической системе, которые сопровождаются одновременным протеканием химических реакций и изменением электрических свойств электрохимической системы.
Электрохимические методы химического анализа основаны на электродных реакциях и на переносе электричества через растворы. Базируются на использовании зависимостей величин измеряемых электрических параметров электрохимических процессов (разность потенциалов U электродов, сила тока I между электродами, электрическое сопротивление раствора R, количество электричества q, зависящее от концентрации C определяемого вещества, содержащегося в анализируемом растворе и участвующего в данном электрохимическом процессе.
Классификация электрохимических методов химического анализа. Аналитические сигналы. [1] С.446.
Классификация электрохимических методов по признаку природы источника электрической энергии в системе
а)
Методы
без наложения внешнего (постороннего)
потенциала.
Источником
электрической энергии служит сама
электрохимическая система, представляющая
собой гальванический элемент
(гальваническую цепь). К таким методам
относятся потенциометрические
методы. Электродвижущая
сила Е
и электродные потенциалы
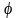 в
такой системе зависят от концентрации
С
определяемого вещества в растворе.
в
такой системе зависят от концентрации
С
определяемого вещества в растворе.
б) Методы с наложением внешнего (постороннего) потенциала. К таким методам относятся:
кондуктометрический анализ – основан на измерении удельной электрической проводимости κ растворов в функции от их концентрации;
вольтамперометрический анализ – основан на измерении силы тока I, протекающего в электрической цепи, как функции приложенной к электродам известной разности потенциалов и концентрации раствора;
кулонометрический анализ – основан на измерении количества электричества, прошедшего через раствор, как функции его начальной концентрации;
электрогравиметрический анализ – основан на измерении массы продукта электрохимической реакции, осажденного на электроде.
Классификация электрохимических методов по признаку способа применения электрохимических методов. Различают прямые и косвенные методы.
а) Прямые методы. Измеряют электрохимический параметр как известную функцию концентрации раствора и по показанию соответствующего измерительного прибора находят концентрацию определяемого вещества в растворе.
б) Косвенные методы – это методы титрования, в которых точку эквивалентности находят на основании измерения электрических параметров системы.
По этому признаку различают, например, прямую кондуктомерию и кондуктометрическое титрование, прямую потенциометрию и потенциометрическое титрование и т.д.
Единицы измерения электрических величин: сила тока I, количество электричества q, напряжение U, электрический потенциал электрода, электрическое сопротивление R раствора, удельное электрическое сопротивление ρ раствора, удельная электропроводность раствора κ = 1/ρ. Энергия (работа) А. Мощность N. Размерности. [I] = А, [q] = Кл, [U] = В, [ ] = В, [R] = Ом, [ρ] = Ом ∙ м, [κ] = Ом-1 ∙м-1, [энергия] = Дж, [мощность] = Дж/с (Вт).
Электрический потенциал в некоей точке пространства равен работе, совершаемой при переносе положительного заряда из этой точки в другую, с электрическим потенциалом = 0. Единица измерения электрического потенциала в системе СИ – В. (Единица измерения работы 1 Дж = 1 Кл ∙1 В = 1 А ∙ 1 с ∙ 1 В)
Внесистемная единица количества электричества Фарадей (1Ф = 96480 Кл). Постоянная Фарадея (F = 96485 Кл/моль). Размерности. [F] = Кл/(моль электронов). F = NА ∙ e. NА = 6.022 ∙1023 моль-1. Задача. Определите заряд электрона.
Схема электрохимической ячейки – электролизера. Схема электрохимической ячейки - гальванического элемента. Анод, катод, направление протекания электрического тока во внешней цепи электрохимической ячейки, анодная и катодная полуреакции.
Краткая запись цинк-медного гальванического элемента обозначается так:
Zn(тв) | Zn2+(водн) || Cu2+(водн) | Сu(тв)
Принято указывать полуэлемент с катодом (положительный электрод) в правой части такой записи. В этом полуэлементе происходит восстановление. Следовательно, запись
Cu2+(водн) | Сu(тв) означает протекание полуреакции
Cu2+(водн) + 2е = Сu(тв).
Полуэлемент с анодом (отрицательный электрод) указывают в левой части краткой записи. В этом полуэлементе происходит окисление. Следовательно, запись Zn(тв) | Zn2+(водн) означает протекание полуреакции Zn(тв) = Zn2+(водн) + 2е.
Один и тот же полуэлемент может быть указан в правой части одних ГЭ и в левой - других ГЭ. Это зависит от электродного потенциала данного полуэлемента и от электродного потенциала другого (соседнего).
Равновесный
электродный потенциал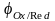 .
Стандартный
равновесный электродный потенциал
.
Стандартный
равновесный электродный потенциал
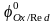 .
Потенциалопределяющие ионы. Зависимость
равновесного электродного потенциала
от активностей потенциалопределяющих
ионов. Задание. Запишите уравнение
Нернста для полуреакции MnO4-/Mn2+.
.
Потенциалопределяющие ионы. Зависимость
равновесного электродного потенциала
от активностей потенциалопределяющих
ионов. Задание. Запишите уравнение
Нернста для полуреакции MnO4-/Mn2+.
