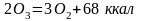- •Содержание
- •Введение
- •1. Основные свойства продуктов электролиза воды и веществ, применяемых при электролизе
- •1.1 Газы
- •1.2 Щелочи и их водные растворы
- •1.3 Общие сведения о процессе электролиза
- •1.4 Энергетический баланс ячейки
- •1.5 Перенапряжение выделения водорода и кислорода
- •1.6 Цепное самовоспламенение
- •2 Особенности использования водородно-кислородного пламени при газопламенной обработке металлов
- •3 Основные элементы конструкции электролизеров
- •3.1 Общие сведения о электролизерах
- •3.2 Электролизеры для получения смеси кислорода и водорода
- •4. Детонационное нанесение покрытий
- •5. Материальный баланс электролизера
- •6. Расчет конструктивных параметров газопламенной горелки
- •Заключение
- •Список используемых источников
Содержание
Введение 3
1. Основные свойства продуктов электролиза воды и веществ, применяемых при электролизе
1.1. Газы 4
1.2. Щелочи и их водные растворы 6
1.3. Общие сведения о процессе электролиза 7
1.4. Энергетический баланс ячейки 11
1.5. Перенапряжение выделения водорода и кислорода 12
1.6. Цепное самовоспламенение 14
2. Особенности использования водородно-кислородного пламени при газопламенной обработке металлов 16
3. Основные элементы конструкции электролизеров
3.1. Общие сведения о электролизерах 19
3.2. Электролизеры для получения смеси кислорода и водорода 20
4. Детонационное нанесение покрытий 27
5. Материальный баланс электролизера 31
6. Расчет конструктивных параметров газопламенной горелки 33
Заключение 35
Список используемых источников 36
Введение
В
последние годы все чаще стали использовать
воду, как источник энергии при пайке,
сварке и резке материалов. В таких
установках вода под действием
электрического поля, разлагается на
положительно заряженные ионы водорода
(катионы водорода) и отрицательно
заряженные ионы кислорода ( анионы
кислорода) образуя гремучий газ. При
температуре выше
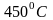 молекулы водорода и кислорода образуют
воду с выделением достаточно большого
количества энергии.
молекулы водорода и кислорода образуют
воду с выделением достаточно большого
количества энергии.
Электролиз
воды выгодно отличается от других
методов получения водорода и кислорода
простотой технологической схемы,
доступностью и дешевизной сырья – воды,
высокой надежностью в эксплуатации,
несложностью обслуживания установок.
При техническом оформлении процесса
электролиза воды возникает меньше
трудностей, чем в большинстве других
электрохимических процессов. При
изготовлении аппаратов для электролиза
воды (с использованием щелочных
электролитов) успешно применяются такие
доступные и дешевые материалы, как
углеродистая сталь и сталь, гальванически
покрытая беспористым никелем, асбестовые
ткани, паронит, обладающие высокой
устойчивостью к коррозии в промышленных
условиях электролиза
 .
.
Целью работы являлось рассмотреть: основные процессы проходящие в электролизере и на выходе горелки; патенты на электролизеры для получения гремучего газа; конструкция горелки для нанесения мелкодисперсных систем на подложку. Провести расчет производительности электролизера, и исходя из полученных данных были найдены основные геометрические размеры горелки. Рассмотреть методы нанесения порошков на обрабатываемую поверхность с помощью ударной волны, а также в газопламенном потоке, для создания адгезионного покрытия.
1. Основные свойства продуктов электролиза воды и веществ, применяемых при электролизе
1.1 Газы
Водород
– самый легкий из газов, не имеет цвета
и запаха, легко воспламеняется и горит
синеватым, мало светящимся пламенем.
При охлаждении водорода ниже
 под давлением около
под давлением около
 он конденсируется в очень легкую (в
он конденсируется в очень легкую (в
 раз легче воды) прозрачную, бесцветную,
легкоподвижную жидкость, не проводящую
электричество и обладающую небольшим
поверхностным натяжением. При охлаждении
до
раз легче воды) прозрачную, бесцветную,
легкоподвижную жидкость, не проводящую
электричество и обладающую небольшим
поверхностным натяжением. При охлаждении
до
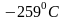 образуется твердый водород - белая
пенообразная масса, плотность которой
в 12 раз меньше, чем воды.
образуется твердый водород - белая
пенообразная масса, плотность которой
в 12 раз меньше, чем воды.
Водород может отдавать электрон с образованием положительного иона (в этом случае по свойствам он подобен ионам щелочных металлов) или присоединять один электрон, превращаясь в отрицательный ион.
При действии вольтовой дуги или пропускании водорода через зону электрического разряда молекулярный водород диссоциирует на атомы, которые при снижении температуры соединяются в молекулы. Причем образование молекул быстрее происходит на поверхности металлов, чем в объеме газа. Реакция диссоциации молекулы водорода эндотермична и протекает с большим поглощением тепла:
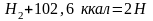
Заметная
термическая диссоциация начинается
при
 и усиливается с повышением температуры.
и усиливается с повышением температуры.
Явление
термической диссоциации молекул водорода
и преимущественное соединение атомов
в молекулу
 на поверхности металлов используется
в процессе атомно-водородной сварки.
на поверхности металлов используется
в процессе атомно-водородной сварки.
Водород
отличается значительно большей скоростью
диффузии по сравнению с другими газами.
При повышенных температурах и давлениях
водород диффундирует в металлы. Наибольшее
количество водорода поглощает палладий,
который не только адсорбирует, но и
растворяет
.
В палладий водород проникает уже при
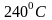 ,
диффузия водорода в мягкое железо
значительна при
,
диффузия водорода в мягкое железо
значительна при
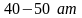 и температуре около
и температуре около
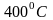 .
Поглощение водорода многими металлами
увеличивается с повышением температуры
и давления. При охлаждении металла и
снижении давления большая часть
поглощенного водорода выделяется.
Количество адсорбируемого водорода
зависит от структуры поверхности
металла. Металлический порошок поглощает
водорода больше, чем сплавленный,
вальцованный или кованный металл. При
поглощении водорода могут изменяться
твердость, термическая стойкость,
текучесть, электропроводность, магнитные
и другие свойства металлов и сплавов.
Для уменьшения диффузии водорода в
металлы при повышенных давлениях и
температурах обычно применяют легированные
стали, содержащие хром, молибден, ванадий,
вольфрам и другие легирующие металлы.
.
Поглощение водорода многими металлами
увеличивается с повышением температуры
и давления. При охлаждении металла и
снижении давления большая часть
поглощенного водорода выделяется.
Количество адсорбируемого водорода
зависит от структуры поверхности
металла. Металлический порошок поглощает
водорода больше, чем сплавленный,
вальцованный или кованный металл. При
поглощении водорода могут изменяться
твердость, термическая стойкость,
текучесть, электропроводность, магнитные
и другие свойства металлов и сплавов.
Для уменьшения диффузии водорода в
металлы при повышенных давлениях и
температурах обычно применяют легированные
стали, содержащие хром, молибден, ванадий,
вольфрам и другие легирующие металлы.
В
обычных условиях при комнатной температуре
молекулы водорода малоактивны. Реакционная
способность водорода значительно
возрастает при нагревании, под действием
света, электрической искры и электрического
разряда. В момент выделения, в присутствии
катализаторов, под воздействием
элементарных частиц атомного распада.
Водород вступает в химические соединения
со многими элементами. На воздухе и в
чистом кислороде водород сгорает,
образуя воду. При отношении
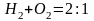 образуется гремучая смесь, взрывающаяся
при пропускании электрической искры
или поджигании. В присутствии катализаторов
(платина, никель, железо и др.)
водородо-кислородная смесь взрывается
при незначительном нагревании. Смеси
водорода с кислородом и воздухом
взрывоопасны в широком интервале
концентраций
.
образуется гремучая смесь, взрывающаяся
при пропускании электрической искры
или поджигании. В присутствии катализаторов
(платина, никель, железо и др.)
водородо-кислородная смесь взрывается
при незначительном нагревании. Смеси
водорода с кислородом и воздухом
взрывоопасны в широком интервале
концентраций
.
Скорость
распространения взрывной волны в
гремучей смеси
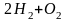 ,
по опытным данным, составляет
,
по опытным данным, составляет
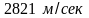 ,
по расчетным данным достигает
,
по расчетным данным достигает
 .
.
Кислород является одним из самых активных химических элементов. Во избежание возможности взрыва (особенно при повышенном давлении) необходимо предотвращать контакт кислорода с органическими и легкоокисляющимися веществами.
Под
действием тихого электрического разряда
или ультрафиолетовых лучей кислород
частично превращается в озон
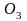 .
В небольших количествах озон образуется
вместе с кислородом в некоторых
электрохимических производствах. Жидкий
озон легко взрывается. При обычной
температуре он довольно устойчив, но
при нагревании легко разлагается,
превращаясь в кислород по реакции:
.
В небольших количествах озон образуется
вместе с кислородом в некоторых
электрохимических производствах. Жидкий
озон легко взрывается. При обычной
температуре он довольно устойчив, но
при нагревании легко разлагается,
превращаясь в кислород по реакции: