
- •Рекомендовано до друку
- •Укладачі: с. Мягкота, х. Василів, м. Марків, я. Білий, п. Панасюк, о. Кушнір, о. Вовк, т. Куречко
- •Визначення питомої потужності електричної лампи
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •III. Хід роботи
- •Контрольні питання
- •Вивчення тонкої лінзи
- •І. Теоретичні відомості
- •III. Хід роботи
- •IV. Завдання науково-дослідного характеру
- •Контрольні питання
- •Вивчення аберацій лінз
- •І. Теоретичні відомості
- •II. Хід роботи
- •Контрольні питання
- •Визначення числової апертури та роздільної здатності мікроскопа
- •І. Опис приладів і методика вимірювання
- •Іі. Завдання
- •III. Хід роботи
- •Контрольні питання
- •Визначення радіуса кривизни лінзи за допомогою кілець ньютона
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Визначення довжини світлової хвилі за допомогою біпризми френеля
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Визначення сталої дифракційної гратки та довжини світлової хвилі
- •І. Теоретичні відомості
- •Ііі. Завдання
- •IV. Хід роботи Завдання 1. Визначення сталої дифракційної гратки
- •Завдання 2. Визначення довжини світлової хвилі
- •Контрольні питання
- •Визначення довжини хвилі випромінювання оптичного квантового генератора
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Вивчення основних явищ поляризації на приладі норенберга
- •I. Теоретичні відомості
- •Іі. Завдання
- •Ііі. Хід роботи
- •Контрольні питання
- •Вивчення явищ обертової поляризації світла
- •І. Теоретичні відомості
- •Іі .Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Дослідження режимів газового розряду у ртутно-кварцовій лампі
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Визначення концентрації розчинів за допомогою фотоелектричного колориметра-нефелометра фек-56
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •III. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Вивчення характеристик фотоелементів
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •III. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Вивчення магнітного обертання площини поляризації
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •III. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Визначення вольт-амперних і світлових характеристик фотоопору
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •III. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Визначення концентрації розчину цукру за допомогою рефрактометра
- •І. Теоретичні відомості
- •Іі .Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Визначення сталої стефана-больцмана
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Визначення коефіцієнта поглинання твердих тіл
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Градуювання спектроскопа та визначення довжин хвиль спектральних ліній досліджуваної речовини
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Визначення показника заломлення прозорих твердих тіл за допомогою мікроскопа
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Вивчення водневих спектрів та визначення сталої рідберга
- •І. Теоретичні відомості
- •Спектр водню і будова атома водню. Енергетичні рівні в атомі водню.
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Визначення сталої планка за спектром водню
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Вивчення взаємодії радіоактивного -випромінювання з речовиною
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні питання
- •Вивчення взаємодії радіоактивного -випромінювання з речовиною та вивчення його кількісних характеристик
- •І. Теоретичні відомості
- •Іі. Опис приладів і методика вимірювання
- •Ііі. Завдання
- •IV. Хід роботи
- •Контрольні запитання
- •Бібліографічний список
- •Додаток
Іі. Опис приладів і методика вимірювання
Спостереження спектральних ліній і вимірювання довжин хвиль виконується на монохроматорі зі скляною оптикою.
Спектр випромінювання є важлива характеристика речовини, яка дозволяє встановити її склад, деякі характеристики її будови, властивості атомів і молекул. Атоми газів випромінюють лінійчасті спектри, які складаються з груп окремих спектральних ліній, що називаються спектральними серіями. Найпростіший спектр є у атома водню. Довжини хвиль його спектральних ліній визначаються за формулою Пальмера-Рітца:
![]() = R (1/n12
– 1/n22), (12)
= R (1/n12
– 1/n22), (12)
де - довжина хвилі, R – стала Рідберга, n1 – номер енергетичного рівня атома, на який здійснюється перехід електрона після випромінювання, n2 – номер рівня, з якого переходить електрон при випромінюванні атомом електромагнітної енергії.
Ііі. Завдання
1. Визначити довжину хвилі чотирьох найбільш яскравих ліній спектра атомарного водню та, користуючись формулою Пальмера-Рітца, визначити сталу Ридберга.
IV. Хід роботи
Встановити трубку з воднем перед вхідним отвором монохроматора.
Зняти відліки по барабану приладу для чотирьох найбільш яскравих ліній спектра атомарного водню. Результати вимірювань занести в табл. 1. З графіка визначити довжину хвиль.
За формулою (12) обчислити чотири значення сталої Рідберга. Знайти середнє значення сталої.
Звітна таблиця 1

Контрольні питання
На чому ґрунтується спектральний метод дослідження речовин?
Як формулюються перший та другий постулати Бора?
Як сформулювати та записати умову квантування моменту імпульсу?
Яка формула n-го радіуса стаціонарної орбіти атома?
За якими формулами визначаються кінетична та потенціальна енергії електрона в атомі водню?
За якою формулою визначається повна енергія електрона в атомі водню?
Яка формула Бора для частоти випромінювання (поглинання) світла електроном при його переході з одного стаціонарного рівня на інший?
Що таке спектральна серія?
Як отримати серії Лаймана, Бальмера, Пашена?
Яка воднева серія знаходиться у видимій області і спостерігається в цій роботі?
Як побудувати дисперсійну криву?
Лабораторна робота № 121
Визначення сталої планка за спектром водню
Прилади і матеріали: спектроскоп, установка з гелієвою та водневою трубками.
Мета роботи: оволодіти методикою визначення сталої Планка.
І. Теоретичні відомості
Пропустимо світло від розжареного твердого або рідкого тіла через скляну тригранну призму. На екрані за призмою отримаємо суцільну кольорову смугу. Цю картину називають суцільним (неперервним спектром). Якщо джерелом світла є розжарений газ або пара, що перебувають в атомарному або в іншому стані, то одержимо кілька яскравих ліній на темному фоні. Такий спектр називають лінійчастим. Якщо джерелом світла є розжарені гази або пара, що перебувають у молекулярному стані, одержимо смугастий спектр. Він складається з окремих смуг, розділених темними проміжками. Природу спектрів пояснює тільки квантова теорія.
Розглянемо лінійчасті спектри, утворення яких вперше теоретично пояснив Нільс Бор. Теорія Бора для атома водню та водневоподібних атомів ґрунтується на планетарній моделі будови атома за Резерфордом та двох постулатах, які суперечать законам класичної фізики. Тому теорія Бора, яка використовує закони класичної фізики, і постулати, які є положеннями квантової теорії, є напівкласичною. Сформулюємо постулати Бора:
електрон в атомі має декілька дискретних дозволених енергетичних станів (стаціонарних станів), перебуваючи в яких він не випромінює і не поглинає енергії;
випромінювання і поглинання енергії може відбуватися тільки при переході електрона з одного стаціонарного рівня Е1 на інший Е2. При цьому енергія фотона h, який випромінюється або поглинається, дорівнює різниці енергій початкового і кінцевого станів (рис.1):
![]()
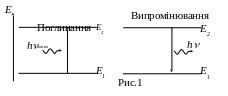 . (1)
. (1)
З усіх можливих
орбіт електрона стаціонарним станам
відповідають ті, для яких момент імпульсу
кратний числу
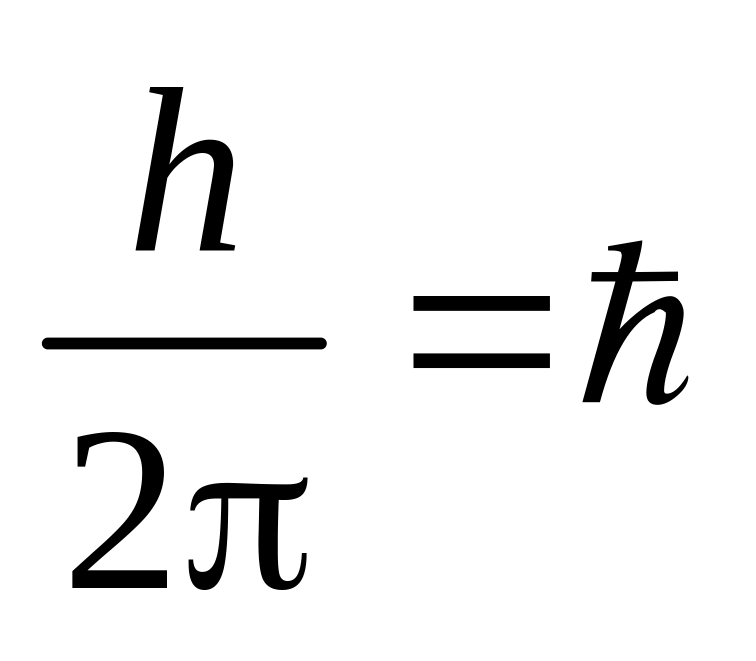 .
Тому умова квантування орбіт запишеться
як
.
Тому умова квантування орбіт запишеться
як
mr = n, (2)
де m – маса електрона; – швидкість електрона; r – радіус дозволеної колової орбіти електрона; n = 1, 2, 3, ... – головне квантове число. Оскільки між негативно зарядженим електроном та позитивно зарядженим ядром діє сила кулонівського притягання, для доцентрової сили (у вакуумі) з другого та третього законів Ньютона отримаємо:
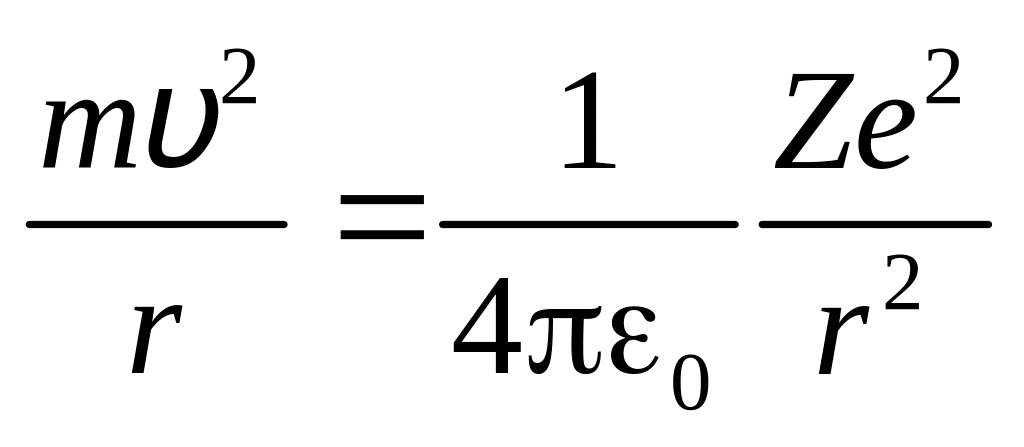 , (3)
, (3)
де Ze – заряд ядра, е – заряд електрона; – швидкість електрона; 0 – діелектрична стала. З (2) і (3) знайдемо швидкість електрона на стаціонарній орбіті:
. (4)
Підставивши (4) у (2), знайдемо радіус n-ї орбіти:
. (5)
Тоді повна енергія електрона на n-му рівні у воднеподібній системі складається із його кінетичної енергії (m2/2 = Ze2/(80r)) та потенціальної енергії в електростатичному полі ядра (–Ze2/(40r)):
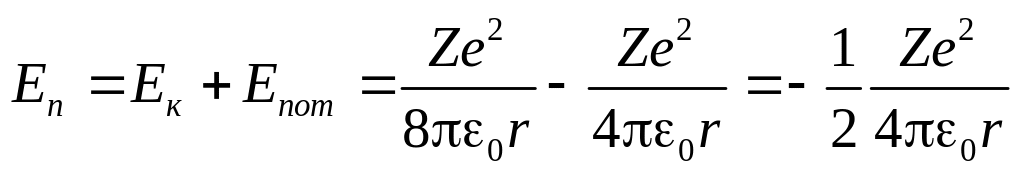 . (6)
. (6)
Врахувавши квантовані значення радіуса для n-ї орбіти електрона (5), отримаємо:
. (7)
Знак “–“ означає, що електрон перебуває у зв’язаному стані. Зазначимо ще раз, що ціле число n, яке у (7) визначає енергетичні рівні атома, називається головним квантовим числом. Енергетичний стан з n = 1 є основним (нормальним, незбудженим) станом, стани з n > 1 – збудженими. Енергія, що відповідає основному станові атома водню (Z = 1, n = 1) дорівнює –13,55 еВ. Це енергія, яку необхідно надати електронові, щоб вивести його за межі атома. Тому її ще називають енергією іонізації.
Користуючись правилом частот Бора (1), визначимо частоту світлової хвилі, яка випромінюється атомом при переході з вищого рівня (n = ni) на нижчий (n = nk):
 , (8)
, (8)
або , (9)
де – стала Рідберга. Перехід електрона на перший енергетичний рівень (nk = 1, ni = 2, 3, 4,…) утворює серію Лаймана; на другий (nk = 2, ni = 3, 4, 5,…) - серію Бальмера; на третій (nk = 3, ni = 4, 5, 6,…) - серію Пашена. Група спектральних ліній з однаковим nk, тобто при переходах електронів на один і той же рівень, називається спектральною серією.
Серія Бальмера
лежить у видимій ділянці спектра. Для
обчислення сталої Планка h
за спектром
водню використаємо (9), врахувавши, що
![]() ,
а Z = 1:
,
а Z = 1:
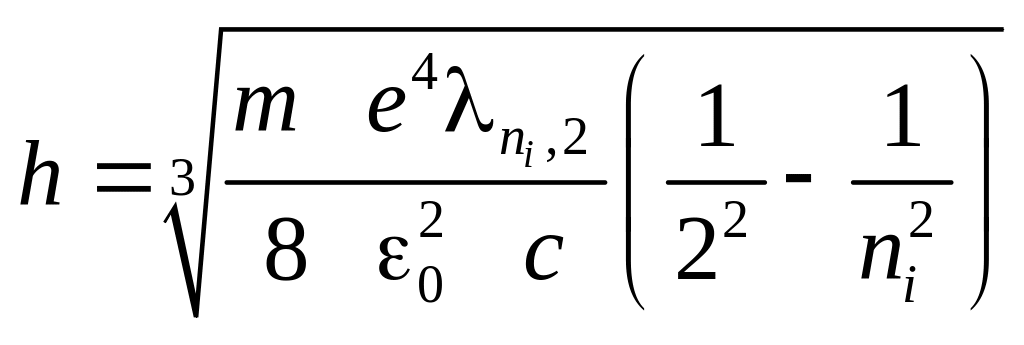 ,
(10)
,
(10)
де m = 9,110-31 кг, е = 1,610-19 Кл, 0 = 1,610-19 Ф/м, с = 3108 м/с. Формула (10) є робочою для обчислення сталої Планка. Отже, для обчислення сталої Планка h треба мати довжину хвилі (у даному випадку ту, яка відповідає переходу з третьої орбіти на другу – 32 (H - червона лінія); з четвертої орбіти на другу – 42 (H - зелено-голуба лінія); з п’ятої орбіти на другу – 52 (H – синя лінія)). Ці лінії найбільш яскраві у спектрі водню.
