
- •Физика сабағының түрлерi
- •Физика сабақтарын жоспарлау
- •Физика пәнi, оның мазмұнының құрылымы
- •Физика пәнi мазмұнының құрылымы
- •Физика пәнiнiң мазмұнын анықтаудың актуальды мәселелерi
- •Оқыту әдiстерiнiң ғылыми негiздерi
- •Физиканы оқыту әдiстерiнiң түрлерi
- •Информациялық-репродуктивтi әдiс
- •Iздену- эвристика әдiсi
- •Физиканы оқытуды жандандыру әдiстерi
- •Бiлiмдi бағалаудың ғылыми негiздерi
- •Бiлiмдi бағалайтын көп сатылы сүлбенiң негiзгi қағидалары
- •Тест әдiсi
- •Механика курсының негiзгi ұғымдарын қалыптастыру әдiстемесi. Кинематика ұғымдары
- •Механика курсының негiзгi ұғымдарын қалыптастыру әдiстемесi. Динамика ұғымдары
- •Сақталу заңдары
- •Молекулалық физика курсының әдiстемелiк мәселелерi
- •Молекулалық физика курсының әдiстемелiк мәселелерi
- •Электрдинамика ұғымдарын қалыптастыру мәселелерi
- •Тербеліс пен толқындар теориясының әдістемелік сұрақтары
- •Атом ядросы және элементар бөлшектер физикасы бөлiмiнiң мазмұнына әдiстемелiк талдау
- •Астрономияның негізгі бөлемдерін оқыту ерекшіліктері
Молекулалық физика курсының әдiстемелiк мәселелерi
Термодинамикалық сипаттамалар. Термодинамиканың бірінші және екінші заңдары. Энтропия. Фазалық көшулер.
Жылу, жұмыс, iшкi энергия ұғымдары тәжрибелiк тұжырым - термодинамиканың бiрiншi заңымен байланысқан:
![]() .
(1)
.
(1)
Мұндағы
![]() - жүйеге берiлген жылу мөлшерi,
- жүйеге берiлген жылу мөлшерi,
![]() - жүйенiң ұлғаюы нәтижесiндегi жұмыс, U
- iшкi энергия. Егер жұмыс сыртқы күштер
арқылы жасалса
- жүйенiң ұлғаюы нәтижесiндегi жұмыс, U
- iшкi энергия. Егер жұмыс сыртқы күштер
арқылы жасалса
![]() (1) формула былай жазылады
(1) формула былай жазылады
![]() .
(2)
.
(2)
Бұл үш физикалық шаманың өлшем бiрлiгi бiрдей, бәрi Дж - мен өлшенедi. Мағыналарының өзгешелiгi (1) - формуладан көрiнiп тұр: жылу, жұмыс туралы тек процестiң микроскопиялық параметрлерiнiң өзгерiсiнiң нәтижесiн ғана айтуға болады ( – айырымды бiлдiредi), ал iшкi энергия – күй функциясы болып табылады.
Физиканы оқыту тәжрибесiнде мынандай ескертпелер бар. Жүйеде берiлген жұмыс бар деп айтуға болмайды. Белгiлi мөлшерде жылу берiлдi, жұмыс жасалды деп айтылады. Әдетте “белгiлi энергия берiлдi, немесе, жоғалды” деп айтылады. Бұл да дәл емес. ”Молекулалар қозғалысының белгiлi энергиясы берiлдi (жоғалды)” деп айтуға болады. Энергия өздiгiнен пайда болмайды, берiлмейдi, ол тек материяның қозғалысының сипаттамасы.
Термодинамиканың І заңы жылу процестердің бағытын белгілемейді. Бірақ, тәжірибе көрсеткендей, көпшілік жылу процестер тек бір бағытпен өтеді. Мұндай процестер қайтымсыз деп айтылады. Мысалы, температуралары әр түрлі екі дененің жылу байланысындағы жылу ағыны жылуы көп денеден салқын денеге қарай бағытталған. Ешқашан температурасы төмен денеден температурасы жоғары денеге қарай өздігімен жылу беру процесі жүрмейді. Сондықтан, температура соңғы айырымды жылуалмасу процесі қайтымсыз болады. Қайтымды процесс деп жүйе бір тепе-тең күйден екінші күйге өтетін процесті айтады, бұл кезде осындай да аралық тепе-тең күйлер тізбегінен процесті кері қарай өткізуге болады. Барлық реалды процестер қайтымсыз, бірақ олар қайтымды процестерге әлде де өте жақындау мүмкін. Қайтымды процестер реалды процестердің асқақ атауы. Термодинамиканың І заңы қайтымды процестерді қайтымсыздан айырылмайды. Ол тек термодинамикалық процестен белгілі энергетикалық балансты талап етеді және мұндай процесс болатынын немесе болмайтынын туралы ештеңе айтпайды. Өз бетімен өтетін процестердің бағытын термодинамиканың ІІ заңы анықтайды. Оны белгілі бір термодинамикалық процестердің түріне тыйым салу ретінде тұжырымдауға болады. 1851 жылы ағылшын физигі У. Кельвин термодинамиканың ІІ заңын былай жазды: Циклмен жұмыс жасайтын жылу машинасында тек бір ғана жылу резервуарынан алынған барлық жылу мөлшерін механикалық жұмысқа ауыстыратын процесс өткізілмейді. Осындай процесс болу мүмкін гипотезалық жылу машинасын «екінші текті мәңгі қозғалтқыш» деп атайды. Неміс физигі Р. Клаузиус термодинамиканың ІІ заңға келесі тұжырымдама берді: температурасы төмен денеден температурасы жоғары денеге жылуалмасу жолымен энергия жіберу тек бір ғана нәтижесі ретінде болатын процесс өтпейді. 1-суретте термодинамиканың екінші заңмен тыйым салынған, бірақ бірінші заңмен рұқсат процестер бейнеленген.
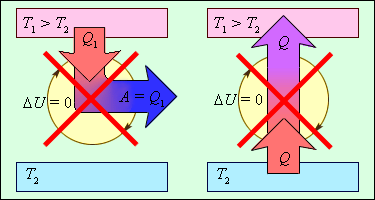
1-сурет. Екінші заңмен тыйым салынған, бірақ бірінші заңмен рұқсат процестер: 1 – «екінші текті мәңгі қозғалтқыш»; 2 – салқын денеден жылы денеге өз бетімен өтетін жылу процесі («идеалды тоңазатқыш машина»).
Энтропия - қазiргi ғылымдағы ең iргелi, универсалды ұғым. Физика заңдылықтары түбiнде белгiлi физикалық шамалардың сақталу заңдарымен байланысты. Энтропия реалды процестерде сақталмайды, ол не өседi, не азаяды. Термодинамика курсында энтропияның дифференциалы мына түрде анықталады:
![]() ,
(3)
,
(3)
мұндағы
![]() - жылу мөлшерiнiң дифференциалы,
- жылу мөлшерiнiң дифференциалы,
![]() -
температура. Бұл формула тек тұйықталған
(сыртқы ортамен ешқандай байланыс жоқ)
жүйе үшiн дұрыс. Тұйықталған жүйе үшiн
1-күйден 2-күйге өткендегi энтропия
айырымы термодинамикалық теория бойынша
Клаузиус теңсiздiгiмен анықталады:
-
температура. Бұл формула тек тұйықталған
(сыртқы ортамен ешқандай байланыс жоқ)
жүйе үшiн дұрыс. Тұйықталған жүйе үшiн
1-күйден 2-күйге өткендегi энтропия
айырымы термодинамикалық теория бойынша
Клаузиус теңсiздiгiмен анықталады:
![]() .
(4)
.
(4)
Алайда
(3), (4) формулалар көптеген физикалық
маңызды сұрақтарға жауап бермедi. Мысалы,
(3) формула бойынша энтропияны қалай
өлшеуге болатындығы белгiсiз (
шамасының температура айырымы болғанда
ғана мағынасы бар, ал формуладағы
![]() ретiнде
қандай температураны қабылдауға
болатындығы белгiсiз). Сондықтан (3)
формулаға негiзделген энтропия өлшейтiн
құрал (“энтропометр”) жоқ. (4) формула
бойынша тұйықталған жүйеде энтропияның
реалды жағдайларда өсу себебi осы күйге
дейiн белгiсiз болып келдi, бұл сұрақты
бiз жоғарыда қарастырған “динамикалық
хаос“ деп аталатын ғылымның жаңа саласы
бiраз айқындады.
ретiнде
қандай температураны қабылдауға
болатындығы белгiсiз). Сондықтан (3)
формулаға негiзделген энтропия өлшейтiн
құрал (“энтропометр”) жоқ. (4) формула
бойынша тұйықталған жүйеде энтропияның
реалды жағдайларда өсу себебi осы күйге
дейiн белгiсiз болып келдi, бұл сұрақты
бiз жоғарыда қарастырған “динамикалық
хаос“ деп аталатын ғылымның жаңа саласы
бiраз айқындады.
Энтропияның физикалық анықтамасын Больцман ұсынды:
![]() .
(5)
.
(5)
мұндағы - Больцман тұрақтысы, W - жүйедегi мүмкiн болатын микрокүйлер саны. Бұл формуланы кез-келген (тепе-теңсiз, ашық) жүйеге қолдануға болады. Сондықтан бiз осы формуланы негiзге алып, оның қазiргi ғылымда және техникада қолданылатын ыңғайлы түрiн қарастырамыз.
Температураны
”Джоуль” бiрлiгiмен өлшесек k=1,
яғни энтропия S
өлшемсiз шама болады. Тепе-тең күйде
барлық микрокүй үлесi бiрдей, яғни олардың
байқалу ықтималдығы
![]() тең.
Бұл жағдайда (5) формуладан
тең.
Бұл жағдайда (5) формуладан
![]() (6)
(6)
Екiншi жағынан, ғылымда
![]() ,
(7)
,
(7)
шамасын
информация
деп атайды. Жиi байқалатын оқиғалардың,
хабарлардың информациясы аз
![]() ,
сирек оқиғалардан көп информация алынады
,
сирек оқиғалардан көп информация алынады
![]() .
(6), (7) формулалардан шығатын маңызды
қорытынды- тепе-тең күйден ешқандай
информация жоқ, информация энтропияға
айналады
.
(6), (7) формулалардан шығатын маңызды
қорытынды- тепе-тең күйден ешқандай
информация жоқ, информация энтропияға
айналады
![]() .
Информация
тудыратын тiрi
организм, компьютерлiк
жады ылғи да тепе-теңсiз
күйде болуы тиiс.
.
Информация
тудыратын тiрi
организм, компьютерлiк
жады ылғи да тепе-теңсiз
күйде болуы тиiс.
Информация
түсiнiгi
тепе-теңсiздiктi
автоматты түрде ескередi.
Жеке сигналдың, құрылымның ықтималдығы
Рi(i1,2.)
болсын,
яғни
![]() . Информацияның орта мәнi
әр күйдiң
ықтималдығының үлесi
арқылы анықталады, және ол шама
информациялық
энтропия
деп аталады:
. Информацияның орта мәнi
әр күйдiң
ықтималдығының үлесi
арқылы анықталады, және ол шама
информациялық
энтропия
деп аталады:
![]() .
(8)
.
(8)
Информациялық энтропия (5), (7) формулалармен анықталатын термодинамикалық, физикалық энтропияның барлық қасиеттерiн қамтиды және бұл шама оңай өлшенедi.
Фазалық көшулер теориясы молекулалық физика курсындағы жаңа, әрi әдiстемелiк мәселелерi қалыптаспаған тарау. Фазалық көшулердiң көп кездесетiн мысалдары : кристалл-сұйық, сұйық-газ. Бұл процестер кезiнде сыртқы ортамен жылу алмасу болады және бұлар 1-тектi фазалық көшулер. 2-тектi фазалық көшуде сыртқы ортамен жылу алмасу болмайды, бiрақ негiзгi физикалық шамалар (энергия, көлем) температураға тәуелдi шұғыл өзгередi, сөйтiп заттың iшкi симметриясы (энтропиясы) өзгередi. Мұндай көшулердiң мысалдары : металл - асқын өткiзгiш, ферромагнетик - парамагнетик, сұйық гелий - асқын аққыш орта.
Барлық жағдайда фазалар шекаралығы шұғыл өзгеретiн, кездейсоқ қатпарланған аса күрделi бет аудан болады. Мысалы, су бетiндегi жекеленген мүз қабыршақтарының формасы сан-алуан. Бiр қарағанда мұндай күрделi объектiлердiң ешқандай заңдылығы жоқ сияқты. Бiрақ, үлкен қабыршақ кiшi қабыршаққа ұқсас, әрқайсысы жеке бөлiктерден тұрады, олардың өздерi де күрделi.
Лекция 11
