- •Сырье и основные процессы органического синтеза.
- •Метанол. Применение метанола, физико-химические основы производства.
- •Технологическая схема производства метанола.
- •Этиловый спирт. Применение, получение методом сернокислотной гидратации.
- •Получение этилового спирта методом прямой гидратации этилена. Технологическая схема.
- •Состав нефти. Важнейшие нефтепродукты.
- •Общий состав
- •Углеводородный состав
- •Элементный состав нефти и гетероатомные компоненты
- •Первичная переработка нефти. Прямая перегонка.
- •8.Классификация методов переработки нефти.
- •Термический крекинг.
- •10.Термические процессы ( пиролиз, коксование нефтяных остатков).
- •Термокаталитические процессы ( каталитический крекинг).
- •Каталитический риформинг, гидрокрекинг.
- •Химическая технология неорганических веществ (структура). Сырье.
- •Получение водорода электролизом воды.
- •Получение водорода газификацией топлив.
- •Получение водорода электролизом водного раствора хлорида натрия.
- •Конверсия метана. Классификация и химизм процессов.
- •Высокотемпературная некаталитическая конверсия метана.
- •Двухступенчатый метод конверсии метана.
- •Применение аммиака. Физико-химические основы производства.
- •Влияние температуры, давления и катализаторов на равновесие и скорость окисления аммиака.
- •Основные технологические стадии процесса синтеза аммиака.
- •Технологические схемы синтеза аммиака.
- •Основные технологические стадии производства азотной кислоты.
- •Влияние температуры, давления и катализаторов на равновесие и скорость окисления аммиака.
- •Процесс окисления оксида азота.
- •Системы производства азотной кислоты.
- •Основные технологические узлы производства азотной кислоты.
- •Свойства и применение серной кислоты. Способы получения серной кислоты.
- •Принципиальная технологическая схема получения серной кислоты из серы.
- •Классификация минеральных удобрений.
- •Получение аммиачной селитры.
- •Получение простого суперфосфата.
- •Производство кальцинированной соды.
- •1. Нейтрализация карбонатных растворов.
- •Экологические проблемы химической промышленности.
- •Классификация хтп (химико-технологических процессов).
- •Основные показатели хтп технологические ( степень превращения, селективность, выход продукта, расходные коэффициенты ).
- •Основные экономические показатели хтп ( производительность, мощность, себестоимость).
- •Основные эксплуатационные показатели хтп ( надежность, безопасность).
- •Основные социальные показатели хтп (экологическая чистота, степень автоматизации).
- •Закон сохранения вещества, как основа материальных расчетов.
- •Закон сохранения энергии, как основа тепловых расчетов.
- •Закон действующих масс.
- •Равновесный выход, зависимость его от константы равновесия.
- •Применение принципа Ле Шателье в химической технологии.
- •Скорость процессов, влияние основных факторов на скорость.
- •Уравнение Аррениуса.
- •Способы увеличения скорости химических реакций. Гомогенные процессы.
- •Гетерогенные процессы. Общая характеристика гетерогенных процессов.
- •Диффузионная и кинетическая области протекания реакций.
- •Способы увеличения скорости протекания гетерогенных реакций.
- •Примеры:
- •Закон действующих масс (к. Гульдберг, п.Вааге, 1867г.)
- •Виды схем: функциональная, технологическая и операторная схемы.
Диффузионная и кинетическая области протекания реакций.
Гетерогенная химическая реакция может протекать только в том случае, если происходит непрерывная молекулярная или конвективная диффузия реагирующих веществ к поверхности, на которой идет данная реакция, и непрерывная обратная диффузия продуктов реакции.
Скорость процесса в целом будет определяться скоростью наиболее медленной стадии. Если скорость реакции на поверхности катализатора больше скорости диффузии, то скорость процесса в целом будет определяться скоростью диффузии. Наблюдаемая макроскопическая кинетика реакции будет подчиняться уравнениям, которые можно получить, рассматривая только процессы диффузии, и, следовательно, не будет отражать истинной скорости химической реакции на поверхности катализатора. В этом случае говорят, что процесс лежит в диффузионной области. Процесс при этом чаще всего описывается уравнением реакции первого порядка, так как скорость диффузии прямо пропорциональна концентрации.
Если скорость химической реакции значительно меньше, чем скорость диффузии, то скорость процесса в целом будет определяться скоростью химической реакции. В этом случае процесс лежит в кинетической области и описывается уравнением кинетики той реакции, которая протекает на поверхности катализатора.
Если скорость диффузии и скорость химической реакции, рассмотренные независимо друг от друга, соизмеримы, то имеется переходная область. Один и тот же процесс в зависимости от условий его проведения может лежать в различных областях. Большое влияние на характер протекания гетерогенного химического процесса оказывают давления реагирующих веществ, скорости потоков, пористость катализатора и температура.
При изменении температуры на 10 °С скорость диффузии, как показывает опыт, изменяется приблизительно в 1,2 раза, а скорость химической реакции — в 3—4 раза. Поэтому при понижении температуры скорость химической реакции убывает быстрее, чем скорость диффузии, и при низких температурах процесс чаще протекает в кинетической области.
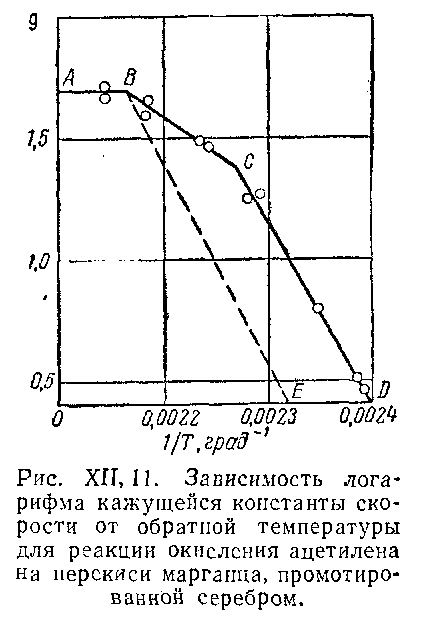
Типичная форма зависимости логарифма константы скорости гетерогенного процесса от величины обратной температуры показана на рис. XII, 11. Участок кривой АВ, отвечающий практически постоянной k (k не зависит от температуры), соответствует диффузионной области протекания процесса. Участок СD соответствует кинетической области протекания процесса. Этот участок обычно характеризуется значительной величиной энергии активации. Участок ВС соответствует переходной области. Обычно переходы из одной области в другую не так резки, как показано на рисунке, и описываются плавной кривой. Такой ход кривой наблюдается для пористых катализаторов. На кривых, характеризующих непористые поверхности, переходная область практически отсутствует. Кривая в точке В резко изменяет направление (ВЕ), характеризуя кинетическую область протекания процесса.