
- •Сырье и основные процессы органического синтеза.
- •Метанол. Применение метанола, физико-химические основы производства.
- •Технологическая схема производства метанола.
- •Этиловый спирт. Применение, получение методом сернокислотной гидратации.
- •Получение этилового спирта методом прямой гидратации этилена. Технологическая схема.
- •Состав нефти. Важнейшие нефтепродукты.
- •Общий состав
- •Углеводородный состав
- •Элементный состав нефти и гетероатомные компоненты
- •Первичная переработка нефти. Прямая перегонка.
- •8.Классификация методов переработки нефти.
- •Термический крекинг.
- •10.Термические процессы ( пиролиз, коксование нефтяных остатков).
- •Термокаталитические процессы ( каталитический крекинг).
- •Каталитический риформинг, гидрокрекинг.
- •Химическая технология неорганических веществ (структура). Сырье.
- •Получение водорода электролизом воды.
- •Получение водорода газификацией топлив.
- •Получение водорода электролизом водного раствора хлорида натрия.
- •Конверсия метана. Классификация и химизм процессов.
- •Высокотемпературная некаталитическая конверсия метана.
- •Двухступенчатый метод конверсии метана.
- •Применение аммиака. Физико-химические основы производства.
- •Влияние температуры, давления и катализаторов на равновесие и скорость окисления аммиака.
- •Основные технологические стадии процесса синтеза аммиака.
- •Технологические схемы синтеза аммиака.
- •Основные технологические стадии производства азотной кислоты.
- •Влияние температуры, давления и катализаторов на равновесие и скорость окисления аммиака.
- •Процесс окисления оксида азота.
- •Системы производства азотной кислоты.
- •Основные технологические узлы производства азотной кислоты.
- •Свойства и применение серной кислоты. Способы получения серной кислоты.
- •Принципиальная технологическая схема получения серной кислоты из серы.
- •Классификация минеральных удобрений.
- •Получение аммиачной селитры.
- •Получение простого суперфосфата.
- •Производство кальцинированной соды.
- •1. Нейтрализация карбонатных растворов.
- •Экологические проблемы химической промышленности.
- •Классификация хтп (химико-технологических процессов).
- •Основные показатели хтп технологические ( степень превращения, селективность, выход продукта, расходные коэффициенты ).
- •Основные экономические показатели хтп ( производительность, мощность, себестоимость).
- •Основные эксплуатационные показатели хтп ( надежность, безопасность).
- •Основные социальные показатели хтп (экологическая чистота, степень автоматизации).
- •Закон сохранения вещества, как основа материальных расчетов.
- •Закон сохранения энергии, как основа тепловых расчетов.
- •Закон действующих масс.
- •Равновесный выход, зависимость его от константы равновесия.
- •Применение принципа Ле Шателье в химической технологии.
- •Скорость процессов, влияние основных факторов на скорость.
- •Уравнение Аррениуса.
- •Способы увеличения скорости химических реакций. Гомогенные процессы.
- •Гетерогенные процессы. Общая характеристика гетерогенных процессов.
- •Диффузионная и кинетическая области протекания реакций.
- •Способы увеличения скорости протекания гетерогенных реакций.
- •Примеры:
- •Закон действующих масс (к. Гульдберг, п.Вааге, 1867г.)
- •Виды схем: функциональная, технологическая и операторная схемы.
Применение аммиака. Физико-химические основы производства.
Аммиак NН3 — бесцветный газ с удушливым резким запахом, действует раздражающе на слизистые оболочки. При температуре —33,19°С и атмосферном давлении аммиак кипит, а при —77,75 °С он затвердевает. Аммиак хорошо растворяется в воде. Так, при 20 °С в 1 объеме воды растворяются примерно 700 объемов газообразного аммиака, образуя водный аммиак (аммиачную воду).
При обычной температуре аммиак устойчив. При температурах выше 1200 °С происходит его диссоциация на водород и азот; в присутствии катализатора диссоциация аммиака наблюдается уже при 300 °С. Аммиак весьма реакционноспособен: с кислотами образует соли, с диоксидом углерода — карбамид; на платиноидном и некоторых других катализаторах аммиак окисляется до оксида азота.
Аммиак в основном используется для производства азотной кислоты и минеральных удобрений — аммиачной селитры, карбамида, сульфата аммония, сложных удобрений и др. Жидкий аммиак сам является высококонцентрированным азотным удобрением. Он применяется также в производстве капролактама, синильной кислоты, соды, взрывчатых веществ, при получении технических солей, используется как хладоагент. Он находит также широкое применение в органических синтезах. Смеси аммиака с воздухом при определенных условиях способны взрываться.
Согласно ГОСТ 6221—75 аммиак выпускают трех сортов:
Высший сорт 1-й сорт 2-й сорт
Аммиак, масс, %, не менее 99,96 99,9 99,6
Влага, масс. %, не более . . 0,04 0,1 0,4
Железо, мг/л, не более ... 1 2 2
Масло, мг/л, не более ... 2 8 8
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
Образование аммиака из азота и водорода протекает на катализаторе при высоких давлениях и температурах по уравнению:
ЗН2 + N2 ↔ 2NH3 + Q
Эта реакция обратима, протекает со значительным уменьшением объема (из четырех объемов водорода и азота получают два объема аммиака) и с выделением большого количества тепла. По принципу Ле-Шателье при повышении давления и понижении температуры равновесие реакции синтеза аммиака будет сдвигаться в сторону образования аммиака. При повышении давления и постоянной температуре равновесное содержание аммиака в смеси с азотом и водородом увеличивается. При известных значениях константы равновесия Кр для азотоводородной смеси стехиометрического состава, пользуясь уравнением:

можно определить равновесные концентрации аммиака при различных температурах.
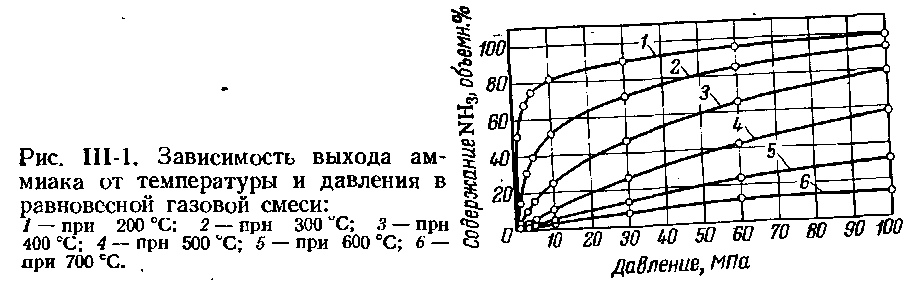
На рис. Ш-1 приведена зависимость выхода аммиака от давления и температуры равновесной газовой смеси. Если состав азотоводородной смеси, поступающей на синтез аммиака, отличается от стехиометрического, равновесные концентрации аммиака резко снижаются. Этим объясняется необходимость получения в промышленных условиях азотоводородной смеси стехиометрического состава.
В азотоводородной смеси, получаемой на промышленных установках, присутствуют так называемые инертные примеси — метан и аргон, которые не вступают в реакцию, но разбавляют азотоводородную смесь и соответственно снижают равновесную концентрацию аммиака, как это показано ниже для давления 29,4 МПа и температуры 500 °С:
Содержание инертных примесей, % ....... 0 5 10 20
Равновесная концентрация аммиака, %...... 26,4 24,0 21,6 17,7
Тепловой эффект реакции синтеза аммиака зависит от давления и температуры процесса. Ниже приведены значения теплового эффекта при различных давлениях и при температуре 500°С:
Давление, МПа..... 0,1 10 30 60 100
Тепловой эффект
кДж/кмоль . ... 49820 52040 55770 60960 68660
ккал/кмоль..... 11900 12430 13320 14560 16400
