
- •Загальна характеристика будови атома[ред. • ред. Код]
- •Електронні оболонки та орбіталі[ред. • ред. Код]
- •Властивості[ред. • ред. Код]
- •Ядерні властивості[ред. • ред. Код]
- •Маса[ред. • ред. Код]
- •Форма і розміри[ред. • ред. Код]
- •Енергетичні рівні[ред. • ред. Код]
- •Квантові переходи в атомі[ред. • ред. Код]
- •Хімічні властивості[ред. • ред. Код]
- •Аналіз і методи візуалізації[ред. • ред. Код]
- •Історія[ред. • ред. Код]
- •Натурфілософський атомізм[ред. • ред. Код]
- •Початки наукової теорії атома[ред. • ред. Код]
А́том (або не́ділка[1] від грец. άτομοσ — неподільний) — найменша, електронейтральна, хімічнонеподільна частинка хімічного елемента. Атом складається з щільного ядра з позитивно заряджених протонів та електрично нейтральних нейтронів, яке оточене набагато більшою хмарою негативно заряджених електронів. Коли число протонів відповідає числу електронів, атом електрично нейтральний; в іншому випадку це є іон, з певним електричним зарядом. Атоми класифікують відповідно до числа протонів та нейтронів: число протонів визначає хімічний елемент, а число нейтронів визначає нуклід елемента.
Утворюючи між собою зв'язки, атоми об'єднуються в молекули і великі за розміром тверді тіла.
Про існування найдрібніших частинок речовини людство здогадувалося ще з давніх часів, проте підтвердження існування атомів було отримане лише в кінці 19-го століття. Але майже одразу ж стало зрозуміло, що атоми, в свою чергу, мають складну будову, якою визначаються їхні властивості.
Концепція атома як найменшої неподільної частинки матерії вперше була запропонована на початку I тисячоліття до н. е. Мохом і популяризована Демокритом — який, власне, і запровадив в науковий обіг термін «атом». В 17-му та 18-му століттях хіміки встановили, що хімічні речовини вступають в реакції в певних пропорціях, які виражаються за допомогою малих чисел. Крім того вони виділили певні найпростіші речовини, які назвали хімічними елементами. Ці відкриття привели до відродження ідеї про неподільні частинки. Розвиток термодинаміки і статистичної фізики показав, що теплові властивості тіл можна пояснити рухом таких частинок. Врешті-решт були експериментально визначені розміри атомів.
Наприкінці 19-го та на початку 20-го століть, фізики відкрили першу з субатомних частинок — електрон, а дещо пізніше атомне ядро, таким чином показавши, що атом не є неподільний. Розвиток квантової механіки дозволив пояснити не лише будову атомів, а також їхні властивості: оптичні спектри, здатність вступати в реакції й утворювати молекули тощо.

![]()
Схематичне зображення атома гелію з електронною хмарою навколо і складним за будовою ядром
Зміст
[сховати]
1 Загальна характеристика будови атома
1.1 Електронні оболонки та орбіталі
2 Властивості
2.1 Ядерні властивості
2.2 Маса
2.3 Форма і розміри
2.4 Енергетичні рівні
2.5 Квантові переходи в атомі
2.6 Хімічні властивості
3 Аналіз і методи візуалізації
4 Історія
4.1 Натурфілософський атомізм
4.2 Початки наукової теорії атома
5 Див. також
6 Посилання
7 Джерела
8 Примітки
Загальна характеристика будови атома[ред. • ред. Код]
Докладніше: Планетарна модель атома
Сучасні уявлення про будову атома базуються на квантовій механіці. На популярному рівні будову атома можна викласти у рамках хвильової моделі, яка опирається намодель Бора, але враховує також додаткові відомості з квантової механіки.
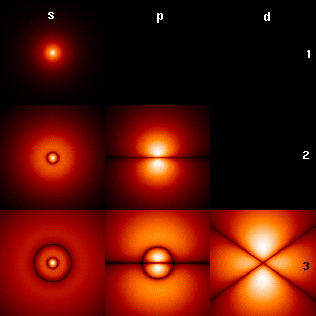
Хвильові функції орбіталей електронів в атомі.
За цією моделлю:
Атоми складаються із елементарних частинок (протонів, електронів, та нейтронів). Маса атома в основному зосереджена в ядрі, тому більша частина об'єму відносно порожня. Ядро оточене електронами. Кількість електронів дорівнює кількості протонів у ядрі, кількість протонів визначає порядковий номер елемента вперіодичній системі. У нейтральному атомі сумарний негативний заряд електронів дорівнює позитивному зарядові протонів. Атоми одного елемента з різною кількістю нейтронів називаються ізотопами.
У центрі атома знаходиться крихітне, позитивно заряджене ядро, що складається з протонів та нейтронів.
Ядро атома приблизно в 100 000 разів менше, ніж сам атом. Таким чином, якщо збільшити атом до розміріваеропорту Бориспіль, розмір ядра буде меншим від розміру кульки для настільного тенісу.
Ядро оточене електронною хмарою, яка займає більшу частину його об'єму. В електронній хмарі можна виділитиоболонки, для кожних з яких існує кілька можливих орбіталей. Заповнені орбіталі складають електронну конфігурацію, властиву для кожного хімічного елемента.
Кожна орбіталь може містити до двох електронів, що характеризуються трьома квантовими числами:основним, орбітальним і магнітним.
Кожен електрон на орбіталі має унікальне значення четвертого квантового числа: спіну.
Орбіталі визначаються специфічним розподілом ймовірності того, де саме можна знайти електрон. Приклади орбіталей та їхні позначення приведені на рисунку праворуч. «Границею» орбіталі вважається відстань, на якій імовірність того що електрон може перебувати поза нею є меншою 90%.
Кожна оболонка може містити не більше від строго визначеного числа електронів. Наприклад, найближча до ядра оболонка може мати максимум два електрони, наступна — 8, третя від ядра — 18
Коли електрони приєднуються до атома, вони займають орбіталь із найнижчою енергією. Лише електрони зовнішньої оболонки можуть брати участь в утворенні міжатомних зв'язків. Атоми можуть віддавати та приєднувати електрони, стаючи позитивно або негативно зарядженими іонами. Хімічні властивості елемента визначаються тим, з якою легкістю ядро може віддавати або здобувати електрони. Це залежить як від числа електронів так і від ступеня заповненості зовнішньої оболонки.
Електронні оболонки та орбіталі[ред. • ред. Код]
Докладніше: Електронні терми атомів
Складні атоми мають десятки, а для дуже важких елементів, навіть сотні електронів. Згідно з принципом нерозрізнюваності часток електронні стани атомів формуються всіма електронами, й неможливо визначити, де перебуває кожен із них. Однак, в так званому одноелектронному наближенні, можна говорити про певні енергетичні стани окремих електронів.
Згідно з цими уявленнями існує певний набір орбіталей, які заповнюються електронами атома. Ці орбіталі утворюють певну електронну конфігурацію. На кожній орбіталі може знаходитися не більше двох електронів (принцип виключення Паулі). Орбіталі групуються в оболонки, кожна з яких може мати лише певне фіксоване число орбіталей (1, 4, 10 тощо). Орбіталі поділяють на внутрішні й зовнішні. В основному стані атома внутрішні оболонки повністю заповнені електронами.
На внутрішніх орбіталях електрони перебувають дуже близько до ядра й сильно до нього прив'язані. Щоб вирвати електрон з внутрішньої орбіталі потрібно надати йому велику енергію, до кількох тисяч електрон-вольт. Таку енергію електрон на внутрішній оболонці може отримати лише поглинувши квант рентгенівського випромінювання. Енергії внутрішніх оболонок атомів індивідуальні для кожного хімічного елемента, а тому за спектром рентгенівського поглинання можна ідентифікувати атом. Цю обставину використовують в рентгенівському аналізі.
На зовнішній оболонці електрони перебувають далеко від ядра. Саме ці електрони беруть участь в формуванні хімічних зв'язків, тому зовнішню оболонку називаютьвалентною, а електрони зовнішньої оболонки валентними електронами.
