
- •Методичні вказівки щодо виконання самостійної роботи
- •1. Пояснювальна записка
- •2. Тематичний план самостійної роботи
- •3. Методичні вказівки щодо виконання самостійної роботи
- •2. Організаційна робота в лабораторії
- •3. Техніка безпеки в хімічній лабораторії. Попередження отруєння. Попередження опіків. Поводження зі склом
- •4. Протипожежні заходи
- •6. Основи проведення експерименту та оформлення лабораторної документації
- •Тема 1. Відбір і підготовка проб для аналізу
- •2. Відбір проб твердих тіл
- •3. Підготовка проб. Загальні правила
- •4. Відбір проб рідин
- •Тема 2. Хімічні реактиви
- •2. Класифікація хімічних реактивів за ступенем чистоти, вмістом основної речовини і домішок
- •3. Тара для фасування та умови зберігання реактивів
- •4. Правила користування реактивами
- •Тема 3. Зважування
- •2. Зважування на технохімічних вагах
- •3. Постійність, стійкість, правильність, точність і чутливість вагів
- •4. Аналітичні ваги і зважування. Визначення нульової точки вагів
- •Тема 4. Хімічний посуд та допоміжне приладдя
- •2. Мірний посуд лабораторії. Ціна поділок та призначення мірного посуду. Калібровка мірного посуду
- •3. Товстостінний хімічний посуд
- •4. Фарфоровий лабораторний посуд
- •Рис, 4. Фарфоровий посуд:
- •5. Допоміжне лабораторне приладдя
- •6. Апарат Кіппа для добування газів. Газометр. Промивні і осушувальні склянки
- •7. Робота зі склом. Різання скляних трубочок і паличок. Згинання і розтягування скляних трубочок. Оплавлення скляних трубочок і паличок
- •8. Добір і свердління пробок
- •Тема 5. Методи очищення речовин
- •2. Центрифугування
- •3. Перегонка
- •4. Перекристалізація
- •5. Сублімація
- •6. Добування газу со2 в апараті Кіппа. Очищення газу
- •Тема 6. Обробка осадів
- •2. Осадження та промивання осаду
- •3. Висушування та прожарювання осаду до постійної маси
- •4. Знаходження вмісту елемента в отриманому осаді
- •Тема 7. Розчини в об’ємному аналізі
- •2. Способи виразу концентрації в об’ємному аналізі
- •3. Приготування титрованих робочих розчинів
- •1. Як приготувати 250 мл 0,1 н. Розчину перекристалізованої чистої двохводної щавлевої кислоти (н2с2о4 ˑ 2н2о), яку використовують для титрування лугу? Яку наважку її треба узяти?
- •2. Як приготувати 200 мл 0,05 н. Розчину кМnO4 для титрування методом перманганатометрії?
- •3. Приготувати 1 л 0,2 н. Розчину нСl, використовуючи наявну в лабораторії концентровану нСl з густиною 1,15.
- •4. Перелік навчально-методичної літератури
- •1. Основна
- •2. Додаткова
4. Перекристалізація
Законспектувати. Знати і вміти розкривати зміст
Очищення твердої речовини від розчинних домішок можна здійснити перекристалізацією. При очищенні речовини перекристалізацією завдання полягає в тому, щоб створити сприятливі умови для виділення даної речовини в кристалічному стані з пересиченого розчину і в той же час утримати в розчині супутні розчинні домішки. Викристалізований осад виходить чистішим від початкової речовини, навіть у тому випадку, коли домішки важче розчинні, ніж основна речовина, оскільки вміст їх у порівнянні з останнім буває незначним і маточний розчин відносно домішок завжди залишається ненасиченим навіть тоді, коли відносно головної маси речовини він є пересиченим. Кристали із посудини, в якій проводиться перекристалізація, тим або іншим шляхом переносяться на фільтр. Кристали, що пристали до стінок посудини, змивають невеликими порціями відфільтрованого маточного розчину. Для повного видалення рідини частіше буває корисним віджати кристали на фільтрі (не припиняючи відсмоктування) за допомогою шпателя, товкачика або скляної пробки. Можна постукати рукою об край лійки, при цьому осад ущільнюється і краще фільтрується.
5. Сублімація
Законспектувати. Знати і вміти розкривати зміст
Деякі тверді речовини, наприклад, йод, нафталін, мають здатність перетворюватися на пару, минувши рідкий стан. Таке випарювання називається сублімацією. Користуючись нею, можна очищати речовини від домішок. Для сублімації можна скористатися одним із приладів, що зображені на рис. 9. Склянки беруть без носика.
П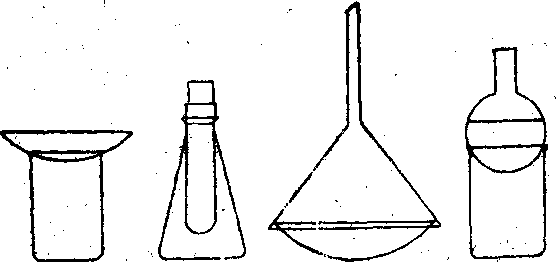 рилад
ставлять на піщану баню. У стакан (колбу)
приладу поміщають йод, нафталін або
саліцилову кислоту. На
годинникове скло (у пробірку або колбу
над Рис.
9.
рилад
ставлять на піщану баню. У стакан (колбу)
приладу поміщають йод, нафталін або
саліцилову кислоту. На
годинникове скло (у пробірку або колбу
над Рис.
9.
склянкою) наливають холодної води. При нагріванні склянки на піщаній бані речовина переганяється і на холодній частині приладу конденсується у вигляді кристалів. Після охолодження сублімовану речовину збирають.
6. Добування газу со2 в апараті Кіппа. Очищення газу
Законспектувати. Знати і вміти розкривати зміст
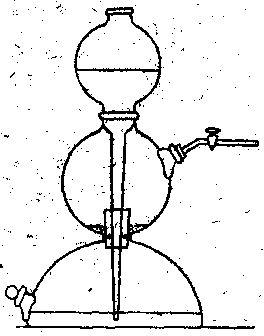 Добувати
вуглекислий газ для хімічних досліджень
можна за допомогою апарату Кіппа (рис.
10). Для його зарядки виймають скляний
кран з пробкою із середньої кулі і
завантажують до неї шматочки мармуру
або вапняку. Протирають стінки отвору
від пилу мармуру або вапняку і встановлюють
пробку з краном на місце. Кран відкривають.
Наливають за допомогою лійки в нижню
кулю через верхню розбавлену хлоридну
кислоту (одну частину концентрованої
кислоти змішують з трьома частинами
води). Кислота повинна заповнити нижню
кулю і частину середньої, змочити мармур
або вапняк. У результаті реакції хлоридної
кислоти з карбонатами виділяється
вуглекислий газ. Щоб очистити цей газ
від домішок кислоти та вологи під’єднують
до апарату Кіппа дві склянки Тищенка:
першу з розчином натрій гідрогенкарбонату,
другу – з концентрованою сульфатною
кислотою.
Рис. 10.
Добувати
вуглекислий газ для хімічних досліджень
можна за допомогою апарату Кіппа (рис.
10). Для його зарядки виймають скляний
кран з пробкою із середньої кулі і
завантажують до неї шматочки мармуру
або вапняку. Протирають стінки отвору
від пилу мармуру або вапняку і встановлюють
пробку з краном на місце. Кран відкривають.
Наливають за допомогою лійки в нижню
кулю через верхню розбавлену хлоридну
кислоту (одну частину концентрованої
кислоти змішують з трьома частинами
води). Кислота повинна заповнити нижню
кулю і частину середньої, змочити мармур
або вапняк. У результаті реакції хлоридної
кислоти з карбонатами виділяється
вуглекислий газ. Щоб очистити цей газ
від домішок кислоти та вологи під’єднують
до апарату Кіппа дві склянки Тищенка:
першу з розчином натрій гідрогенкарбонату,
другу – з концентрованою сульфатною
кислотою.
Рис. 10.
Запитання для контролю та самоконтролю
1. Які є методи очищення рідин, газів та твердих речовин?
2. Які є методи фільтрування рідин?
3. Які особливості фільтрування рідин при звичайному тиску?
4. У чому суть фільтрування під вакуумом?
5. Як проводиться гаряче фільтрування?
6. Який скляний посуд і яке обладнання використовують для перегонки?
7. Що собою являє сублімація?
8. Який порядок зарядки апарата Кіппа? Як ним користуватись?
9. У яких склянках очищають гази?
10. Для чого застосовують центрифугування?
Рекомендована література
1. Грималюк І.М. Лабораторні роботи з хімії. – К.: Вища школа, 1970. – 100 с.
2. Девятых Г.Г., Павлов А.М., Односельцев А.И. Руководство к практическим занятиям по неорганической химии. – М.: Высшая школа, 1964. – 284 с.
3. Васильева З.Г. Лабораторные работы по общей и неорганической химии. – М.: Просвещение, 1980. – 336 с.
4. Воскресенский П.Н. Техника лабораторных работ. – М.: Просвещение, 1969. – 313 с.
5. Воскресенский П.И., Неймарк А.М. Основы химического анализа. – М.: Просвещение, 1971. – 192 с.
