
- •Содержание
- •1.8.6. Описание явлений переноса в газах……………………………………………………37
- •2.2. Работа в термодинамике…………………………………………………………………..46
- •1. Молекулярно-кинетические представления
- •1.1. Число степеней свободы.
- •1.2. Температура и ее измерение.
- •1.3. Шкалы температур
- •1.4. Уравнение состояния идеального газа
- •1.5. Изопроцессы. Законы Бойля-Мариотта, Гей-Люссака, Шарля.
- •1.6. Закон Дальтона для смеси газов
- •1.7. Основные понятия классической и квантовой статистики
- •1.7.1. Барометрическая формула
- •1.7.2. Распределение Больцмана.
- •1.7.3. Распределение Максвелла.
- •1.7.4. Распределение Максвелла-Больцмана.
- •1.7.5. Опыт Штерна. Скорость частиц вещества
- •1.7.6. Уравнение состояния для газа Ван-дер Вальса.
- •1.8. Явления переноса.
- •1.8.1. Эффективный диаметр молекулы.
- •1.8.2. Средняя длина пробега молекул.
- •1.8.3. Диффузия.
- •1.5.4. Теплопроводность.
- •1.8.5.Вязкость или внутреннее трение
- •1.8.6. Описание явлений переноса в газах
- •2. Основи термодинаміки
- •2.1. Внутренняя энергия идеального газа
- •2.2. Работа в термодинамике.
- •2.3. Количество теплоты
- •2.4. Первое начало термодинамики. Применение для изопроцессов.
- •2.5. Теплоемкость идеального газа
- •2.6. Адиабатическое изменение объёма газа.
- •2.7. Внутренняя энергия газа Ван-дер-Ваальса
- •2.8. Эффект Джоуля – Томсона.
- •2.9. Тепловая машина. Холодильная машина. Кпд.
- •2.10. Цикл Карно. Идеальная тепловая машина
- •2.11. Второе начало термодинамики. Энтропия.
- •2.12. Третий закон термодинамики (тепловой закон Нернста)
- •3. Жидкое состояние
- •Строение жидкостей
- •Явления на границе раздела газа, жидкости и твердого тела
- •Явление смачивания и несмачивания
- •3.4. Давление под изогнутой поверхностью жидкости
- •Капиллярные явления.
- •Кристаллическое состояние
- •Кристаллические и аморфные тела
- •Кристаллическая решетка
- •Физические типы кристаллов
- •4.3. Дефекты кристаллического строения
- •4.4. Тепловое движение в кристаллах.
- •4.6. Теплоемкость кристаллов.
- •5. Фазовые равновесия и превращения
- •5.1. Испарение и конденсация
- •5.2. Насыщенные и ненасыщенные пары
- •5.3. Равновесие жидкости и насыщенного пара
- •5.4. Влажность.
- •5.5. Плавление и кристаллизация
- •5.6. Критическое состояние
- •5.6. Пересыщенный пар и перегретая жидкость. Метастабильное состояние вещества.
- •5.8. Уравнение Клапейрона –Клаузиуса
- •5.9. Диаграмма состояния. Тройная точка.
- •Литература
1.4. Уравнение состояния идеального газа
Самой простой системой частиц является газ. В то же время его изучение имеет большое практическое значение, хотя бы потому, что газообмен определяет состояние всей биосферы Земли, в том числе человека. Вместо реального газа, между молекулами которого действуют сложные силы взаимодействия, мы будем рассматривать физическую модель - идеальный газ.
Идеальным газом называется газ, в котором собственными размерами молекул и взаимодействием между молекулами можно пренебречь. Реальные разреженные газы ведут себя подобно идеальному, так как лишь небольшая доля молекул в них находится в состоянии соударения. Например, такие газы, как воздух, кислород, азот и т. д. при комнатной температуре и атмосферном давлении по своим свойствам близки к идеальному.
Состояние заданной массы газа определяется значениями трех термодинамических параметров: давления p, объема V и температуры T. Связь между параметрами называется уравнением состояния. Уравнение состояния идеального газа может быть записано в разных формах.
В наиболее общем виде уравнение состояния идеального газа установил эмпирически французский ученый Б.П. Клапейрон и русский ученый Д.И. Менделеев. Для двух различных состояний уравнение Клапейрона имеет вид
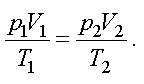 (1.5)
(1.5)
Уравнение Клапейрона-Менделеева имеет вид:
![]() (1.6)
(1.6)
или
![]() (1.7)
(1.7)
где p - давление; V - объем; T -
термодинамическая или абсолютная
температура (вычисляется по шкале
Кельвина, которая связана с температурой
по шкале Цельсия соотношением
![]() );
m - масса вещества, μ - молярная
масса;
);
m - масса вещества, μ - молярная
масса;
![]() -
газовая постоянная.
-
газовая постоянная.
Уравнение Клапейрона - Менделеева формулируется так: произведение давления идеального газа на его объем, деленное на термодинамическую температуру, есть величина постоянная для данной массы газа.
Отношение массы вещества к молярной массе называется количеством вещества
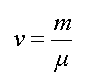 (1.8)
(1.8)
и измеряется в молях.
Уравнению (1.6) можно придать другой вид. Обозначим через m0 - массу одной молекулы, а N - полное число молекул. Тогда
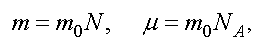
где NA - число Авогадро.
Количество вещества равно
 (1.8)
(1.8)
Подставим (1.8) в (1.6) и получим
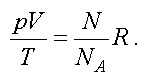
Отношение газовой постоянной к числу Авогадро есть постоянная Больцмана
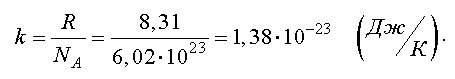
Тогда другая форма записи уравнения состояния идеального газа имеет вид
 (1.9)
(1.9)
Найдем связь давления и концентрации газа.
Концентрацией называется число молекул, заключенных в единице объема:
 (1.10)
(1.10)
Из этого следует, что давление пропорционально концентрации, т. е.
![]() (1.11)
(1.11)
Это еще одна форма записи уравнения состояния идеального газа.
1.5. Изопроцессы. Законы Бойля-Мариотта, Гей-Люссака, Шарля.
Состояние идеального газа определяется тремя параметрами: p - давление, V - объем и T - термодинамическая температура. Изменение хотя бы одного параметра приводит к новому состоянию. Переход системы из одного состояния в другое называется процессом. Изопроцессом называется процесс, при котором один из параметров остается постоянным. Существует три изопроцесса, законы которых легко получить из уравнения (1.5).
Изотермический (при постоянной температуре). Это процесс описывается законом Бойля и Мариотта. Для данной массы газа при постоянной температуре произведение давление на объем газа есть величина постоянная (рис. 1.2, а).
![]()
![]() .
(1.12)
.
(1.12)
Изобарный (изобарический) – при постоянном давлении. Подчиняется закону Гей-Люссака. Для данной массы газа при постоянном давлении объем газа прямо пропорционален абсолютной температуре (рис. 1.2., б).
![]()
![]() .
(1.13)
.
(1.13)
Изохорный (изохорический) – при постоянном объеме. Подчиняется закону Шарля. Для данной массы газа при постоянном объеме давление газа прямо пропорционално абсолютной температуре (рис. 1.2., в).
![]()
![]() .
(1.14)
.
(1.14)

Рис. 1.2. а, б, в – изотермы, изобары и изохоры идеального газа, соответственно
Эти частные законы позволяют связать конечные параметры с начальными характеристиками.
