
- •Содержание
- •1.8.6. Описание явлений переноса в газах……………………………………………………37
- •2.2. Работа в термодинамике…………………………………………………………………..46
- •1. Молекулярно-кинетические представления
- •1.1. Число степеней свободы.
- •1.2. Температура и ее измерение.
- •1.3. Шкалы температур
- •1.4. Уравнение состояния идеального газа
- •1.5. Изопроцессы. Законы Бойля-Мариотта, Гей-Люссака, Шарля.
- •1.6. Закон Дальтона для смеси газов
- •1.7. Основные понятия классической и квантовой статистики
- •1.7.1. Барометрическая формула
- •1.7.2. Распределение Больцмана.
- •1.7.3. Распределение Максвелла.
- •1.7.4. Распределение Максвелла-Больцмана.
- •1.7.5. Опыт Штерна. Скорость частиц вещества
- •1.7.6. Уравнение состояния для газа Ван-дер Вальса.
- •1.8. Явления переноса.
- •1.8.1. Эффективный диаметр молекулы.
- •1.8.2. Средняя длина пробега молекул.
- •1.8.3. Диффузия.
- •1.5.4. Теплопроводность.
- •1.8.5.Вязкость или внутреннее трение
- •1.8.6. Описание явлений переноса в газах
- •2. Основи термодинаміки
- •2.1. Внутренняя энергия идеального газа
- •2.2. Работа в термодинамике.
- •2.3. Количество теплоты
- •2.4. Первое начало термодинамики. Применение для изопроцессов.
- •2.5. Теплоемкость идеального газа
- •2.6. Адиабатическое изменение объёма газа.
- •2.7. Внутренняя энергия газа Ван-дер-Ваальса
- •2.8. Эффект Джоуля – Томсона.
- •2.9. Тепловая машина. Холодильная машина. Кпд.
- •2.10. Цикл Карно. Идеальная тепловая машина
- •2.11. Второе начало термодинамики. Энтропия.
- •2.12. Третий закон термодинамики (тепловой закон Нернста)
- •3. Жидкое состояние
- •Строение жидкостей
- •Явления на границе раздела газа, жидкости и твердого тела
- •Явление смачивания и несмачивания
- •3.4. Давление под изогнутой поверхностью жидкости
- •Капиллярные явления.
- •Кристаллическое состояние
- •Кристаллические и аморфные тела
- •Кристаллическая решетка
- •Физические типы кристаллов
- •4.3. Дефекты кристаллического строения
- •4.4. Тепловое движение в кристаллах.
- •4.6. Теплоемкость кристаллов.
- •5. Фазовые равновесия и превращения
- •5.1. Испарение и конденсация
- •5.2. Насыщенные и ненасыщенные пары
- •5.3. Равновесие жидкости и насыщенного пара
- •5.4. Влажность.
- •5.5. Плавление и кристаллизация
- •5.6. Критическое состояние
- •5.6. Пересыщенный пар и перегретая жидкость. Метастабильное состояние вещества.
- •5.8. Уравнение Клапейрона –Клаузиуса
- •5.9. Диаграмма состояния. Тройная точка.
- •Литература
5.8. Уравнение Клапейрона –Клаузиуса
Рассмотрим элементарный цикл Карно в области фазового перехода (рис. 5.7).
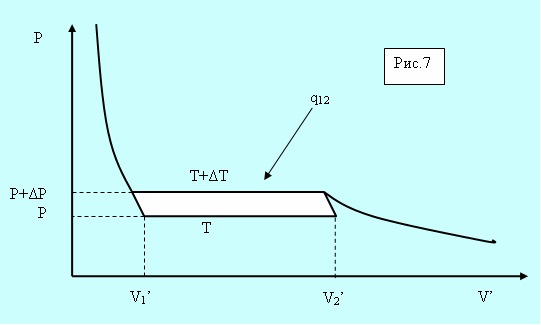
Рис. 5.7. Фазовый переход.
Горизонтальные участки соответствуют изотермам в процессе фазового перехода отличающимся на ΔТ, а вертикальные – адиабатам (они круче изотерм). По определению кпд цикла равно
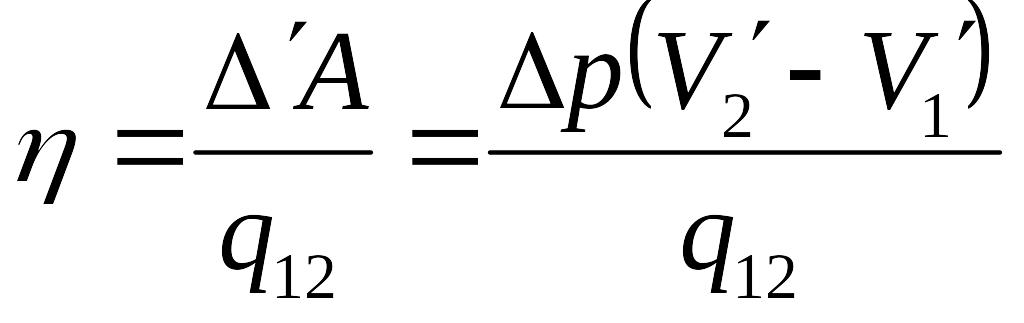 . (5.8)
. (5.8)
Здесь V’1 и V’2 – удельные объёмы фаз, а q12- удельная теплота сообщаемая единице массы системы при расширении.
Но кпд цикла Карно можно также записать через температуры нагревателя и холодильника:
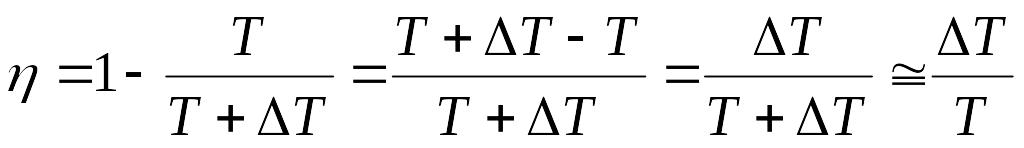 . (5.9)
. (5.9)
Приравняем (5.8) и (5.9)
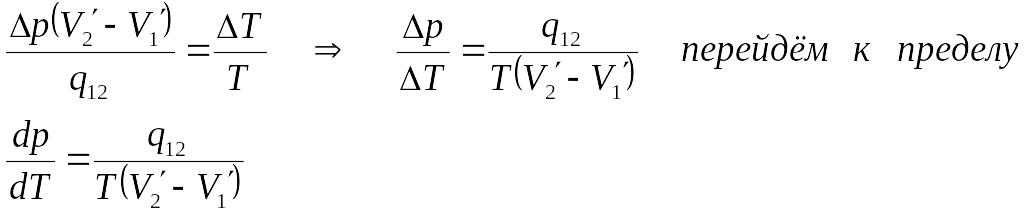 (5.10)
(5.10)
Это уравнение называется уравнением Клапейрона – Клаузиуса.
Согласно уравнению (5.10) знак производной зависит от того, каким изменением объёма – возрастанием или уменьшением - сопровождается фазовый переход, происходящий при поглощении тепла. При испарении жидкости или твёрдого тела объём всегда увеличивается, поэтому производная dp/dT >0 для кривой сублимации и испарения. При плавлении объём обычно возрастает, однако, у некоторых веществ, в том числе у воды, объём твёрдой фазы больше объёма жидкой. В этом случае dp/dT <0.
5.9. Диаграмма состояния. Тройная точка.
Возьмём вещество в виде жидкости и находящегося в равновесии с ней пара и, не изменяя объема, начнём отнимать тепло. Понижение температуры будет сопровождаться понижением давления. Это будет продолжаться до тех пор, пока не будет достигнута температура кристаллизации. Обозначим её Ттр.
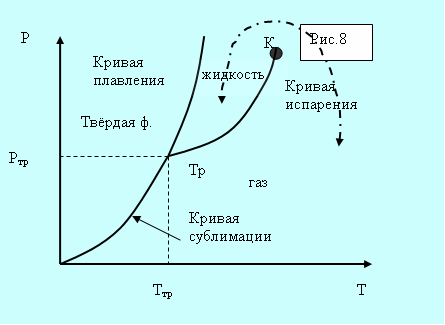
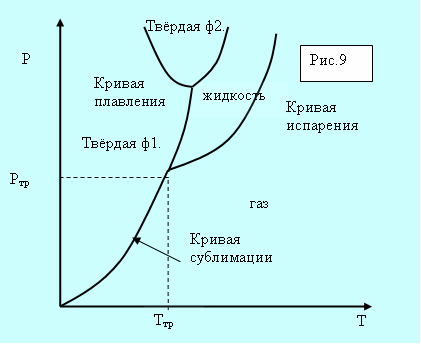
а б
Рис. 5.8. Фазовые диаграммы.
Всё время пока идёт кристаллизация, температура и давление остаются неизменными. Отводимое тепло представляет собой тепло, выделяемое при кристаллизации. Температура Ттр и давление ртр– единственные значения, при которых могут одновременно находится в равновесии три фазы вещества: твёрдая, жидкая, газообразная. Соответствующая точка на диаграмме (р,Т) называется тройной точкой.
Кривые плавления, испарения и сублимации разбивают координатную плоскость на три области (рис. 5.8, а). Любая точка в одной из областей соответствует однофазному состоянию вещества. Точки, лежащие на кривых, соответствуют равновесным двухфазным состояниям вещества. Кривая испарения заканчивается критической точкой К. Можно осуществить процесс в обход её, так что переход от газа к жидкости не будет проходить через двухфазное состояние (пунктирная кривая на рис. 5.8, а).
Для вещества с несколькими кристаллическими модификациями может быть несколько тройных точек. Например, для двух модификаций на рисунке 5.8, б присутствуют две тройные точки. Непрерывный переход между жидким и газообразным состоянием возможен потому, что различие между ними носит количественный характер. Непрерывный переход между жидким и кристаллическим состоянием не возможен потому, что характерной чертой является анизотропия – наличие кристаллической решётки. У жидкости анизотропия отсутствует, а переход между анизотропным и не анизотропным состояниями может происходить только скачком. По этой причине кривые сублимации и плавления не могут обрываться критической точкой.
