
- •Содержание
- •1.8.6. Описание явлений переноса в газах……………………………………………………37
- •2.2. Работа в термодинамике…………………………………………………………………..46
- •1. Молекулярно-кинетические представления
- •1.1. Число степеней свободы.
- •1.2. Температура и ее измерение.
- •1.3. Шкалы температур
- •1.4. Уравнение состояния идеального газа
- •1.5. Изопроцессы. Законы Бойля-Мариотта, Гей-Люссака, Шарля.
- •1.6. Закон Дальтона для смеси газов
- •1.7. Основные понятия классической и квантовой статистики
- •1.7.1. Барометрическая формула
- •1.7.2. Распределение Больцмана.
- •1.7.3. Распределение Максвелла.
- •1.7.4. Распределение Максвелла-Больцмана.
- •1.7.5. Опыт Штерна. Скорость частиц вещества
- •1.7.6. Уравнение состояния для газа Ван-дер Вальса.
- •1.8. Явления переноса.
- •1.8.1. Эффективный диаметр молекулы.
- •1.8.2. Средняя длина пробега молекул.
- •1.8.3. Диффузия.
- •1.5.4. Теплопроводность.
- •1.8.5.Вязкость или внутреннее трение
- •1.8.6. Описание явлений переноса в газах
- •2. Основи термодинаміки
- •2.1. Внутренняя энергия идеального газа
- •2.2. Работа в термодинамике.
- •2.3. Количество теплоты
- •2.4. Первое начало термодинамики. Применение для изопроцессов.
- •2.5. Теплоемкость идеального газа
- •2.6. Адиабатическое изменение объёма газа.
- •2.7. Внутренняя энергия газа Ван-дер-Ваальса
- •2.8. Эффект Джоуля – Томсона.
- •2.9. Тепловая машина. Холодильная машина. Кпд.
- •2.10. Цикл Карно. Идеальная тепловая машина
- •2.11. Второе начало термодинамики. Энтропия.
- •2.12. Третий закон термодинамики (тепловой закон Нернста)
- •3. Жидкое состояние
- •Строение жидкостей
- •Явления на границе раздела газа, жидкости и твердого тела
- •Явление смачивания и несмачивания
- •3.4. Давление под изогнутой поверхностью жидкости
- •Капиллярные явления.
- •Кристаллическое состояние
- •Кристаллические и аморфные тела
- •Кристаллическая решетка
- •Физические типы кристаллов
- •4.3. Дефекты кристаллического строения
- •4.4. Тепловое движение в кристаллах.
- •4.6. Теплоемкость кристаллов.
- •5. Фазовые равновесия и превращения
- •5.1. Испарение и конденсация
- •5.2. Насыщенные и ненасыщенные пары
- •5.3. Равновесие жидкости и насыщенного пара
- •5.4. Влажность.
- •5.5. Плавление и кристаллизация
- •5.6. Критическое состояние
- •5.6. Пересыщенный пар и перегретая жидкость. Метастабильное состояние вещества.
- •5.8. Уравнение Клапейрона –Клаузиуса
- •5.9. Диаграмма состояния. Тройная точка.
- •Литература
5.4. Влажность.
Для того чтобы судить, много или мало водяных паров находится в воздухе, вводят понятие влажности. Абсолютная влажность - количество пара, выраженное в килограммах, содержащееся в 1 м3 при данной температуре, т.е. абсолютная влажность равна плотности паров воды.
Относительная влажность В - это отношение абсолютной влажности к плотности насыщенного пара при данной температуре.
В =
![]() 100%
.
(5.7)
100%
.
(5.7)
Плотность насыщенного водяного пара при данной температуре есть величина табличная. Для определения относительной влажности надо знать абсолютную влажность, которую можно определить по точке росы.
Точке росы соответствует температура, при которой пар, находящийся в воздухе, становится насыщающим.
5.5. Плавление и кристаллизация
По мере возрастания температуры энергия колебательного движения атомов в твёрдом теле возрастает и, наконец, наступает такой момент, когда связи между атомами начинают разрываться. При этом твердое тело переходит в жидкое состояние. Такой переход называется плавлением. При фиксированном давлении плавление происходит при строго определённой температуре.
Количество тепла, необходимое для превращения единицы массы вещества в жидкость при температуре плавления, называют удельной теплотой плавления L.
Для плавления вещества массой m необходимо затратить количество теплоты равное:
Q = L·m. (5.8)
При охлаждении расплавленного твёрдого тела происходит обратный процесс, называемый кристаллизацией. Образование кристалла также происходит при постоянной температуре, равной температуре плавления. При кристаллизации жидкости выделяется такое же количество теплоты, какое поглощается при плавлении вещества той же массы.
Аморфные тела в противоположность кристаллам не имеют определенной температуры плавления.
5.6. Критическое состояние
На рисунке 5.3 дано семейство изотерм реального газа. Видно, что с повышением температуры горизонтальные участки изотерм сокращаются, стягиваясь в точку при температуре называемой критической. В критической точке исчезает всякое различие между жидкостью и паром. Это состояние называют критическим состоянием вещества. Объём Vкр, давление pкр, и температура Ткр, отвечающие критическому состоянию, называются критическими величинами. Для критической изотермы точка К служит точкой перегиба, а касательная в ней параллельна оси V.
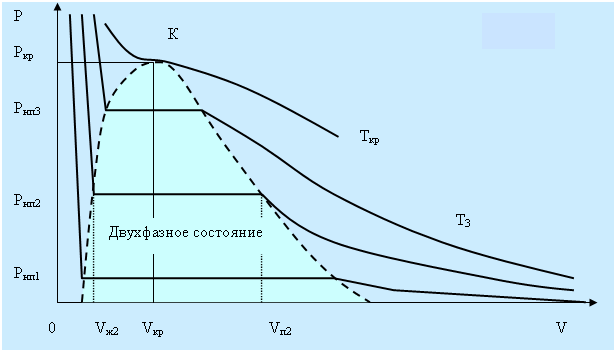
Рис. 5.3.
При температурах выше критической понятие насыщенного пара теряет смысл. Колоколообразная кривая ограничивает область двухфазных состояний. При температурах выше критической вещество при любых давлениях будет однородным и никаким сжатием не может быть осуществлено ожижение вещества. В области левее колоколообразной кривой находится жидкое состояние, а правее пар.
Выбрав процесс перехода так, что бы он не пересекал двухфазную область, можно осуществить переход из жидкого в газообразное состояние без расслаивания на две фазы. При этом вещество всё время будет оставаться однородным.
5.6. Пересыщенный пар и перегретая жидкость. Метастабильное состояние вещества.
На рисунке 5.4 изображены изотермы Ван дер Ваальсовского газа. Характерным для них является то, что при температурах, ниже критической, у кривых имеется S-образный завиток. У реальных изотерм его нет, а на его месте находится прямолинейный горизонтальный участок.
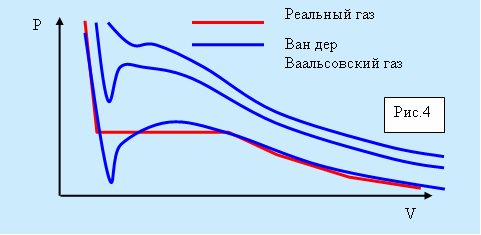
Рис. 5.4. Изотермы для газа Вад-дер-Ваальса.
Из рисунка видно, что уравнение Ван дер Ваальса хорошо описывает газообразное и жидкое состояние. На участке 1-4 рисунка 5.5 вещество ведёт себя совершенно необычно.
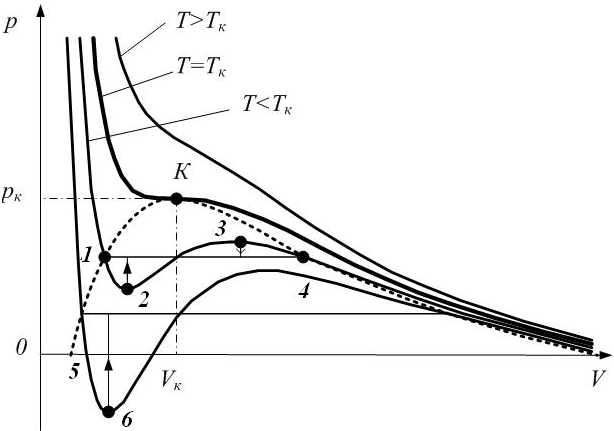
Рис. 5.5. Метастабильные состояния.
Тем не менее, участок 1-2 может быть реализован. Точки на участке 1-2 соответствуют состояниям перегретой жидкости. Точки на участке 4-3 пересыщенному пару. Эти состояния являются неустойчивыми и стрелочки на рисунке показывают направление возможного перехода – при этом происходит расслоение на две фазы. Такие состояния называются метастабильными. При достаточно низких температурах изотерма пересекает ось Vm, переходя в область отрицательных давлений (рис. 5.5, нижняя кривая). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 5–6 на нижней изотерме растянутой жидкости.
Что бы получить метастабильное состояние необходимо очистить вещество от всевозможных пылинок, микрочастиц и всего, что может стать центром конденсации или центром кипения. Тогда, например, жидкость можно перевести в метастабильное состояние перегретой жидкости. Однако, достаточно бросить в перегретую жидкость песчинку, как произойдёт бурное закипание, температура жидкости станет равной температуре кипения, а избыток тепла будет истрачен на парообразование. На участке 2-3 рис. 5.5. вещество обладало бы противоестественными свойствами, так как при увеличении объёма давление бы повышалось. Поэтому такие состояния не реализуются.
