
- •Содержание
- •1.8.6. Описание явлений переноса в газах……………………………………………………37
- •2.2. Работа в термодинамике…………………………………………………………………..46
- •1. Молекулярно-кинетические представления
- •1.1. Число степеней свободы.
- •1.2. Температура и ее измерение.
- •1.3. Шкалы температур
- •1.4. Уравнение состояния идеального газа
- •1.5. Изопроцессы. Законы Бойля-Мариотта, Гей-Люссака, Шарля.
- •1.6. Закон Дальтона для смеси газов
- •1.7. Основные понятия классической и квантовой статистики
- •1.7.1. Барометрическая формула
- •1.7.2. Распределение Больцмана.
- •1.7.3. Распределение Максвелла.
- •1.7.4. Распределение Максвелла-Больцмана.
- •1.7.5. Опыт Штерна. Скорость частиц вещества
- •1.7.6. Уравнение состояния для газа Ван-дер Вальса.
- •1.8. Явления переноса.
- •1.8.1. Эффективный диаметр молекулы.
- •1.8.2. Средняя длина пробега молекул.
- •1.8.3. Диффузия.
- •1.5.4. Теплопроводность.
- •1.8.5.Вязкость или внутреннее трение
- •1.8.6. Описание явлений переноса в газах
- •2. Основи термодинаміки
- •2.1. Внутренняя энергия идеального газа
- •2.2. Работа в термодинамике.
- •2.3. Количество теплоты
- •2.4. Первое начало термодинамики. Применение для изопроцессов.
- •2.5. Теплоемкость идеального газа
- •2.6. Адиабатическое изменение объёма газа.
- •2.7. Внутренняя энергия газа Ван-дер-Ваальса
- •2.8. Эффект Джоуля – Томсона.
- •2.9. Тепловая машина. Холодильная машина. Кпд.
- •2.10. Цикл Карно. Идеальная тепловая машина
- •2.11. Второе начало термодинамики. Энтропия.
- •2.12. Третий закон термодинамики (тепловой закон Нернста)
- •3. Жидкое состояние
- •Строение жидкостей
- •Явления на границе раздела газа, жидкости и твердого тела
- •Явление смачивания и несмачивания
- •3.4. Давление под изогнутой поверхностью жидкости
- •Капиллярные явления.
- •Кристаллическое состояние
- •Кристаллические и аморфные тела
- •Кристаллическая решетка
- •Физические типы кристаллов
- •4.3. Дефекты кристаллического строения
- •4.4. Тепловое движение в кристаллах.
- •4.6. Теплоемкость кристаллов.
- •5. Фазовые равновесия и превращения
- •5.1. Испарение и конденсация
- •5.2. Насыщенные и ненасыщенные пары
- •5.3. Равновесие жидкости и насыщенного пара
- •5.4. Влажность.
- •5.5. Плавление и кристаллизация
- •5.6. Критическое состояние
- •5.6. Пересыщенный пар и перегретая жидкость. Метастабильное состояние вещества.
- •5.8. Уравнение Клапейрона –Клаузиуса
- •5.9. Диаграмма состояния. Тройная точка.
- •Литература
2.10. Цикл Карно. Идеальная тепловая машина
В природе и технике существует бесконечное количество циклов. Но тогда возникает вопрос, какой цикл из всех существующих циклов является самым экономичным, т.е. какой цикл имеет наибольший коэффициент полезного действия (КПД)? Такой цикл был предложен французским инженером Карно в 1824 г.
Циклом Карно называется цикл тепловой машины, которая связана только с двумя тепловыми резервуарами: нагревателем и холодильником. В качестве рабочего тела используется идеальный газ. Цикл Карно состоит из двух равновесных изотермических процессов и двух равновесных адиабатических процессов. Тепловую машину, работающую по циклу Карно, называют машиной Карно или идеальной тепловой машиной.
Обратимый цикл Карно состоит
из двух изотерм, описывающих процесс
теплопередачи от нагревателя к рабочему
телу и от рабочего тела к холодильнику,
и двух адиабат, описывающих расширение
и сжатие рабочего тела в тепловой машине
(см. рис. 2.8). Температура нагревателя
считается равной
![]() ,
а температура холодильника - соответственно
,
а температура холодильника - соответственно
![]() .
При этом температуры нагревателя
и
холодильника
постоянны,
что должно обеспечиваться бесконечно
большой теплоемкостью используемых
тепловых резервуаров. При первом
изотермическом процессе 1-2 происходит
передача рабочему телу теплоты
.
При этом температуры нагревателя
и
холодильника
постоянны,
что должно обеспечиваться бесконечно
большой теплоемкостью используемых
тепловых резервуаров. При первом
изотермическом процессе 1-2 происходит
передача рабочему телу теплоты
![]() ,
причем эта теплота передается бесконечно
медленно, при практически нулевой
разнице температуры между нагревателем
и рабочим телом. Далее рабочее тело
подвергается адиабатическому расширению
без теплообмена с окружающей средой
(процесс 2-3). При последующем изотермическом
процессе 3-4 холодильник забирает у
рабочего тела теплоту
.
Процесс 4-1 представляет собой адиабатическое
сжатие, переводящее рабочее тело в
первоначальное состояние.
,
причем эта теплота передается бесконечно
медленно, при практически нулевой
разнице температуры между нагревателем
и рабочим телом. Далее рабочее тело
подвергается адиабатическому расширению
без теплообмена с окружающей средой
(процесс 2-3). При последующем изотермическом
процессе 3-4 холодильник забирает у
рабочего тела теплоту
.
Процесс 4-1 представляет собой адиабатическое
сжатие, переводящее рабочее тело в
первоначальное состояние.
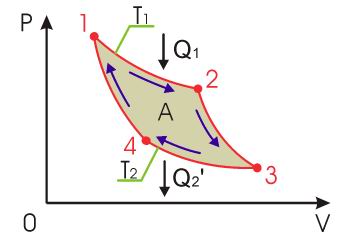
Рис. 2.8. Термодинамический цикл Карно
Французский ученый Сади Карно показал, что максимально возможное значение КПД тепловой машины равно
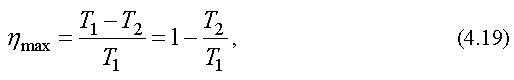 (2.44)
(2.44)
где T1 - температура нагревателя, T2 - температура холодильника.
Из сравнения уравнений (2.40) и (2.44) следует,
что
![]() или
или
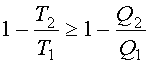 .
Отсюда
.
Отсюда
 (2.45)
(2.45)
На основании этого неравенства можно прийти к понятию энтропия и второму началу термодинамики.
Повышение КПД тепловых двигателей и приближение его к максимально возможному значению - важнейшая техническая задача. Однако, все тепловые двигатели выделяют большое количество теплоты, что называется тепловым загрязнением, и выбрасывают в атмосферу вредные для растений и животных химические соединения. Это ставит серьезные проблемы охраны окружающей среды.
2.11. Второе начало термодинамики. Энтропия.
Первый закон термодинамики, являясь частным случаем всеобщего закона о сохранении и превращении энергии, разрешает проведение любого процесса, не устанавливая условий, при которых возможен этот процесс. Он не решает вопроса о том, будет ли теплота передаваться от горячего тела к холодному или наоборот. Этот вопрос решает второй закон, выделяя из всех воображаемых процессов только те, которые в действительности могут произойти.
Следует отметить, что второй закон не ограничивается рамками техники, его действие распространяется на химию, биологию, астрономию, социологию и даже на явление жизни
Второе начало термодинамики является фундаментальным законом природы. Оно охватывает самый широкий круг природных явлений и указывает направление, в котором самопроизвольно протекают термодинамические процессы.
Второе начало термодинамики устанавливает наличие в природе фундаментальной асимметрии, т.е. однонаправленности всех происходящих в ней самопроизвольных процессов. Об этой асимметрии свидетельствует всё окружающее нас: горячие тела с течением времени охлаждаются, однако холодные сами по себе никогда не становятся горячими; прыгающий мяч в конце концов останавливается, но покоящийся мяч самопроизвольно не начинает подскакивать. Здесь проявляется свойство природы, отличное от свойства сохранения энергии. Это свойство состоит в том, что, хотя баланс энергии должен сохраняться в любом процессе, распределение имеющейся энергии изменяется необратимым образом. Второе начало термодинамики указывает естественное направление, в котором происходит изменение распределения энергии, причем это направление не зависит от её общего количества.
Смысл второго начала заключается в том, что любая система, предоставленная самой себе, стремится к одному вполне определённому состоянию – состоянию равновесия с окружающей средой. Такое состояние имеет минимум энергии.
Второе начало термодинамики, как и первое, имеет несколько формулировок.
В наиболее общей формулировке второе начало термодинамики предложено Л. Больцманом: природа стремится к переходу от менее вероятных состояний к более вероятным.
Опытом установлено, что различные формы энергии могут самопроизвольно переходить в теплоту, но невозможны обратные самопроизвольные превращения теплоты в другие виды энергии. Это отражено в другой формулировке второго закона: любой реальный самопроизвольный процесс необратим. Например, переход теплоты в работу является самопроизвольным процессом и осуществляется полностью: трение, удар, торможение и т.д. В противоположность этому самопроизвольного превращения теплоты в работу никто не наблюдал. Такое превращение возможно только в организованном процессе и не полностью.
Из всех форм движения наиболее вероятно хаотическое движение молекул. В соответствии с формулировкой М. Планка: невозможно построить периодически действующую машину, результатами действия которой были бы только получение механической работы и охлаждение источника теплоты. Для осуществления несамопроизвольного процесса получения работы необходимо построить тепловой двигатель, имеющий два источника теплоты с разными температурами – горячий источник (нагреватель) и холодный источник (холодильник). Теплота, полученная от нагревателя, частично превращается в работу, а частично передается холодильнику. Иными словами природа требует с нас «контрибуции» всякий раз, когда теплота преобразуется в работу.
Невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, полностью в работу.
Невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Эти формулировки показывают, что тепловые процессы являются необратимыми. Мерой необратимости процесса, мерой хаотичности является энтропия.
К определению энтропии S можно прийти
на основе анализа работы тепловых машин.
Если система получает тепло
![]() или отдает тепло
или отдает тепло
![]() ,
то состояние ее меняется. Тогда, при
изменении состояния системы, можно
найти не саму энтропию, а только ее
изменение, т. е.
,
то состояние ее меняется. Тогда, при
изменении состояния системы, можно
найти не саму энтропию, а только ее
изменение, т. е.
 (2.46)
(2.46)
Для тепловой машины изменение энтропии нагревателя и холодильника равны:
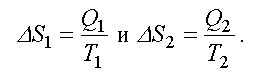 (2.47)
(2.47)
Формула
![]() справедлива для изотермического процесса
и представляет собой термодинамическое
определение энтропии. Энтропией
называется термодинамическая величина,
изменение которой в системе пропорционально
изменению ее тепловой энергии, деленной
на абсолютную температуру. Для
любого процесса можно найти бесконечно
малое изменение энтропии, т. е. ее
дифференциал
справедлива для изотермического процесса
и представляет собой термодинамическое
определение энтропии. Энтропией
называется термодинамическая величина,
изменение которой в системе пропорционально
изменению ее тепловой энергии, деленной
на абсолютную температуру. Для
любого процесса можно найти бесконечно
малое изменение энтропии, т. е. ее
дифференциал
 (2.48)
(2.48)
где
![]() -
элементарная теплота (см. формулу (2.8)).
-
элементарная теплота (см. формулу (2.8)).
В интегральной форме для любого процесса изменение энтропии равно
 (2.49)
(2.49)
Найдем изменение энтропии за один цикл
для тепловой машины. Из неравенства
(2.45)
следует, что
![]() .
Полное изменение энтропии за цикл больше
или равно нулю
.
Полное изменение энтропии за цикл больше
или равно нулю
![]() (2.50)
(2.50)
Знак равенства ΔS = 0 относится к обратимым процессам, которые являются бесконечно медленными процессами.
Знак неравенства ΔS > 0 относится к необратимым процессам. В реальных системах все процессы необратимы. Например, расширение газа, выравнивание температуры.
Таким образом, второе начало термодинамики формулируется и как закон возрастания энтропии (2.50).
Во всех необратимых процессах в замкнутой системе энтропия всегда возрастает.
Возрастание энтропии сопровождается выравниванием температуры или плотности газа. Это можно связать с порядком и беспорядком. Под порядком будем понимать сосредоточение частиц или энергии в определенном месте пространства, а под беспорядком (хаосом) - равномерное распределение их во всем объеме. Тогда возрастание энтропии при совершающихся без внешних воздействий необратимых процессах отражает природное стремление систем переходить от состояния, более упорядоченного в состояние менее упорядоченное. Этот процесс сопровождается рассеянием (или диссипацией) энергии.
Как мы видим, второе начало термодинамики определяет направленность тепловых процессов в изолированных системах, они всегда протекают в сторону роста энтропии, в сторону увеличения беспорядка. Капелька туши растворяется во всем объеме, колечко сигаретного дыма тает, огонь костра гаснет, разрушаются горы, гаснут звезды и т. д. Вся практическая деятельность людей как в технике, так и в сельском хозяйстве, представляет собой не что иное, как создание из природных материалов искусственных структур, т. е. в том или ином смысле борьбу с самопроизвольным ростом энтропии.
Возникновение упорядоченных структур
возможно только в незамкнутых, т. е. в
открытых системах. Открытой системой
называется система, которая обменивается
энергией и веществом с окружающей
средой. В открытых системах энтропия
может как возрастать, так и убывать в
зависимости от знака
![]() .
.
Трудами Ильи Пригожина (датский физик русского происхождения) строго доказано, что в открытых системах, находящихся в неравновесном состоянии, при определенных условиях из хаоса может возникать порядок. Процесс возникновения из хаоса упорядоченных структур называется самоорганизацией. Процессы самоорганизации являются общими для живой и неживой природы.
Феномен жизни является примером сохранения и увеличения упорядоченности и, следовательно, уменьшения энтропии. Жизненный цикл наблюдается только в открытых системах. Он включает в себя три стадии: рождение, развитие, смерть. На первых двух стадиях энтропия понижается, возникает и развивается структура. На этих стадиях живой организм поддерживает связь с окружающей средой. На третьей стадии система становится замкнутой, энтропия возрастает и достигает максимума. В этом смысле жизнь - это борьба с возрастанием энтропии. Человек существует, пока он активно поддерживает связь с окружающим миром, обменивается с ним энергией, веществом и информацией.
Заключение:
1. Второй закон термодинамики объясняет направление протекания процессов и вводит понятие энтропии ΔS=Q/T. Критерием самопроизвольного протекания процесса в
изолированной системе является ΔS>0, равновесия – ΔS=0.
2. Энтропия является функцией состояния и ее смысл расшифровывается в статистической термодинамики как мера беспорядка системы. Чем больше беспорядок, тем больше энтропия.
