
- •Содержание
- •1.8.6. Описание явлений переноса в газах……………………………………………………37
- •2.2. Работа в термодинамике…………………………………………………………………..46
- •1. Молекулярно-кинетические представления
- •1.1. Число степеней свободы.
- •1.2. Температура и ее измерение.
- •1.3. Шкалы температур
- •1.4. Уравнение состояния идеального газа
- •1.5. Изопроцессы. Законы Бойля-Мариотта, Гей-Люссака, Шарля.
- •1.6. Закон Дальтона для смеси газов
- •1.7. Основные понятия классической и квантовой статистики
- •1.7.1. Барометрическая формула
- •1.7.2. Распределение Больцмана.
- •1.7.3. Распределение Максвелла.
- •1.7.4. Распределение Максвелла-Больцмана.
- •1.7.5. Опыт Штерна. Скорость частиц вещества
- •1.7.6. Уравнение состояния для газа Ван-дер Вальса.
- •1.8. Явления переноса.
- •1.8.1. Эффективный диаметр молекулы.
- •1.8.2. Средняя длина пробега молекул.
- •1.8.3. Диффузия.
- •1.5.4. Теплопроводность.
- •1.8.5.Вязкость или внутреннее трение
- •1.8.6. Описание явлений переноса в газах
- •2. Основи термодинаміки
- •2.1. Внутренняя энергия идеального газа
- •2.2. Работа в термодинамике.
- •2.3. Количество теплоты
- •2.4. Первое начало термодинамики. Применение для изопроцессов.
- •2.5. Теплоемкость идеального газа
- •2.6. Адиабатическое изменение объёма газа.
- •2.7. Внутренняя энергия газа Ван-дер-Ваальса
- •2.8. Эффект Джоуля – Томсона.
- •2.9. Тепловая машина. Холодильная машина. Кпд.
- •2.10. Цикл Карно. Идеальная тепловая машина
- •2.11. Второе начало термодинамики. Энтропия.
- •2.12. Третий закон термодинамики (тепловой закон Нернста)
- •3. Жидкое состояние
- •Строение жидкостей
- •Явления на границе раздела газа, жидкости и твердого тела
- •Явление смачивания и несмачивания
- •3.4. Давление под изогнутой поверхностью жидкости
- •Капиллярные явления.
- •Кристаллическое состояние
- •Кристаллические и аморфные тела
- •Кристаллическая решетка
- •Физические типы кристаллов
- •4.3. Дефекты кристаллического строения
- •4.4. Тепловое движение в кристаллах.
- •4.6. Теплоемкость кристаллов.
- •5. Фазовые равновесия и превращения
- •5.1. Испарение и конденсация
- •5.2. Насыщенные и ненасыщенные пары
- •5.3. Равновесие жидкости и насыщенного пара
- •5.4. Влажность.
- •5.5. Плавление и кристаллизация
- •5.6. Критическое состояние
- •5.6. Пересыщенный пар и перегретая жидкость. Метастабильное состояние вещества.
- •5.8. Уравнение Клапейрона –Клаузиуса
- •5.9. Диаграмма состояния. Тройная точка.
- •Литература
2.7. Внутренняя энергия газа Ван-дер-Ваальса
Для нахождения внутренней энергии газа Ван-дер-Ваальса, воспользуемся следующим приемом. Пусть над газом Ван-дер-Ваальса осуществляется процесс без теплообмена с окружающей средой. Тогда изменение его внутренней энергии можно записать в виде
|
(2.32) |
При тех же условиях изменение внутренней энергии идеального газа можно было бы рассчитать по формуле
|
(2.33) |
Подстановка в эту формулу выражений (1.37) и (1.40) дает
|
(2.34) |
Первое слагаемое в правой части выражения (2.34) согласно формуле (2.33) представляет собой изменение внутренней энергии газа Ван-дер-Ваальса.
Отсюда следует:
|
(2.35) |
Интегрирование этого выражения дает
|
(2.36) |
Здесь произвольную константу интегрирования
необходимо положить равной нулю, так
как при
![]() выражения
для внутренних энергий газа Ван-дер-Ваальса
и идеального газа должна совпадать:
выражения
для внутренних энергий газа Ван-дер-Ваальса
и идеального газа должна совпадать:
![]() .
.
Использование выражения (2.21) для внутренней энергии идеального газа позволяет записать формулу, для расчета внутренней энергии газа Ван-дер-Ваальса в виде
|
(2.37) |
Из выражения (2.37) следует, что внутренняя энергия газа Ван-дер-Ваальса зависит не только от его температуры, но и от объема, занимаемого им, в отличие от идеального газа. Поэтому при осуществлении изотермических процессов в газе Ван-дер-Ваальса будет изменяться его внутренняя энергия, а, следовательно, при таких процессах подведенная к газу теплота не будет равна совершенной им работе.
Внутренняя энергия идеального газа определяется кинетической энергией его молекул. В отличие от этого для газа Ван-дер-Ваальса существенное значение имеет потенциальная энергия, обусловленная силами притяжения и отталкивания.
2.8. Эффект Джоуля – Томсона.
Согласно первому началу термодинамики изменение внутренней энергии газа может быть осуществлено либо сообщением ему теплоты, либо совершением над ним механической работы. Если при адиабатическом расширении газа не совершается механическая работа, то его внутренняя энергия остается неизменной. Для идеального газа неизменность внутренней энергии эквивалентна постоянству температуры газа, что было показано в опытах Гей-Люссака.
В экспериментах, проведенных Джоулем и Томсоном на реальных газах, было установлено, что при адиабатическом расширении их температура изменяется, причем может, как повышаться, так и понижаться. Это явление получило название эффекта Джоуля-Томсона.
В опыте использовалась теплоизолированная трубка, разделенная пористой перегородкой, по обе стороны от которой находился газ (рис. 2.4).
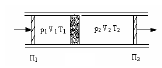
Рис. 2.4.
Газ под действием разности давлений медленно продавливался через перегородку, при помощи поршней П1, П2. До перегородки и после нее газ находился в термодинамически равновесных состояниях. Давление p1, p2 по разные стороны перегородки поддерживалось постоянным.
Исследования позволили открыть новое ранее не известное явление: если реальный газ под давлением протекает через дроссель – местное препятствие (пористую перегородку или отверстие небольшого диаметра) – то его температура изменяется. Это явление вошло в научно-техническую литературу под названием «эффект Джоуля-Томпсона».
В зависимости от начального состояния реального газа перед дросселем температура его при дросселировании может уменьшаться, увеличиваться и оставаться без изменений.
Точка, соответствующая начальному состоянию газа, при котором температура газа при адиабатическом дросселировании не изменяется, называется точкой инверсии. Температура, соответствующая этой точке, называется температурой инверсии. При температуре инверсии Ti газ при расширении не охлаждается и не нагревается.
При начальных температурах газа, которые меньше температуры инверсии, реальный газ при дросселировании будет охлаждаться, а при начальных температурах больше температуры инверсии - нагреваться. Объясняется этот эффект тем, что в силу закона сохранения энергии, уменьшение кинетической энергии реального газа равно приращению его потенциальной энергии. Если потенциальная энергия взаимодействия молекул реального газа при расширении возрастает, то его температура при этом падает. Если потенциальная энергия уменьшается, то его температура растет. В частности, для газа Ван-дер-Ваальса, если силы притяжения играют более существенную роль, чем силы отталкивания, то газ при расширении охлаждается, а если силы отталкивания превосходят силы притяжения, то его температура увеличивается.
Большинство газов, за исключением водорода и гелия, имеет довольно высокую температуру инверсии (600°С и выше), поэтому практически для всех газообразных веществ в области, близкой к критической, адиабатическое дросселирование приводит к понижению температуры.
Дайверам хорошо знаком эффект охлаждения газа при расширении. Именно этот эффект "повинен" в обмерзании регуляторов. При расширении воздуха (смесь азота, кислорода, углекислого газа и так далее) и перепаде давления по обе стороны дросселирующей перегородки 196 бар (бар – (греч. βάρος – тяжесть) – внесистемная единица измерения давления, равная 105 Н/м², то есть приблизительно равная давлению атмосферы), и начальной температуре 17°С температура газа снизиться на 35 градусов. Такого перепада температур достаточно, чтобы частицы влаги, плохо отфильтрованные в компрессоре, замерзли. Кристаллики льда покрывают внутренние механизмы регулятора, блокируя их.

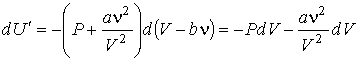 .
. .
.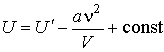 .
.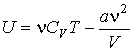 .
.