
- •Содержание
- •1.8.6. Описание явлений переноса в газах……………………………………………………37
- •2.2. Работа в термодинамике…………………………………………………………………..46
- •1. Молекулярно-кинетические представления
- •1.1. Число степеней свободы.
- •1.2. Температура и ее измерение.
- •1.3. Шкалы температур
- •1.4. Уравнение состояния идеального газа
- •1.5. Изопроцессы. Законы Бойля-Мариотта, Гей-Люссака, Шарля.
- •1.6. Закон Дальтона для смеси газов
- •1.7. Основные понятия классической и квантовой статистики
- •1.7.1. Барометрическая формула
- •1.7.2. Распределение Больцмана.
- •1.7.3. Распределение Максвелла.
- •1.7.4. Распределение Максвелла-Больцмана.
- •1.7.5. Опыт Штерна. Скорость частиц вещества
- •1.7.6. Уравнение состояния для газа Ван-дер Вальса.
- •1.8. Явления переноса.
- •1.8.1. Эффективный диаметр молекулы.
- •1.8.2. Средняя длина пробега молекул.
- •1.8.3. Диффузия.
- •1.5.4. Теплопроводность.
- •1.8.5.Вязкость или внутреннее трение
- •1.8.6. Описание явлений переноса в газах
- •2. Основи термодинаміки
- •2.1. Внутренняя энергия идеального газа
- •2.2. Работа в термодинамике.
- •2.3. Количество теплоты
- •2.4. Первое начало термодинамики. Применение для изопроцессов.
- •2.5. Теплоемкость идеального газа
- •2.6. Адиабатическое изменение объёма газа.
- •2.7. Внутренняя энергия газа Ван-дер-Ваальса
- •2.8. Эффект Джоуля – Томсона.
- •2.9. Тепловая машина. Холодильная машина. Кпд.
- •2.10. Цикл Карно. Идеальная тепловая машина
- •2.11. Второе начало термодинамики. Энтропия.
- •2.12. Третий закон термодинамики (тепловой закон Нернста)
- •3. Жидкое состояние
- •Строение жидкостей
- •Явления на границе раздела газа, жидкости и твердого тела
- •Явление смачивания и несмачивания
- •3.4. Давление под изогнутой поверхностью жидкости
- •Капиллярные явления.
- •Кристаллическое состояние
- •Кристаллические и аморфные тела
- •Кристаллическая решетка
- •Физические типы кристаллов
- •4.3. Дефекты кристаллического строения
- •4.4. Тепловое движение в кристаллах.
- •4.6. Теплоемкость кристаллов.
- •5. Фазовые равновесия и превращения
- •5.1. Испарение и конденсация
- •5.2. Насыщенные и ненасыщенные пары
- •5.3. Равновесие жидкости и насыщенного пара
- •5.4. Влажность.
- •5.5. Плавление и кристаллизация
- •5.6. Критическое состояние
- •5.6. Пересыщенный пар и перегретая жидкость. Метастабильное состояние вещества.
- •5.8. Уравнение Клапейрона –Клаузиуса
- •5.9. Диаграмма состояния. Тройная точка.
- •Литература
1.8.1. Эффективный диаметр молекулы.
Эффективный диаметр молекулы –
расстояние d, на которое
сближаются центры двух молекул при
столкновении. Обозначим
σ – эффективное сечение молекулы,
т.е. полное поперечное сечение
рассеяния,
характеризующее столкновение между
двумя молекулами (рис. 1.11). Здесь σ
– площадь, в которую
не может проникнуть центр любой другой
молекулы. Здесь
![]() – диаметр молекулы.
Площадь, ограниченную штриховой
окружностью на рис. 1.12, называют
эффективным сечением молекулы:
– диаметр молекулы.
Площадь, ограниченную штриховой
окружностью на рис. 1.12, называют
эффективным сечением молекулы:
![]() (1.55)
(1.55)
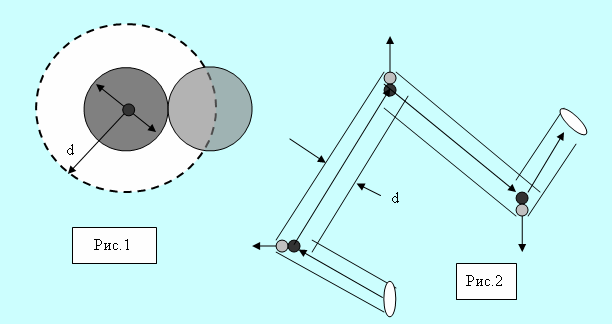
Рис. 1.11.
1.8.2. Средняя длина пробега молекул.
Средней длиной свободного пробега называется расстояние, проходимое молекулой в среднем без столкновений. Средняя длина свободного пробега равна:
![]() (1.56)
(1.56)
где ![]() – средняя скорость
теплового движения, τ – среднее время
между двумя столкновениями. Именно
– средняя скорость
теплового движения, τ – среднее время
между двумя столкновениями. Именно ![]() -
средняя длина свободного пробега нас
интересует (рис. 1.13)
-
средняя длина свободного пробега нас
интересует (рис. 1.13)
Рис. 1.12.
Медленность явлений переноса, например диффузии ароматических веществ – «распространение запаха», - при относительно высокой скорости теплового движения молекул (103 м/с) объясняется столкновениями молекул. Молекула газа время от времени сталкивается с другими молекулами. В момент столкновения молекула резко изменяет величину и направление скорости своего движения.
Модель идеального газа – твёрдые шарики одного диаметра, взаимодействующие между собой только при столкновении.
За одну секунду молекула проходит путь,
равный средней арифметической скорости ![]() .
За ту же секунду молекула претерпевает
ν столкновений. Следовательно,
.
За ту же секунду молекула претерпевает
ν столкновений. Следовательно,
![]() (1.57)
(1.57)
Подсчитаем число столкновений. Вероятность столкновения трех и более молекул бесконечно мала. Предположим, что все молекулы застыли, кроме одной. Её траектория будет представлять собой ломаную линию. Столкновения будут только с теми молекулами, центры которых лежат внутри цилиндра радиусом d (рис. 1.13).
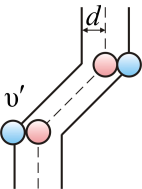
Рис. 1.13.
Путь, который пройдет
молекула за одну секунду, равен длине
цилиндра ![]() .
Умножим объём цилиндра
.
Умножим объём цилиндра ![]() на
число молекул в единице объёма n,
получим среднее число столкновений в
одну секунду:
на
число молекул в единице объёма n,
получим среднее число столкновений в
одну секунду:
![]() (1.58)
(1.58)
На самом деле, все молекулы движутся (и в сторону, и навстречу друг другу), поэтому число соударений определяется средней скоростью движения молекул относительно друг друга. По закону сложения случайных величин
![]() (1.59)
(1.59)
А так как средняя
длина свободного пробега
![]() то получим:
то получим:
![]() (1.60)
(1.60)
Уравнение состояния идеального газа позволяет нам выразить n через давление P и термодинамическую температуру Т.
Так как ![]() ,
то есть
,
то есть ![]() то
то
![]()
Таким образом, при заданной температуре средняя длина свободного пробега обратно пропорциональна давлению Р:
![]() .
(1.61)
.
(1.61)
Например, при d =
3 Å = 3×10-10 м, Р =
1 атм., Т =
300 К,![]() а,
т.к.
а,
т.к. ![]() ,
то
,
то ![]() столкновений.
столкновений.
