
- •30. Особенности протекания окислительных процессов в электропечах.
- •Растворимость углерода в железе
- •Общая термодинамическая характеристика реакции окисления углерода
- •Минимальное остаточное содержание углерода при плавке в открытых сталеплавильных агрегатах
- •Равновесные концентрации углерода и кислорода при глубоком обезуглероживании стали
- •Основные физико-химические свойства кремния
- •Общая термодинамическая характеристика реакции окисления кремния
- •Изменение содержания кремния в металле по ходу плавки
- •Основные принципы получения заданного содержания кремния в стали
- •Основные физико-химические свойства марганца
- •Общая термодинамическая характеристика реакции окисления марганца
- •Изменение содержания марганца в металле по ходу плавки
- •Основные принципы получения заданного содержания марганца в стали
- •Основные физико-химические свойства фосфора
- •Основные реакции дефосфорации металла
- •Поведение фосфора по ходу плавки
- •Основные принципы получения заданного содержания фосфора в стали
- •Окисление и восстановление хрома
- •Роль хрома в сталеплавильных процессах
- •Основные физико-химические свойства хрома
- •Общая термодинамическая характеристика реакции окисления хрома
- •Основы технологии глубокого обезуглероживания металла с высоким содержанием хрома
- •Основные принципы получения заданного содержания хрома в стали
Основные физико-химические свойства фосфора
Чистый фосфор (белый) имеет температуру плавления 44оС и температуру кипения 280оС. В жидком железе фосфор обладает неограниченной растворимостью.
Изменение энергии Гиббса реакции
![]()
можно рассчитать согласно уравнению
![]()
Анализ диаграммы состояния системы Fe-P показывает, что, взаимодействуя с железом, фосфор образует ряд фосфидов, наиболее устойчивым из которых является Fe2P. Тепловой эффект реакции образования этого фосфида составляет 144,6 кДж/моль, что практически соответствует тепловому эффекту растворения фосфора в железе. В связи с этим наиболее вероятной формой существования фосфора в расплавах железа считают группировки атомов, близкие по составу к химическому соединению Fe2P.
Обладая переменной валентностью, фосфор при взаимодействии с кислородом образует ряд соединений. При температурах сталеплавильных процессов наиболее устойчивым из них является P2O5. Пентаоксид фосфора имеет температуру плавления 569оС и температуру кипения 590оС. Вследствие низкой температуры кипения в жидком шлаке P2O5 может находиться только в виде химических соединений, температура кипения которых выше температуры ванны. В основных сталеплавильных шлаках такими соединениями являются фосфаты железа и кальция.
Основные реакции дефосфорации металла
По ходу плавки основное количество фосфора окисляется по реакции
![]()
Однако, при температурах сталеплавильных процессов P2O5 в чистом виде находиться в шлаке не может. Для дефосфорации металла необходимо образование в шлаке прочных фосфатов.
При низких температурах начала плавки в основных шлаках возможно образование фосфатов железа по реакции
![]()
Об этом свидетельствует, например, опыт основного мартеновского процесса. В начале плавки, когда температура ванны не превышает 1450оС, при основности шлака менее 1 и содержании оксидов железа 25 – 30% и более коэффициент распределения фосфора между шлаком и металлом может превышать 100.
Но при температурах заключительного периода плавки фосфаты железа не устойчивы. Например, при 1600оС коэффициент распределения фосфора между шлаком, состоящим в основном из оксидов железа, и металлом уменьшается до 1 – 3. В этих условиях, чтобы избежать рефосфорации необходимо связать P2O5 в более устойчивые соединения. В основных сталеплавильных шлаках такими соединениями являются фосфаты кальция 3CaO*P2O5, а при высокой основности шлака – 4CaO*P2O5
![]()
Результатом последовательного протекания реакций (15.3) – (15.5) является процесс дефосфорации, который может быть описан уравнением реакции
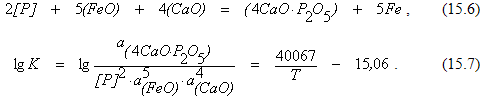
Так как численные значения активности (4CaO*P2O5) и (CaO) часто не известны, в последнее время получили распространение различные эмпирические соотношения, которые вместо истинной величины константы равновесия реакции позволяют рассчитать значения коэффициентов распределения, в которых концентрации взаимодействующих веществ выражены в массовых процентах. Примером могут служить соотношения
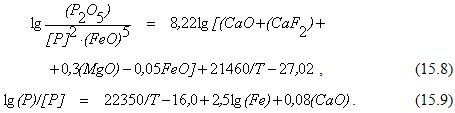
Из уравнения (15.7) видно, что реакция дефосфорации относится к числу сильных экзотермических реакций. Поэтому с точки зрения термодинамики протеканию ее в направлении образования фосфата кальция должны способствовать низкие температуры начального периода плавки (практика термического удара).
Однако
влияние температуры на величину
коэффициента распределения фосфора
между шлаком и металлом заключается
также и в том, что высокие значения
коэффициента распределения фосфора
между шлаком и металлом (![]() )
достигаются только при высокой основности
шлака. Получение гомогенных шлаков с
высоким содержанием CaO возможно только
при высокой температуре ванны. Поэтому,
если использовать повышение температуры
для получения высокоосновных шлаков,
дефосфорацию металла во второй половине
плавки можно провести не менее эффективно,
чем в начале ее. Опыт показывает, что
для эффективной дефосфорации металла
основность шлака в мартеновской плавке
без продувки ванны кислородом должна
составлять 2,5 – 2,8, а в кислородно-конвертерном
процессе с верхней подачей дутья – 3,0
– 3,5.
)
достигаются только при высокой основности
шлака. Получение гомогенных шлаков с
высоким содержанием CaO возможно только
при высокой температуре ванны. Поэтому,
если использовать повышение температуры
для получения высокоосновных шлаков,
дефосфорацию металла во второй половине
плавки можно провести не менее эффективно,
чем в начале ее. Опыт показывает, что
для эффективной дефосфорации металла
основность шлака в мартеновской плавке
без продувки ванны кислородом должна
составлять 2,5 – 2,8, а в кислородно-конвертерном
процессе с верхней подачей дутья – 3,0
– 3,5.
Характер совместного влияния содержания CaO и FeO в шлаке на величину коэффициента распределения фосфора поясняется рисунком 15.1. Из рисунка видно, что при высокой основности шлака коэффициент распределения фосфора между шлаком и металлом может превышать 300. Это означает, что при высоких температурах дефосфорация металла может быть не менее эффективной, чем при использовании теплового удара.
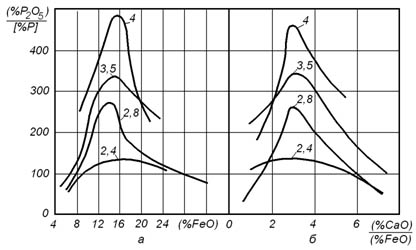
Рисунок 15.1 – Зависимость величины коэффициента распределения фосфора между шлаком и металлом от содержания FeO и отношения (CaO)/(FeO). Цифры у кривых – основность шлака B=(CaO)/(SiO2)
Вместе с тем наиболее высокие значения коэффициента распределения фосфора достигаются в узком диапазоне составов шлака – 14 – 17% (FeO) и (CaO)/(FeO) = 3.
