
- •71. Схема проведения, достоинства и недостатки рентгено-абсорбционного анализа.
- •72. Физические основы молекулярной спектроскопии поглощения уф- и видимого диапазона.
- •72. Физические основы молекулярной спектроскопии поглощения уф- и видимого диапазона.
- •73. Хромофорные и ауксохромные группы. Гипсохромный и батохромный сдвиги. Гипо- и гиперхромный эффекты
- •74. Вид и основные характеристики молекулярных спектров поглощения уф- и видимого диапазона.
- •76. Основные положения количественного фотометрического анализа.
- •77.Типы отклонений закона светопоглощения от линейности и их причины.
- •78.Метод Фирордта.
- •79.Метод Аллена.
- •80.Аналитические применения фотометрии.
- •81.Физические основы ик-спектроскопии. Типы колебаний в молекулах. Зависимость положения спектральной полосы поглощения от типа колебаний, вида атомов и др. Особенностей строения молекул.
- •82. Скелетные колебания и колебания характеристических групп.
- •83.Типичный вид ик - спектра сложного органического вещества. Основные характеристики ик - спектров.
- •84.Подготовка образцов в ик - спектроскопии.
- •85.Особенности конструкции ик - спектрометров.
- •86. Порядок идентификации веществ по их ик- спектрам.
- •87.Использование ик-спектроскопии для определения молекулярной структуры неизвестного вещества.
- •88.Использование ик-спектроскопии для количественного анализа и анализа смеси веществ.
- •89.Физические основы люминесцентного метода. Виды люминесценции и способы ее возбуждения.
- •90. Схема возбуждения и эмиссии люминесцентного излучения.
- •91. Взаимосвязь спектров поглощения и люминесценции. Правило Стокса, закон Стокса-Ломмеля.
- •92. Квантовый и энергетический выход люминесценции. Закон Вавилова.
- •93 Вид спектров люминесценции и их основные характеристики.
- •94. Зависимость интенсивности люминесценции от конц. Люминесцируемого вещества, температуры, рН, примесей.
- •95. Гашение флуоресценции
- •96.Прямой флуоресцентный анализ.
- •97. Косвенный флуоресцентный анализ.
- •98.Аппаратура и практическое применение люминесцентного анализа.
- •99. Схема и принцип действия фотометра люминесцентного.
71. Схема проведения, достоинства и недостатки рентгено-абсорбционного анализа.
Анализ по спектрам поглощения рентгеновского излучения.






1 2 3 4 5
Анализируемая проба 2 в виде плоскопараллельной пластинки устанавливается на пути потока рентгеновского излучения от источника 1(рентгеновская трубка или радиоактивный источник) с непрерывным или линейчатым спектром, кванты которого имеют большую энергию, чем энергия краёв поглощения элементов, определяемых в пробе.
Излучение, прошедшее через образец, разлагается в спектр анализатором 3. Из разложенного в спектр излучения выбираются аналитические линии определяемого элемента, которые попадают на приемник излучения 4 и далее регистрируется электрической схемой 5.
Для определения концентрации каждого элемента интенсивность их спектральных линий измеряется дважды: до введения пробы в поток излучения источника и с пробой. Затем определяется оптическая плотность, по которой при соответствующей калибровке прибора (по эталонам) определяется искомая концентрация.
Этап атомизации пробы отсутствует.
72. Физические основы молекулярной спектроскопии поглощения уф- и видимого диапазона.
При образовании молекул из атомов внешние атомные орбитали перестраиваются, изменяются их энергетические уровни, образуются молекулярные орбитали. При этом для упрощения считается, что внутренние электроны атомов и внешние электроны, не участвующие в образовании связей, сохраняют ту же энергию, что и в индивидуальном атоме.
В органических соединениях различают два типа электронов, ответственных за поглощение видимого и УФ-излучения:
- непосредственно участвующие в образовании связи, таким образом связанные более чем с одним атомом;
- несвязывающие внешние электроны, локализованные большей частью у атомов таких элементов как кислород, галогены, сера и тд.
В зависимости от характера исходных атомных орбиталей, могут образовываться молекулярные орбитали π- и σ-типа. σ-Связями называются связи, которые имеют цилиндрическую симметрию относительно линии, соединяющей атомы. π-Связи – это связи, симметричные относительно плоскости, проходящей ч/з линию, соединяющую центры атомов
При отсутствии внешнего воздействия максимум электронной плотности в π- и σ-связях находится м-ду ядрами, стягивая их. Такие орбитали наз-ся связывающими.
Атомные орбитали, не принимающие участие в образовании связей, т.е. орбитали так называемых п-электронов, называются несвязывающими n-орбиталями.
При поглощении эл.маг. излучения УФ– и видимого диапазона могут происходить электронные переходы со связывающих π- и σ-орбиталей и несвязывающих n-орбиталей на разрыхляющие π*- и σ*-орбитали.
+В
А +
+
 σ σ*
σ σ*
 Е
Е
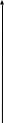
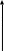 σ*-орбиталь
σ*-орбиталь
 π*-
орбиталь
π*-
орбиталь
n- σ* n- π*
n- орбиталь
π- π* π- орбиталь
σ-σ σ-орбиталь
Электронные переходы со связывающей π- орбитали на разрыхляющую π*- орбиталь происходит при поглощении меньшей, но всеже достаточно большой энергии, и соответствующие спектральные линии наблюдаются в области среднего УФ. n- π* и n- σ* переходы могут происходить при поглощении еще меньших квантов и наблюдаться в области ближнего УФ.
Вид типичных спектров поглощения в УФ- и видимых областях представлены ниже. D- оптическая плотность; Т- пропускание;
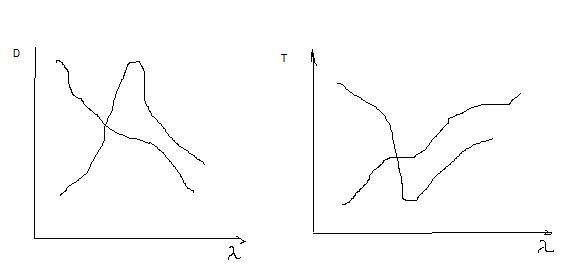
Поскольку поглощаемая энергия приводит к изменению не только электронного, но и колебательного и вращательного состояния молекул, наблюдаемые спектры поглощения представляют собой широкие полосы с одним или несколькими максимумами в непрерывной области поглощения либо несколькими максимумами в различных областях, разделенных областями пропускания.
Полосы поглощения в электронном спектре характеризуется длиной волны и интенсивностью, измеряемыми в максимуме. Положение полосы на шкале длин волн определяется разностью энергий состояний, м-ду которыми происходит переход. Интенсивность полосы поглощения оценивается вероятностью такого перехода. Преимущество использования молярного коэффициента как меры интенсивности поглощения состоит в том, что интенсивность относится к одному и тому же числу поглощающих частиц.
Многочисленные опыты показали, что для определенных рядов соединений, содержащих одни и те же структурные фрагменты, характерные полосы поглощения наблюдаются в определенной области. Такие структурные фрагменты молекулы, как правило ковалентно ненасыщенные группировки атомов, обусловливающие электронное поглощение, например, С=С, С=О, и др. называют хромофорами. Атомы или группы атомов присоединение которых к хромофорной с-ме приводит как к смещению характерной для хромофора полосы, так и к изменению поглощения, называют оксохромами. Полоса поглощения хромофорной группы может сместиться не только в зависимости от внутримолекулярного окружения, но и от растворителя.
